人參皂苷Rb1通過上調(diào)P53和P21抑制PDGF-BB誘導(dǎo)的大鼠主動(dòng)脈平滑肌細(xì)胞增殖
李 蓉,鐘益剛,錢 康
0 引言
動(dòng)脈粥樣硬化(Atherosclerosis,AS)是急性心肌梗死、心衰、卒中等心腦血管疾病的最主要發(fā)病原因。AS發(fā)生的原因是內(nèi)皮細(xì)胞受到損傷,細(xì)胞表面的粘附分子被激活后,導(dǎo)致血液中的單核細(xì)胞、T淋巴細(xì)胞和巨噬細(xì)胞等免疫細(xì)胞吸附于內(nèi)皮,最后滲入血管內(nèi)膜[1]。還有一個(gè)重要原因就是血管中膜的平滑肌細(xì)胞(Smooth muscle cells,SMCs)大量增殖并侵入血管內(nèi)膜[2]。最終發(fā)生一系列的免疫反應(yīng)和炎癥反應(yīng),使得血管內(nèi)膜增厚,而血管管腔狹窄。而平滑肌遷移和增殖的一個(gè)重要因素是血小板源性生長(zhǎng)因子(Platelet-derived growth factor,PDGF)。其不僅能夠?qū)ζ交〖?xì)胞、成纖維細(xì)胞和中性粒細(xì)胞產(chǎn)生趨化作用,使得這些細(xì)胞遷移到內(nèi)膜,還能夠促進(jìn)血管平滑肌細(xì)胞的分裂和增殖[3]。因此,PDGF在AS的形成過程中發(fā)揮著至關(guān)重要的作用。如果能夠?qū)够蛘咭种芇DGF誘導(dǎo)的平滑肌細(xì)胞增殖,就可以減緩內(nèi)膜增厚的進(jìn)程,甚至可以預(yù)防和減緩AS的發(fā)生和發(fā)展,最終降低心腦血管疾病的發(fā)病率和死亡率。
人參皂苷Rb1(Rb1)是一種提取于人參、田七等名貴中藥的皂苷類化合物。Rb1對(duì)機(jī)體多個(gè)系統(tǒng)均有復(fù)雜的生物學(xué)效應(yīng)。在心血管系統(tǒng)方面,具有保護(hù)血管內(nèi)皮細(xì)胞和預(yù)防AS的作用[4]。然而,Rb1能否對(duì)抗或者抑制PDGF誘導(dǎo)的血管平滑肌增殖并不完全明確。因此,本研究選擇Rb1作為干預(yù)因素,通過體內(nèi)外試驗(yàn)來探討Rb1對(duì)大鼠主動(dòng)脈血管平滑肌(Rat aortic smooth muscle cells,RASMCs)增殖的影響及可能的機(jī)制。
1 材料與方法
1.1 主要材料 人參皂苷Rb1(上海經(jīng)科化學(xué)科技有限公司);PDGF-B(Sigma);DMEM(Hyclone);胎牛血清(Hyclone);MTT(Sigma);DMSO(BD公司);P53、P21、CDK2、CyclinE和PCNA單抗購(gòu)于上海朗頓生物科技有限公司;小鼠α-SM-actin單抗、鏈霉親和素-生物素試劑盒(上海碧云天公司);Annexin V-FITC凋亡檢測(cè)試劑盒、細(xì)胞周期檢測(cè)試劑(百奇生物科技有限公司);SD大鼠25只(南京斯科瑞生物科技有限公司)。
1.2 細(xì)胞培養(yǎng) RASMCs取自SD大鼠胸主動(dòng)脈,按照陳雄林等[5]方法進(jìn)行RASMCs原代培養(yǎng)。細(xì)胞傳到第3代后,用于后續(xù)實(shí)驗(yàn)。使用含10%FBS的DMEM培養(yǎng)基進(jìn)行培養(yǎng)(37 ℃,5%CO2濕潤(rùn)培養(yǎng)環(huán)境)。并加入100 U/mL青霉素、100 μg/mL鏈霉素防止細(xì)菌污染。α-SM-actin檢測(cè)對(duì)RASMCs進(jìn)行鑒定和純度分析。
1.3 MTT實(shí)驗(yàn) 用于檢測(cè)PDGF-BB誘導(dǎo)RASMCs增殖的情況和Rb1抑制PDGF-BB誘導(dǎo)的RASMCs增殖作用。PDGF-BB誘導(dǎo)增殖試驗(yàn)分組(終濃度):0、2、4、8、16、32 ng/mL共6組。每孔接種細(xì)胞濃度為5×104/mL的細(xì)胞懸液200 μL,培養(yǎng)24 h后換成無血清培養(yǎng)基200 μL。每組設(shè)置6個(gè)復(fù)孔,加入PDGF-BB后選擇24 h和48 h兩個(gè)檢測(cè)時(shí)間點(diǎn)。加入MTT后繼續(xù)培養(yǎng)4 h,取上清液加入200 μL DMSO充分溶解,結(jié)晶后,于492 nm波長(zhǎng)檢測(cè)OD值作生長(zhǎng)曲線圖。Rb1抑制PDGF-BB誘導(dǎo)的RASMCs增殖試驗(yàn)分組:0(對(duì)照組)、20、40、80 μg/mL組。每孔接種細(xì)胞濃度為5×104/mL的細(xì)胞懸液200 μL,培養(yǎng)24 h后換成含Rb1無血清培養(yǎng)基200 μL。設(shè)置6個(gè)復(fù)孔,作用24 h。過程同上述MTT操作。結(jié)果計(jì)算公式:細(xì)胞活力=(Rb1作用組/對(duì)照組)×100%。
1.4 Annexin V-FITC/PI法檢測(cè)細(xì)胞凋亡 用于檢測(cè)Rb1對(duì)PDGF-BB誘導(dǎo)增殖的RASMCs凋亡的影響。將細(xì)胞分成4組:PDGF-BB組、PDGF-BB+20 μg/mL組、PDGF-BB+40 μg/mL組、PDGF-BB+80 μg/mL組。于6孔板中接種5×104/mL的細(xì)胞懸液(無血清培養(yǎng)基)2 L。PDGF-BB終濃度為16 ng/mL。Rb1先作用24 h,再加入PDGF-BB刺激24 h后消化收集細(xì)胞于10 mL離心管,離心(1 000 r/min,5 min)洗滌2遍后1 mL PBS重懸細(xì)胞,加入FITC-Annexin V和PI各100 μL。室溫避光孵育10 min,上流式細(xì)胞儀檢測(cè)。
1.5 流式細(xì)胞術(shù)測(cè)細(xì)胞周期 用于檢測(cè)Rb1對(duì)PDGF-BB誘導(dǎo)增殖的RASMCs周期的影響。細(xì)胞分組:對(duì)照組(不加藥)、PDGF-BB組、80 μg/mL組、PDGF-BB+20 μg/mL組、PDGF-BB+40 μg/mL組、PDGF-BB+80 μg/mL組。具體操作:于6孔板中接種5×104/mL的細(xì)胞懸液(無血清培養(yǎng)基)2 L。PDGF-BB終濃度為16 ng/mL。Rb1先作用24 h,再加入PDGF-BB刺激24 h后消化收集細(xì)胞,離心(1 000 r/min,5 min)洗滌2遍后用70%冰乙酸重懸細(xì)胞,-20 ℃固定過夜。PBS洗滌1次,去上清加入300 μL DNA染液(含碘化丙啶100 mg/L、RNA酶2×104U/L)37 ℃避光染色30 min,然后PBS洗滌2次,上流式細(xì)胞儀檢測(cè)細(xì)胞周期。
1.6 Western blot 用于檢測(cè)Rb1作用PDGF-BB誘導(dǎo)增殖的RASMCs后,PNCA、CDK2、CyclinE、P53和P21的蛋白表達(dá)情況。分組同“1.5”項(xiàng)下分組方法,Rb1先作用24 h,再加入PDGF-BB刺激24 h。各種抗體濃度分別為:PNCA(1∶1 000)、CDK2(1∶1 000)、CyclinE(1∶1 000)、P53(1∶1 000)、P21(1∶1 200)。具體操作如下:將細(xì)胞消化收集于離心管中,離心洗滌2遍,加入裂解液置于4 ℃冰箱1 h后12 000 r/min離心10 min。吸取上清液測(cè)蛋白濃度。然后取等量蛋白質(zhì)溶液行SDS-PAGE電泳,獲取蛋白質(zhì)凝膠條后轉(zhuǎn)印到硝酸纖維薄膜。牛奶封閉后加入相應(yīng)的單抗搖晃孵育2 h。PBS洗滌孵育單抗的膜條3遍,然后結(jié)合HRP-二抗。最后曝光、顯影、定影和掃描條帶分析光密度。
1.7 動(dòng)物模型 頸動(dòng)脈球囊損傷的SD大鼠模型建造參照張紓等[6]的造模方法。水合氯醛麻醉大鼠,固定后頸前正中切開,分離右頸總動(dòng)脈和頸外動(dòng)脈,經(jīng)頸外動(dòng)脈插入2F球囊導(dǎo)管,注入生理鹽水使球囊充盈后緩慢來回推拉球囊導(dǎo)管3次。回抽生理鹽水后縫合傷口即可。大鼠分組:正常組、損傷非治療組、低劑量治療組[10 mg/(kg·d)]和高劑量治療組[30 mg/(kg·d)]。采取腹腔注射方式持續(xù)給藥14 d。
1.8 形態(tài)學(xué)觀察和免疫組化分析 用于觀察Rb1治療大鼠頸動(dòng)脈球囊損傷后的血管形態(tài)改變,分析血管內(nèi)膜PCNA、P53和P21的變化。處死大鼠后,切取損傷部位頸動(dòng)脈,置于10%的甲醛中。制作成4 μm切片后,使用HE染色法染色觀察。隨機(jī)選取每只大鼠的3張切片,測(cè)量血管管腔面積和內(nèi)膜面積,并計(jì)算平均值,作為該只大鼠的血管形態(tài)學(xué)計(jì)量指標(biāo)(使用Image-Pro Plus軟件)。免疫組化抗體工作濃度:PCNA(1∶200)、P53(1∶100)、P21(1∶100)。切片經(jīng)脫蠟至水后用上述抗體置于37 ℃孵育30 min進(jìn)行結(jié)合。然后按照鏈霉親和素-生物素試劑盒說明進(jìn)行操作,最后蒸餾水沖洗、復(fù)染、脫水、透明、封片鏡下觀察。
2 結(jié)果
2.1 RASMCs的鑒定 RASMCs經(jīng)免疫熒光檢測(cè),α-SM-actin顯示紅色,形成的纖維與細(xì)胞縱軸平行(見圖1,黃色箭頭)。細(xì)胞核經(jīng)DAPI染色后顯示藍(lán)色(見圖1,白色箭頭)。隨機(jī)5個(gè)視野計(jì)數(shù)200個(gè)細(xì)胞,數(shù)3次。細(xì)胞無顯示紅色α-SM-actin為陰性細(xì)胞。結(jié)果顯示RASMCs純度達(dá)(95±1.4)%。
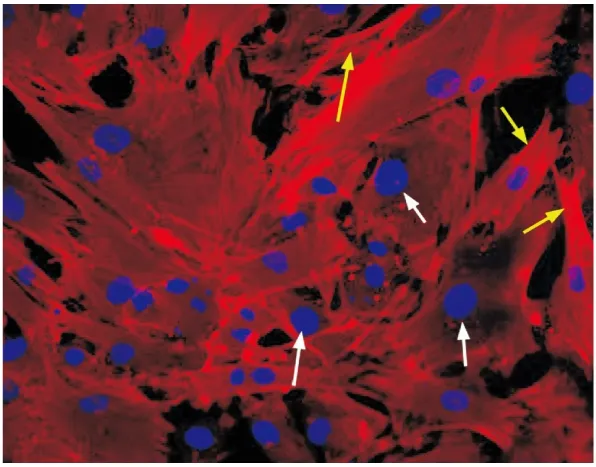
圖1 RASMCs免疫熒光分析(×200)
2.2 PDGF-BB誘導(dǎo)RASMCs增殖具有時(shí)間劑量依賴性 設(shè)置對(duì)照組、PDGF-BB組(2、4、8、16、32 ng/mL)共6組。作用RASMCs 24 h和48 h后,應(yīng)用MTT法檢測(cè)OD值。結(jié)果顯示,隨著PDGF-BB濃度的增加,細(xì)胞活力越來越高,與對(duì)照組(0 ng/mL)相比有顯著提高(P<0.05,見圖2)。而同一個(gè)濃度的不同時(shí)間點(diǎn)比較,發(fā)現(xiàn)48 h細(xì)胞活力高于24 h細(xì)胞活力(P<0.05,見圖2)。表明PDGF-BB誘導(dǎo)RASMCs增殖具有時(shí)間和劑量的依賴性。
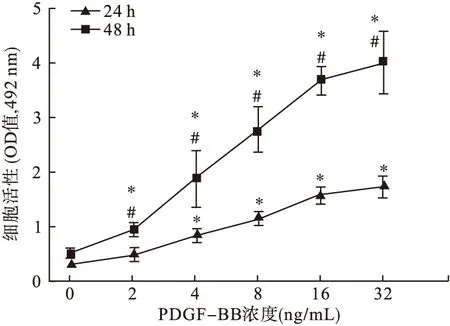
圖2 PDGF-BB對(duì)RASMCs增殖的影響
2.3 Rb1能夠抑制PDGF-BB誘導(dǎo)的RASMCs增殖 選擇16 ng/mL的PDGF-BB作為RASMCs的增殖誘導(dǎo)濃度。Rb1分4個(gè)濃度組:0(對(duì)照組)、20、40、80 μg/mL。Rb1先作用24 h,再加入PDGF-BB刺激24 h后MTT法檢測(cè)并統(tǒng)計(jì)分析發(fā)現(xiàn),Rb1作用組細(xì)胞活力均比對(duì)照組低(P<0.05,見圖3)。而且Rb1高濃度組比低濃度組細(xì)胞活力低(P<0.05)。表明Rb1能夠抑制PDGF-BB誘導(dǎo)的RASMCs增殖,并且具有濃度劑量依賴性。另外,增殖細(xì)胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)是反映細(xì)胞增殖的指標(biāo)。通過檢測(cè)PCNA可以評(píng)價(jià)細(xì)胞增殖情況。本試驗(yàn)檢測(cè)PCNA發(fā)現(xiàn),隨著Rb1濃度增高,PCNA表達(dá)量逐漸減少,并且有劑量依賴性(P<0.05,見圖4)。總之,Rb1能夠明顯抑制RASMCs增殖。
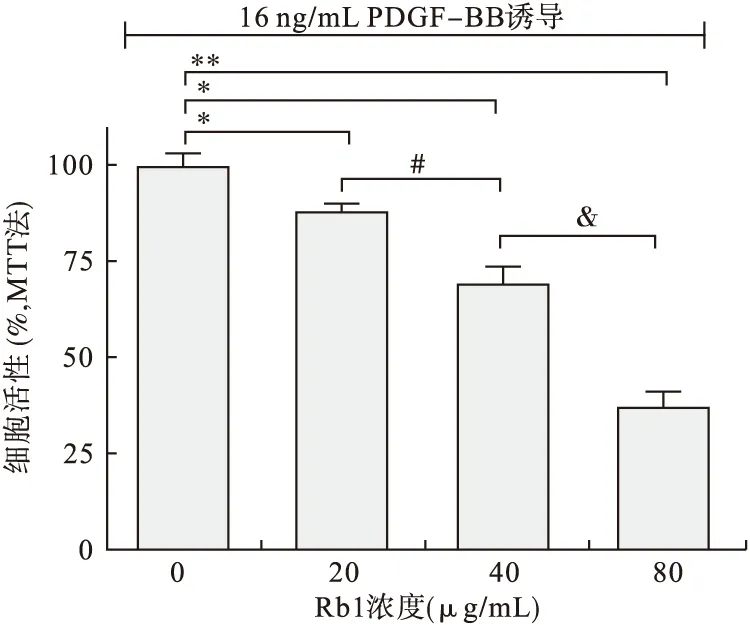
圖3 Rb1對(duì)PDGF-BB誘導(dǎo)的RASMCs增殖的抑制作用
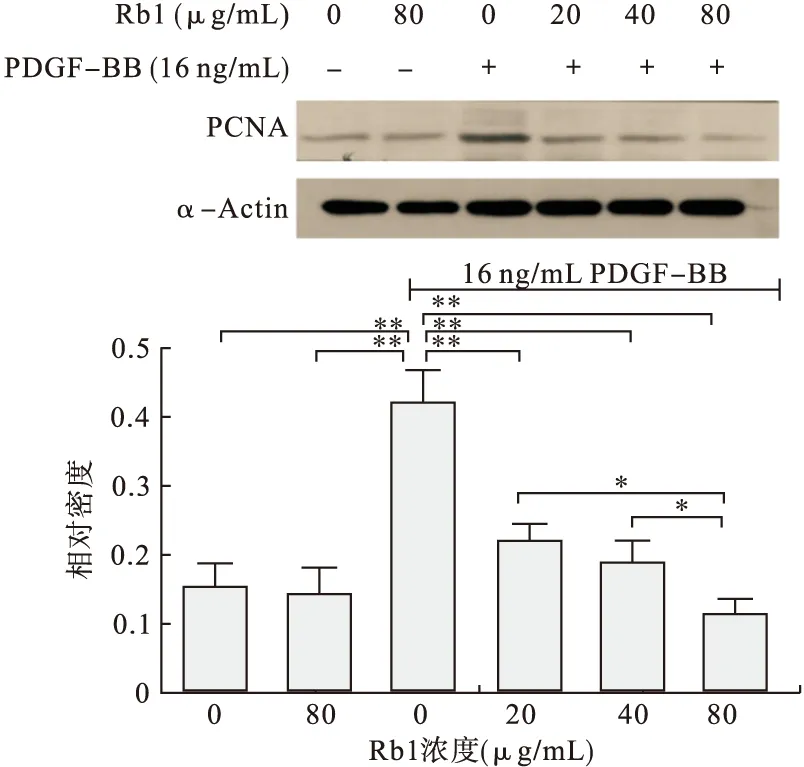
圖4 Rb1對(duì)RASMCs的PCNA表達(dá)的影響
2.4 Rb1誘導(dǎo)RASMCs的凋亡作用不明顯 選擇16 ng/mL的PDGF-BB作為RASMCs的增殖誘導(dǎo)濃度,Rb1分組同“2.3”。作用24 h后流式檢測(cè)細(xì)胞凋亡率。結(jié)果顯示,4組的細(xì)胞凋亡率(早晚期)分別為:(3.2±0.3)%、(3.0±0.2)%、(4.3±0.4)%和(2.9±0.2)%。各個(gè)組間凋亡率比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05,見圖5)。結(jié)合“2.3”項(xiàng)的結(jié)果,說明Rb1能夠抑制RASMCs增殖,但不誘導(dǎo)細(xì)胞凋亡。
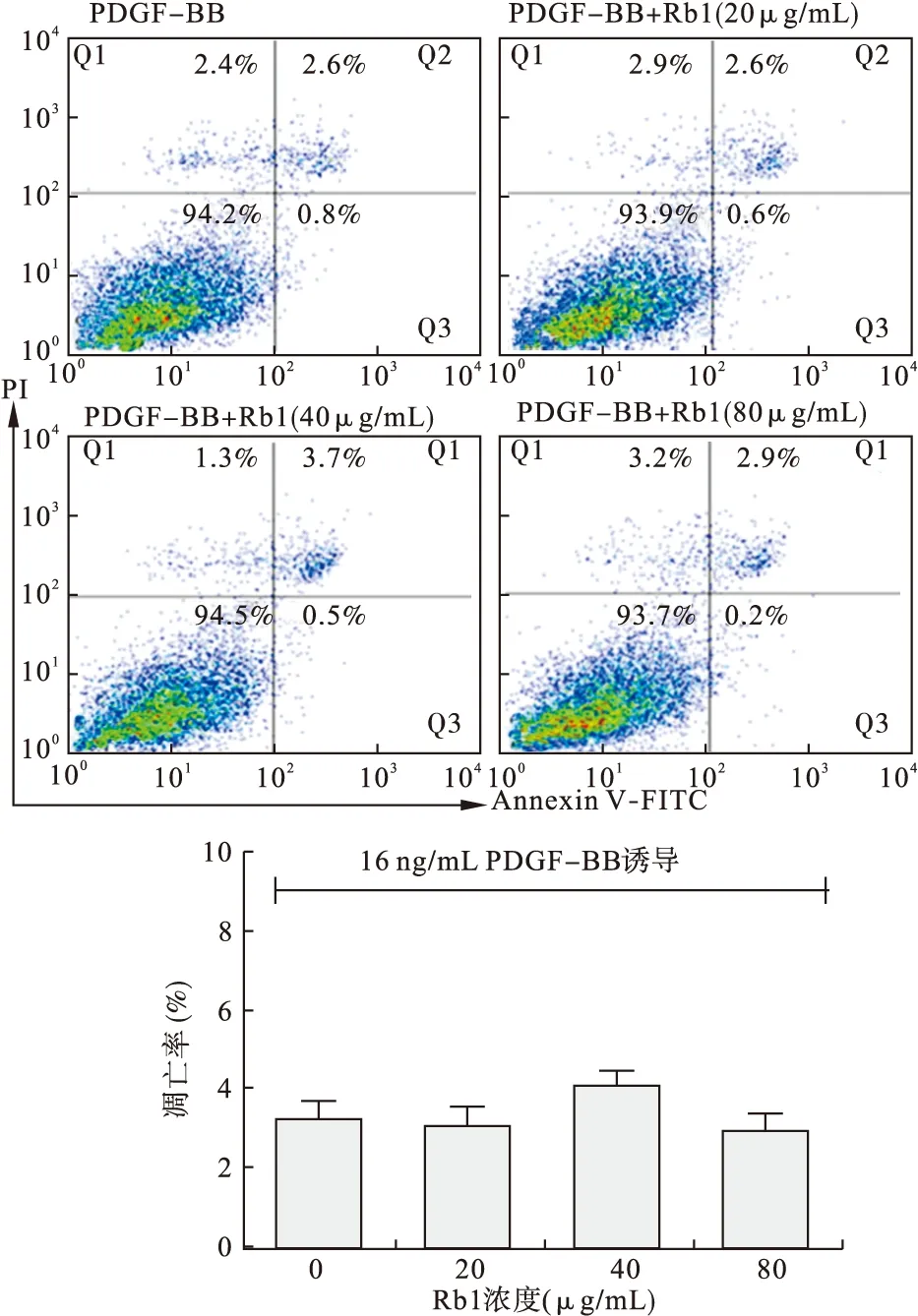
圖5 Rb1對(duì)RASMCs凋亡的影響
2.5 Rb1對(duì)PDGF-BB誘導(dǎo)增殖的RASMCs細(xì)胞周期的影響 將細(xì)胞分成6組:對(duì)照組(不加任何藥物)、Rb1(80 μg/mL)組、PDGF-BB組、PDGF-BB+Rb1(20 μg/mL)組、PDGF-BB+Rb1(40 μg/mL)組、PDGF-BB+Rb1(80 μg/mL)組,Rb1先作用24 h,再加入PDGF-BB刺激24 h。流式細(xì)胞術(shù)檢測(cè)細(xì)胞周期分布。結(jié)果顯示,單藥Rb1對(duì)細(xì)胞周期影響不明顯(見圖6-b);PDGF-BB能夠增加S期和G2/M期細(xì)胞比例(見圖6-c);隨著Rb1的濃度增加,S期細(xì)胞逐漸減少,而G0/G1期細(xì)胞逐漸增加(見圖6-d、e、f)。綜上,PDGF-BB能夠誘導(dǎo)細(xì)胞進(jìn)入增殖旺盛的S期和G2/M期,而Rb1能夠抑制PDGF-BB的這種作用,使細(xì)胞阻滯于G0/G1期。
2.6 Rb1對(duì)PDGF-BB誘導(dǎo)增殖的RASMCs的CDK2和CyclinE的影響 細(xì)胞周期蛋白依賴性激酶2(Cyclin-dependent kinases 2,CDK2)和CyclinE是細(xì)胞由G1期進(jìn)入S期的關(guān)鍵蛋白。通過檢測(cè)這兩個(gè)蛋白的表達(dá),可以了解Rb1在蛋白水平對(duì)RASMCs周期的影響。結(jié)果顯示,PDGF-BB誘導(dǎo)增殖后CDK2和CyclinE的表達(dá)上調(diào)。當(dāng)Rb1作用后,CDK2和CyclinE的表達(dá)受到抑制,且具有一定的劑量依賴性(P<0.05,見圖7)。
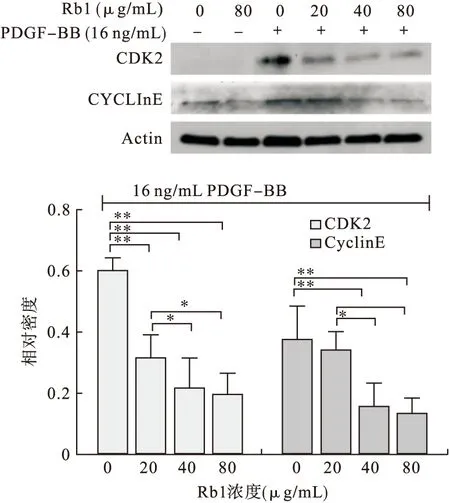
圖7 Rb1對(duì) RASMCs的CDK2和CyclinE表達(dá)的影響
2.7 Rb1對(duì)PDGF-BB誘導(dǎo)增殖的RASMCs的P53和P21的影響 P53和P21均為細(xì)胞增殖相關(guān)信號(hào)通路的重要蛋白分子,可以抑制細(xì)胞增殖,并且處于CDK2、CyclinE的上游。Rb1作用PDGF-BB誘導(dǎo)增殖的RASMCs后,CDK2、CyclinE明顯下調(diào)。因此,本試驗(yàn)探討Rb1是否作用P53、P21而導(dǎo)致CDK2、CyclinE下調(diào)。結(jié)果顯示,與0 μg/mL組比較,P53和P21均有不同程度的上調(diào)(P<0.05,見圖8)。因此,可認(rèn)為Rb1上調(diào)P53、P21后使得細(xì)胞增殖受到抑制。
2.8 Rb1對(duì)球囊損傷導(dǎo)致的大鼠頸動(dòng)脈內(nèi)膜增厚的影響 將大鼠分成4組:正常組、非治療組、低劑量治療組[10 mg/(kg·d)]和高劑量治療組[30 mg/(kg·d)]。治療14 d后,測(cè)量頸動(dòng)脈管腔面積和內(nèi)膜面積。與非治療組比較,治療組的管腔面積顯著增加,內(nèi)膜面積減小(P<0.01)。見表1。此外,蘇木精-曙紅染色后顯微鏡觀察直觀可見非治療組管腔明顯狹窄和內(nèi)膜增厚,治療后管腔變寬和內(nèi)膜變薄。見圖9。
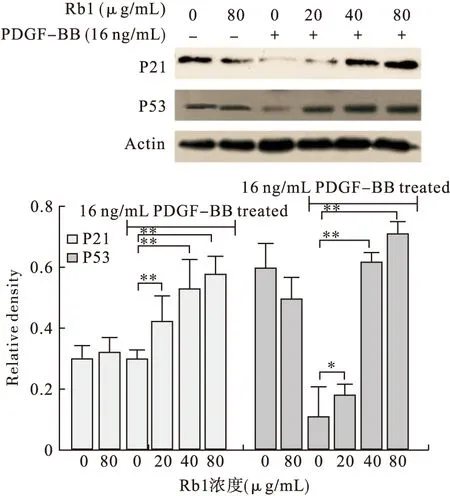
圖8 Rb1對(duì) RASMCs的P53和P21表達(dá)的影響

表1 Rb1治療后比較球囊損傷的頸動(dòng)脈內(nèi)膜相關(guān)形態(tài)計(jì)量指標(biāo)(mm2)
2.9 Rb1治療后PCNA、P53和P21在大鼠頸動(dòng)脈內(nèi)膜的表達(dá)情況 免疫組化法檢測(cè)損傷非治療組、低劑量治療組和高劑量治療組大鼠頸動(dòng)脈的PCNA、P53和P21的表達(dá)。結(jié)果顯示,低、高劑量治療組(圖10-B、C)的PCNA表達(dá)低于非治療組(圖10-A);而P53和P21的表達(dá)高于非治療組。見圖10。此結(jié)果與體外實(shí)驗(yàn)結(jié)果(Western blot法檢測(cè))相類似。
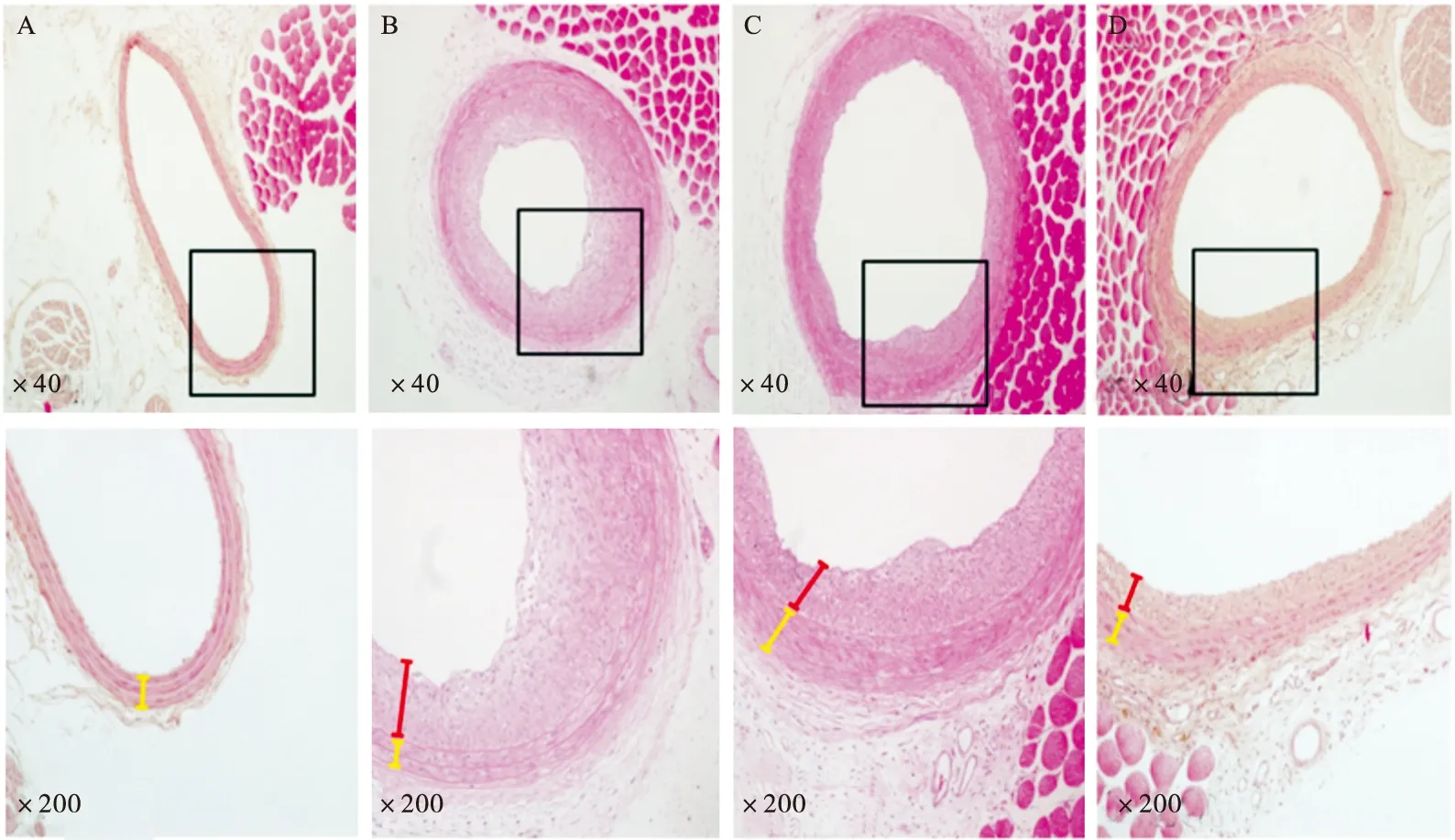
圖9 Rb1治療后球囊損傷的頸動(dòng)脈形態(tài)學(xué)觀察
3 討論
血管平滑肌細(xì)胞(Vascular smooth muscle cells,VSMCs)異常增殖是AS發(fā)生的關(guān)鍵因素之一。而在VSMCs異常增殖的過程中,PDGF-BB又起到非常重要的作用。PDGF-BB是一種最有效的細(xì)胞有絲分裂原和誘導(dǎo)劑,通過激活與其相關(guān)的分子體系導(dǎo)致VSMCs增殖[7]。如:PDGF-BB結(jié)合PDGFRβ后,通過激活ERK通路、MAPK通路和PI3K-Akt通路,最終促進(jìn)VSMCs的增殖[8]。此外,其可以上調(diào)MMP-2的表達(dá)并導(dǎo)致VSMCs的遷移[9]。而本試驗(yàn)在體外使用PDGF-BB誘導(dǎo)大鼠主動(dòng)脈平滑肌細(xì)胞增殖獲得了同樣的效果,并且具有時(shí)間劑量依賴性。此后,使用Rb1作用PDGF-BB誘導(dǎo)增殖的RASMCs,發(fā)現(xiàn)Rb1對(duì)其增殖具有抑制作用。Rb1對(duì)機(jī)體各個(gè)系統(tǒng)均有多種作用,而在心血管方面通過對(duì)抗氧化和同型半胱氨酸作用使得血管內(nèi)膜得到保護(hù)和修復(fù)[10]。而本研究發(fā)現(xiàn),Rb1能夠阻滯PDGF-BB誘導(dǎo)增殖的RASMCs于G0/G1,不增加細(xì)胞的凋亡。說明Rb1抑制細(xì)胞增殖是通過阻滯細(xì)胞進(jìn)入分裂期,而不是誘導(dǎo)細(xì)胞凋亡。CDK2和CyclinE是細(xì)胞由G1期進(jìn)入S期的關(guān)鍵分子之一,兩者結(jié)合后使其下游的pRb磷酸化,最后使得細(xì)胞順利進(jìn)入S期[11]。通過檢測(cè)CDK2和CyclinE的表達(dá)可以了解藥物對(duì)細(xì)胞周期相關(guān)通路的影響。本研究發(fā)現(xiàn),Rb1作用后,RASMCs的CDK2和CyclinE表達(dá)受到抑制。進(jìn)而再檢測(cè)兩者的上游分子P53和P21,結(jié)果發(fā)現(xiàn)P53和P21表達(dá)上調(diào)。P53是一種抑制腫瘤發(fā)生的轉(zhuǎn)錄因子[12],但同時(shí)在細(xì)胞周期阻滯中發(fā)揮重要作用,它可以激活下游的P21分子,而P21又能抑制CDK2/CyclinE復(fù)合體,最終阻滯細(xì)胞進(jìn)入S期。
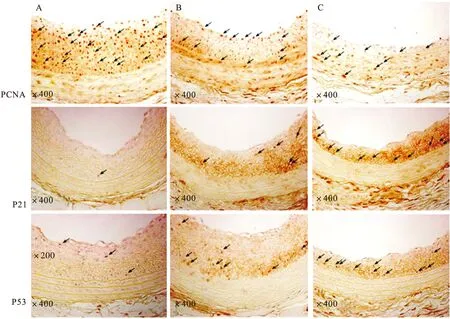
圖10 球囊損傷的大鼠頸動(dòng)脈的PCNA、P53和P21的表達(dá)情況
在大鼠體內(nèi)實(shí)驗(yàn)同樣證實(shí)了Rb1能夠抑制VSMCs增殖,使動(dòng)脈管腔變寬和內(nèi)膜變薄。并且檢測(cè)到PCNA的下調(diào)、P53和P21的上調(diào),與體外試驗(yàn)結(jié)果一致。
總之,本研究證明了Rb1能夠有效抑制PDGF-BB誘導(dǎo)的VSMCs增殖,而且是通過阻滯細(xì)胞于G0/G1期實(shí)現(xiàn)的。而這個(gè)過程與P53、P21的上調(diào)明顯相關(guān)。
參考文獻(xiàn):
[1] Wildgruber M,Swirski FK,Zernecke A.Molecular imaging of inflammation in atherosclerosis[J].Theranostics,2013,3(11):865-884.
[2] Lan T,Huang X,Tan H.Vascular fibrosis in atherosclerosis[J].Cardiovascular Pathology,2013,22(5):401-407.
[3] Donovan J,Abraham D,Norman J.Platelet-derived growth factor signaling in mesenchymal cells[J].Front Biosci(Landmark Ed),2013,18:106-119.
[4] Chai H,Schultz G,Aghaie K,et al.In vivo assessment of the effects of ginsenoside Rb1 on intimal hyperplasia in ApoE knockout mice[J].J Surg Res,2010,162(1):26-32.
[5] 陳雄林,楊耀防,熊建軍,等.SD大鼠胸主動(dòng)脈平滑肌細(xì)胞原代培養(yǎng)及鑒定[J].九江醫(yī)學(xué),2009,(2):1-2.
[6] 張紓,高楊,鄧江,等.人參皂苷Rb1抗血管平滑肌細(xì)胞增殖與calcineurin通路及抗氧化作用的關(guān)系[J].華西藥學(xué)雜志,2013,(5):461-463.
[7] Heldin CH,Westermark B.Mechanism of action and in vivo role of platelet-derived growth factor[J].Physiol Rev,1999,79(4):1283-1316.
[8] Lee MH,Kwon BJ,Koo MA,et al.Mitogenesis of vascular smooth muscle cell stimulated by platelet-derived growth factor-bb is inhibited by blocking of intracellular signaling by epigallocatechin-3-O-gallate[J].Oxid Med Cell Longev,2013:827905.
[9] Zhan Y,Kim S,Izumi Y,et al.Role of JNK,p38,and ERK in platelet-derived growth factor-induced vascular proliferation,migration,and gene expression[J].Arterioscler Thromb Vasc Biol,2003,23(5):795-801.
[10]Chai H,Dong Y,Wang X,et al.Ginsenoside Rb1 attenuates homocysteine-augmented guidewire injury-induced intimal hyperplasia in mice[J].J Surg Res,2009,157(2):193-198.
[11]白曉光,許樂幸,李祎亮,等.基于靶蛋白結(jié)構(gòu)的CDK2小分子抑制劑研究進(jìn)展[J].中國(guó)新藥雜志,2011,(17):1667-1672.
[12]Muller PA,Vousden KH,Norman JC.p53 and its mutants in tumor cell migration and invasion[J].J Cell Biol,2011,192(2):209-218.

