逆流等溫尿素合成的熱力學分析(續一)
(中國化工學會化肥專業委員會,上海 200062)
1 研究本課題的目的和意義
逆流等溫尿素合成塔是UTI熱循環工藝開發出的眾多創新成果中最引人注目的科研成果。
該成果使尿素合成轉化率從傳統法的65%提高到75%,經濟效益不言而喻。
因為逆流等溫合成塔是從傳統合成塔發展創新而來的,合成塔的工藝條件——壓力、溫度、NH3/CO2、H2O/CO2,與傳統法相近,因而特別受我國目前運行著的眾多傳統法尿素裝置青睞。僅此一項成果(尿素合成轉化率提高),即能使傳統法尿素裝置噸尿蒸汽消耗降至1.2~1.1 t。同時該項成果還是節能與增產兼顧的先進技術,故而也是擴產改造的首選技術,增產能力在40%~50%(即130 kt/a擴產到190 kt/a)時,合成轉化率仍能保持在70%以上。
本課題首先考察傳統工業尿素合成存在哪些問題,指出傳統尿素合成運行效率低的原因,哪些因素影響轉化率的提高。嗣后,對UTI新穎的逆流等溫合成法所采取的技改措施開展熱力學分析,揭示其高效運行的成功之道及技術關鍵。
2 傳統工業尿素合成存在的的問題
2.1 傳統工業尿素合成過程分析[1,2]
通常,工業上傳統尿素合成的運行方式如下:三股物流(原料CO2、預熱的液氨、以及返回的循環甲銨液)全部從底部進入尿塔,如圖1所示。經過理想混合后,原料CO2全部生成甲銨。由于進入的NH3與CO2生成液態甲銨的反應是快速強放熱反應,放出的大量反應熱會加熱混合物料,使物料溫度急劇升高,導致底部過熱,其結果是使液相物系平衡壓迅速升高。若平衡壓超過外壓時,甲銨反應熱還有多余,則生成的液態甲銨將分解為NH3與CO2氣體,直到多余的熱量全部用完,達到新的氣液相平衡。

圖1 傳統尿塔示意圖
底部進料尿塔的過熱現象是工業尿素合成物系甲銨生成反應化學平衡與相平衡、焓平衡三者綜合的結果。如果甲銨生成熱不移走,即在絕熱條件下,此現象是不可避免的。其結果是,使底部物料形成氣液兩相流。
底部進料的尿塔出現氣液兩相流是普遍的。除了傳統法之外,日本改良C法,CO2汽提法,NH3汽提法,以及ACES等塔底都是呈相平衡的氣液兩股物流。
對于傳統法尿塔,當合成工藝條件為p20 MPa,t188~190 ℃,NH3/CO24.0~4.1,H2O/CO20.65時,由計算可知,占20%~25%的原料CO2在塔底尚未生成液態甲銨,或液態甲銨重又分解為NH3與CO2氣體,在塔底混合區輸出達氣液平衡的兩股物流,溫度為178~180 ℃。之后,進入反應區,進行復合的尿素合成反應。由熱力學分析可知,此過程也是在化學平衡(這里是氣液相甲銨生成反應和液相中甲銨脫水生成尿素的兩個反應)、相平衡和焓平衡條件下進行的。簡述如下。
當氣體與液體呈平衡的混合物沿合成塔上升,隨著時間的推移,液相中甲銨進行轉化為尿素的脫水反應,使液相中水和尿素濃度增加,這兩種物質都是高沸點,因此物系沸點升高,進入液相區,溶液呈溶解吸收狀態,氣相中的NH3與CO2再一次反應生成液態甲銨,并放出反應熱,作為甲銨脫水反應所需之熱量。同時甲銨反應熱還加熱液態物料,使其達沸點。進入新的氣液平衡狀態的兩股物流繼續上移,隨著時間的推移,進行新一輪的甲銨脫水轉化為尿素的反應,……如此不斷循環。隨著物流上移,尿素轉化率增加,溶液中尿素和水濃度增加。物流上移過程中,氣相物流量減少,液相物料量增加,物流溫度逐漸升高。到達塔頂,近乎達化學平衡和相平衡的氣液物流一起排出塔外。由此可見,物料從底部慢慢上行進行的尿素合成之復合反應,均是在氣液兩相流的氛圍中進行的,直到塔頂。
2.2 存在的問題[3]
傳統尿素合成從塔底到塔頂始終是氣相(包括惰性氣體N2,O2,H2等以及有效氣體CO2,NH3,H2O)和含有甲銨過剩NH3,H2O和尿素的液相兩股物流,見圖2。由圖可知,底部氣相體積分率最大,超過50%,頂部最小,約22%。氣相物流的存在是導致尿素轉化率降低的主要原因。可從以下兩方面來分析。
(1)物料在塔內停留時間縮短
因為塔內物流是氣液混合物,導致流過全塔物流之密度降低,原來認為尿塔全為液相的觀點應改變。密度的降低導致物料在塔內停留時間減少。計算得傳統水溶液全循環法的實際停留時間為30 min(若為全液相,名義停留時間為45~50 min)。隨著停留時間的縮短,液相脫水反應時間亦隨之減少,最終導致尿素轉化率下降。
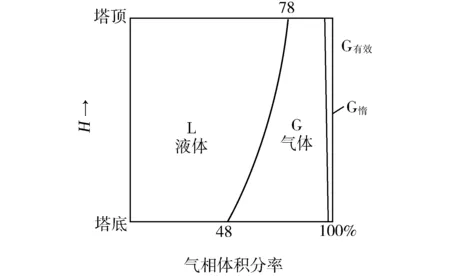
圖2 塔高與氣液體積圖
(2)晚生成之甲銨停留時間嚴重不足
由于底部存在過熱現象,塔底液態甲銨要再分解為氣態CO2和NH3,這部分CO2隨著物料上移而逐漸冷凝為液態甲銨,屬于“晚生成之甲銨”。
上述的全程停留時間(30 min)并非物系中所有甲銨都享有,只有塔底未分解之液態甲銨才享有如此長的甲銨脫水轉化為尿素的反應時間。
底部氣相物流中的CO2,都屬于晚生成之甲銨。這些CO2雖然會在上升過程中逐漸冷凝為液態甲銨,但其脫水轉化為尿素的時間則逐漸遞減,都低于30 min。
以傳統法為例,圖3中只有塔底85%~87%的甲銨享有30 min脫水轉化時間,位于中部(H1)晚生成之甲銨,脫水反應時間τ1降為20 min,上部(H2)晚生成之甲銨,τ2=10 min。
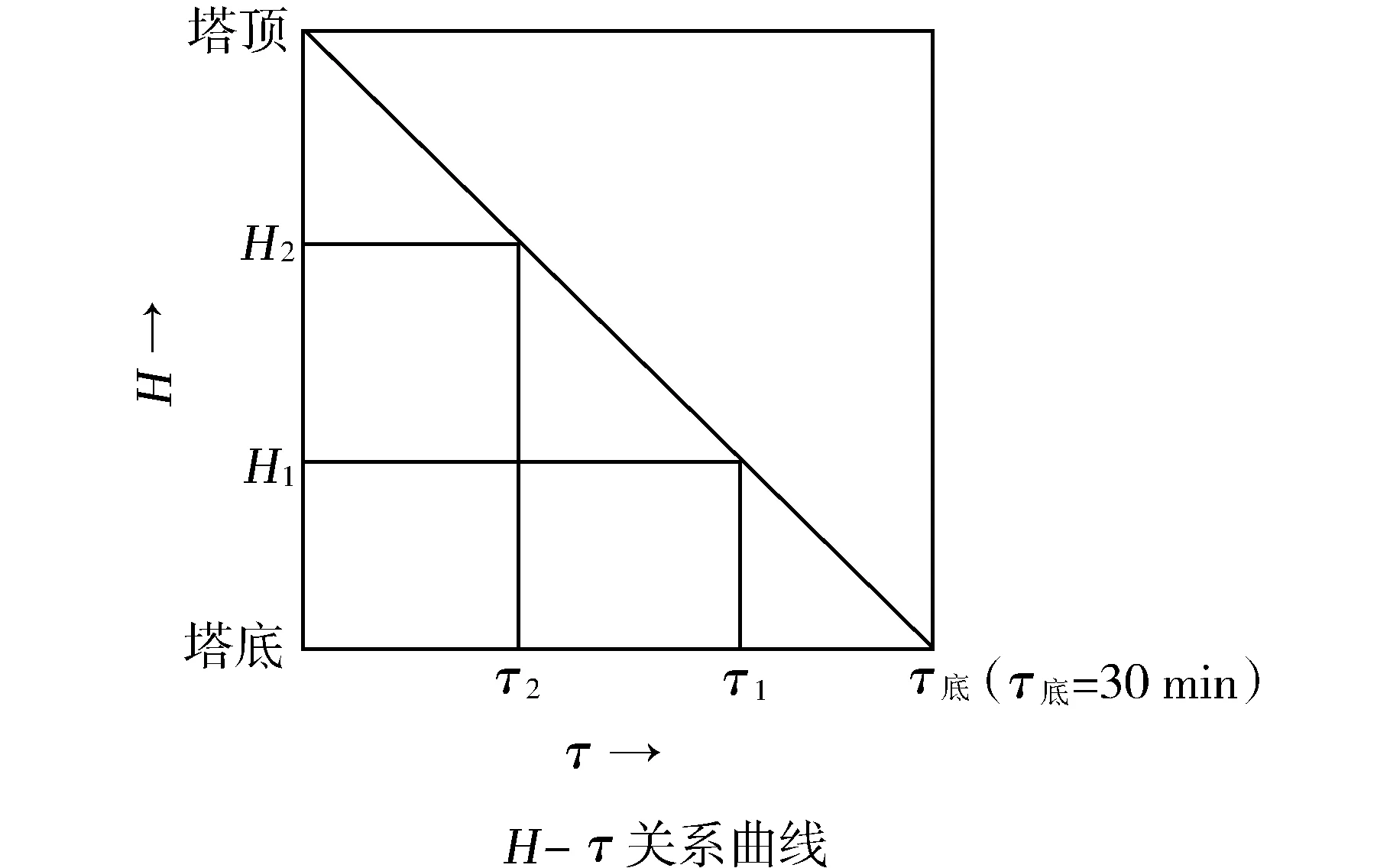
圖3 塔高與物流停留時間圖
由動力學模型計算可知,只有塔底的甲銨可望其尿素轉化率達到平衡轉化率的95%~98%。上中部晚生成之甲銨終因轉化時間不足致使尿素轉化率大大低于平衡轉化率。這些晚生成之甲銨終因停留時間嚴重不足而排出尿塔,導致總的尿素轉化率偏低。
2.3 工業實際的驗證
(1)實際停留時間τ實
物料在尿塔中的實際停留時間(τ實),對于尿塔的操作運行,塔實際體積的設計,以及模擬計算等,都是十分重要的基礎數據。為此,本文以工業裝置提供的數據為基礎,計算了傳統法和汽提法流程尿塔的τ實,見表1。

表1 工業裝置尿塔內物料停留時間
表中還列出了假設物料全為液相狀態時的名義停留時間τ名義,這是虛擬值,工業裝置中并不存在。
另外,還計算了尿塔物系在合成溫度條件下達到化學平衡狀態所需的時間,τ平[4,5]。可見,工業裝置在設計的生產強度下,實際停留時間基本滿足要求。嚴格講是底部液態甲銨的停留時間滿足要求。當然,隨著生產強度的提高,τ實就不夠了,轉化率隨之降低。
(2)實際尿素轉化率的瓶頸現象[3]
底部進料的傳統尿塔產生兩相流導致尿素轉化率下降已被工業裝置實際數據所證實。并且工業裝置的轉化率出現瓶頸現象,x實<70%。這一現象從我國傳統水溶液全循環法和日本改良C法的實際尿素轉化率數據得到證實,見表2。
表2中傳統1是傳統法工業化初期的尿素轉化率數據(尿塔為空塔或安裝簡易塔板),強烈的液相返混和氣相溝流,使實際尿素轉化率x實只有63%~65%,大大低于平衡轉化率x平。

表2 傳統法尿素工業裝置的平衡轉化率和實際轉化率
表2還列出了另一傳統水溶液全循環法——日本改良C法的尿素轉化率數據。該數據是由日本改良C法提供的物料平衡表中合成出口液數據計算求得的。應該說明的是,計算得到的xCO2不是真實的尿素轉化率,因為進入尿塔的循環液中含有大量尿素。若將甲銨液中循環的尿素扣除,則x實下降為69.40%(表2中括號內數字),故而真實尿素轉化率亦低于70%,x實與x平之差值Δx約為5%。
表2中傳統2為在尿塔內安裝了高效塔盤的尿素轉化率x實,為67%~68%,與x平之差值Δx約為5%。
工業實際數據產生瓶頸現象的主要原因還是兩相流,因為塔盤只能加速物流質量、熱量的交換,使之趨于平衡,降低液相返混和氣相溝流,使物流處于理想的氣液活塞流狀態,并不能增加甲銨脫水轉化為尿素的反應時間,因為塔盤的效率再高也不會改變上中部晚生成的液態甲銨脫水轉化為尿素的時間。所以再高效的塔盤或安裝再多的塔盤,x實也難以超越70%。
3 技改思路與方法
3.1 技改思路
通常,實驗室測試尿素平衡轉化率是按合成原始配料,在高壓釜中保持一定溫度,使物料處于全液相狀態下測定的。因此,若工業實際尿塔物料也能像實驗室一樣,處于全液相狀態下進行甲銨脫水轉化為尿素的反應,是最為理想的。這樣,工業實際轉化率x實就避免了氣相物流的干擾,其值易于接近平衡轉化率x平。
但是,尿素合成反應是由兩個反應組合而成的。第一個反應,甲銨生成反應,是飛速反應;第二個反應,甲銨脫水反應,是速度較慢的反應。兩個反應速度的巨大差異,使工業裝置上兩者的熱量轉移遇到困難,并導致在底部進料混合區,第一反應完成時第二反應尚未開始或第二反應剛剛開始,最終出現物流過熱及兩相流現象。如何將甲銨瞬間放出的熱量,不用于甲銨再分解,而逐漸轉移作為甲銨脫水熱,避免氣相物流的產生,使甲銨脫水反應在全液相的狀態下進行,是提高尿素裝置工業實際轉化率的關鍵。
設想的方案有兩個:第一為熔融液顯熱轉移法;第二為逆流換熱法。
3.2 熔融液顯熱轉移法
3.2.1原理
如果將甲銨放出的熱量以生成的氨-甲銨熔融液為受熱載體,將熱能以顯熱形式貯存,隨著甲銨脫水反應的緩慢進行,將熱量逐漸消化。為了保持液態,氨-甲銨熔融液的溫度將急劇升高。然而,在傳統水溶液全循環法尿塔壓力20 MPa下,物系沸點溫度太低,為170~175 ℃,見圖4中c1點,故而物系中甲銨發生分解,產生氣相。只有提高壓力,才能將氨-甲銨熔融液之沸點溫度提高,以使物系保持液態。
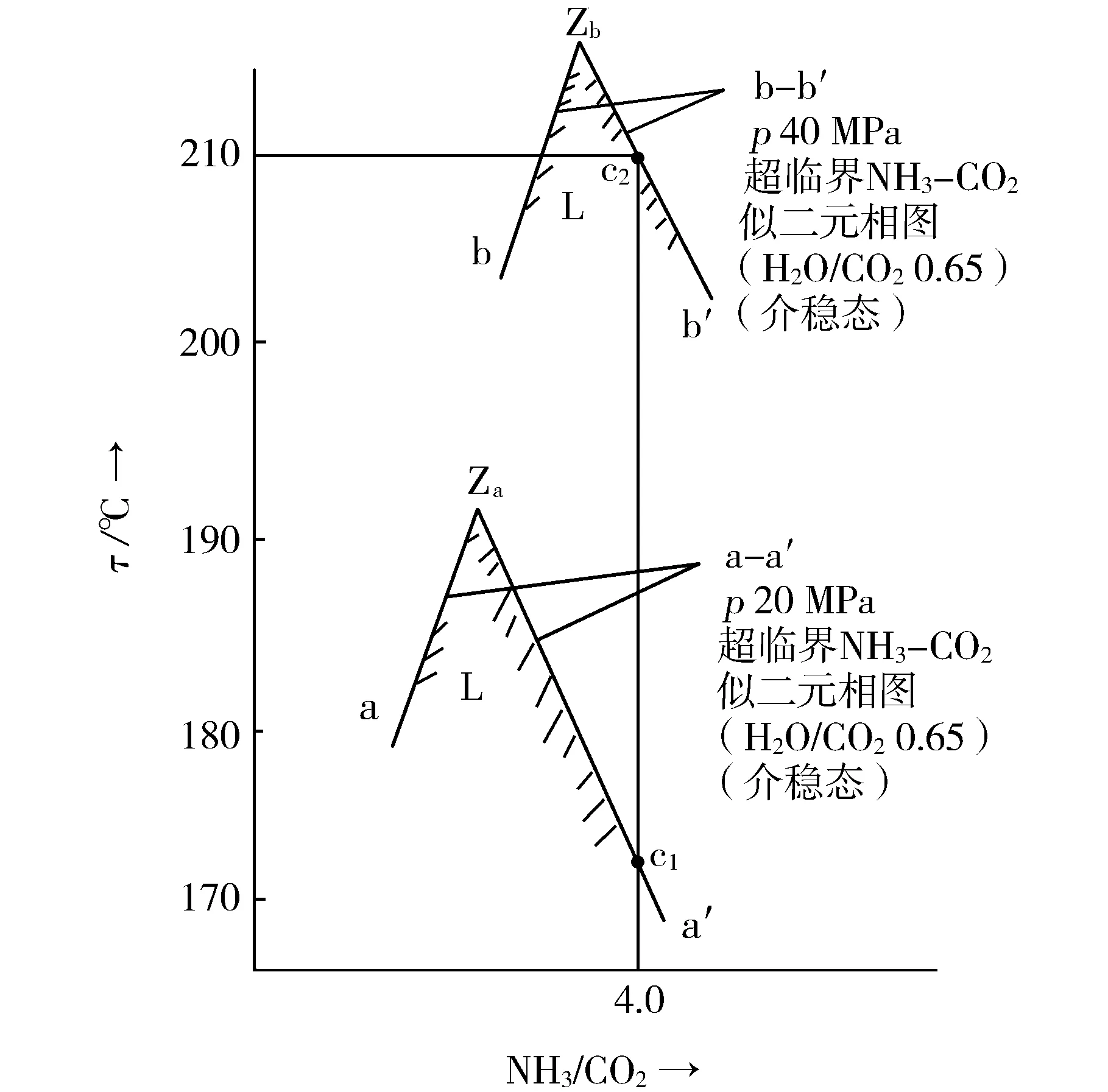
圖4 介穩態超臨界NH3―CO2似二元物系t―p―NH3/CO2關系曲線
由液相焓模型:
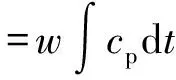
可計算出熔融液溫度升至210 ℃以上。
3.2.2流程(圖5)
顯熱法全液相尿塔的工藝條件如下:
壓力p>40 MPa,溫度t底210 ℃,t頂188~190 ℃,NH3/CO24.0~4.1,H2O/CO20.65。
流程說明 壓力為40 MPa的三股物料(原料液氨,原料CO2,返回的甲銨液)從底部進入尿塔,充分混合后,原料CO2與NH3生成甲銨。該反應是一個幾乎在瞬間(速度極快)完成的強放熱反應,也即CO2近于100%地反應生成液態甲銨,并與剩余NH3和循環甲銨返回液一起形成熔融態的氨-甲銨合成液。該熔融液被甲銨反應放出的熱量加熱。在絕熱狀態下,甲銨反應熱將被熔融液全部吸收,溫度迅速升高,由于壓力高達40 MPa,則熔融液溫度可升至210 ℃仍保持液態而不發生汽化或甲銨分解現象。這樣將反應熱以顯熱形態貯存于熔融液中。
之后,隨著時間的推移,在自下而上的移動過程中,高溫液態物料中的甲銨脫水轉化為尿素,即進行尿素合成第二反應。該反應是一個弱吸熱且速度較慢的反應,在氨-甲銨熔融液緩慢上移過程中,溶液中的顯熱作為甲銨脫水生成尿素所需之熱量,塔溫隨之下降。此過程一直進行到塔頂,近于達化學平衡,溫度下降至188~190 ℃。
由此可知,顯熱全液相合成的塔溫出現倒置現象(圖5),即下部溫度最高,上部溫度最低。
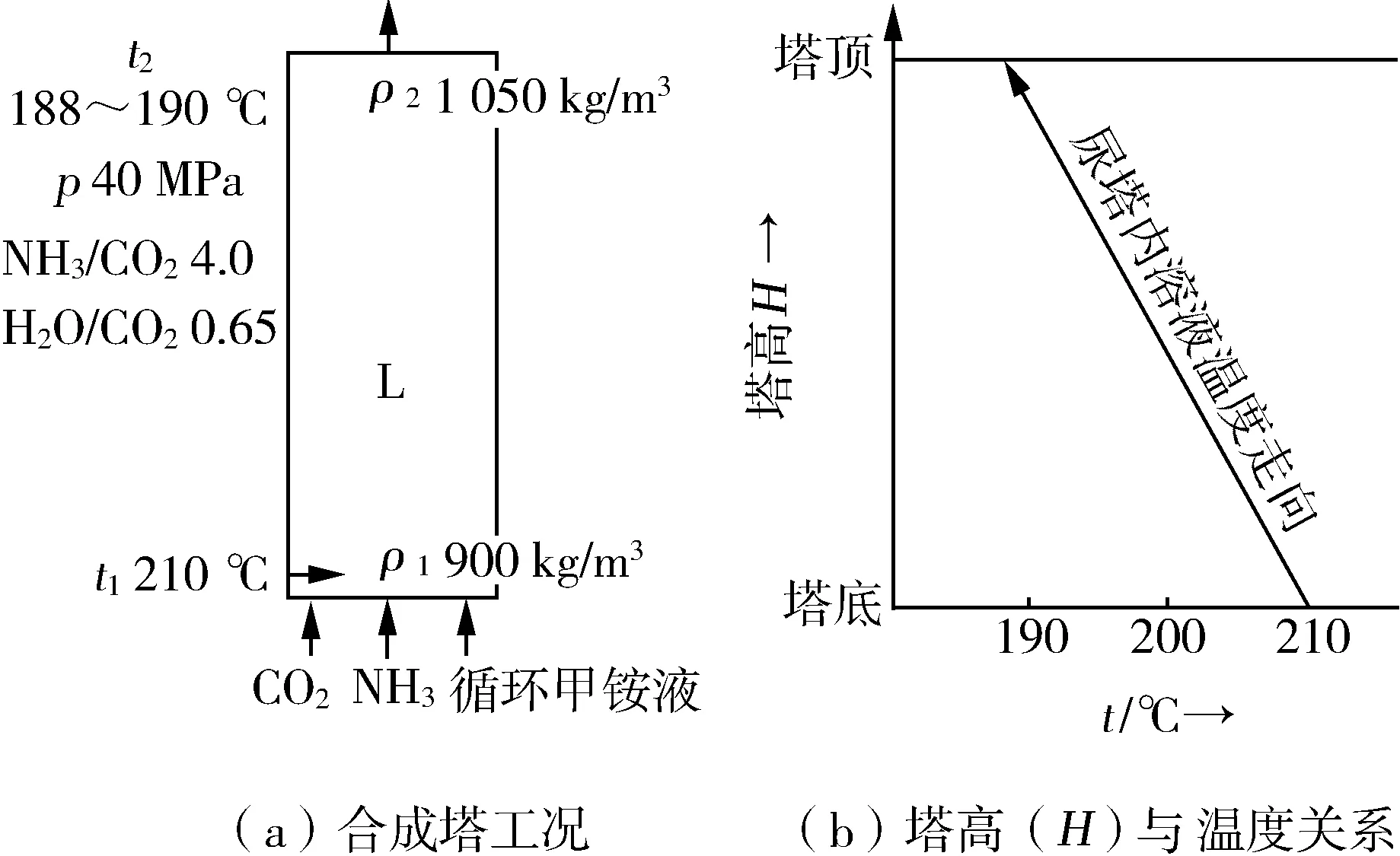
圖5 顯熱法全液相尿塔示意圖
3.2.3評議
顯熱全液相法的操作溫度高達210 ℃,壓力高達40 MPa。在如此超高溫高壓條件下,設備的材質,制造費用以及高壓運行費用,都是極為昂貴的。因而,雖然尿塔內物流呈全液相流狀態,但受經濟性限制無法應用。
3.3 逆流換熱全液相法
與前一種顯熱貯存熱量法不同,本法設想靠盤管換熱來轉移熱量,基本思路如下。
在尿塔內設置一個盤管,作為發熱部件,在盤管內進行甲銨放熱反應,并且將甲銨快速放熱反應限制在盤管內,放熱盤管放置于塔內受熱溶液流經的路徑上,盤管外尿塔內氨-甲銨熔融液為受熱部件,尿塔內熔融液進行甲銨脫水吸熱反應。盤管與尿塔溶液隔開,兩者通過管壁溫差傳遞熱量。這樣就解決了尿素合成兩個反應之間因速度差而產生的矛盾。
如果盤管設計合理,應能輸出全為液態而不含氣態CO2的氨-甲銨熔融液,然后送到尿塔內再進行甲銨脫水轉化為尿素的反應。
圖6(a)為本法示意圖。
經上述熱量轉移處理,本法就演變成了靜態實驗室測定尿素平衡轉化率的裝置[圖6(b)]。
兩者比較,圖6(b)的發熱部件為電熱絲,相當于圖6(a)的盤管;圖6(b)高壓釜內配料為全液態的氨-甲銨液混合物,相當于尿塔內盤管輸出全為液態的熔融液。
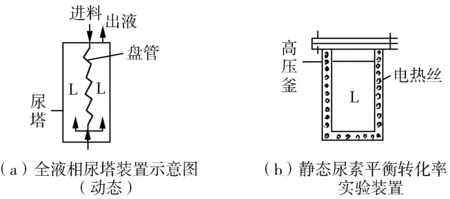
圖6 全液相法尿素合成裝置示意圖
由上討論可見,本法最終目的是為了實現尿塔內動態的實際轉化率x實與靜態測定的平衡轉化率一致。
以上即是UTI逆流等溫尿素合成塔的設計思路。
上述思路要工業實施還有一些熱力學問題需解決。
第一,盤管內高溫的創建。由熱力學第二定律可知,熱量傳遞必須從高溫端向低溫端,故而欲將盤管內放出的熱量向尿塔溶液傳遞,則盤管內的甲銨反應必須在高于尿液溫度的條件下進行。第二,盤管內物流溫度分布。因尿塔溫度為順置分布,下低上高。故盤管內溫度分布也應配置成上高下低,且上端溫度最高,以實現兩者的熱傳遞。下文詳細展開。
4 UTI逆流等溫尿素合成工藝參數及流程
4.1 UTI典型的合成工藝條件[6]
壓力p21.38 MPa,溫度 192 ℃
NH3/CO24.2(摩爾比),H2O/CO20.85
典型的合成塔溫度分布
頂部進入盤管混合器Lin187 ℃
盤管入口L0196 ℃
盤管L0-L1194 ℃
與氨混合后(合成底部)L2180 ℃
合成塔出口溶液L3192 ℃
x實73%
4.2 流程(圖7)
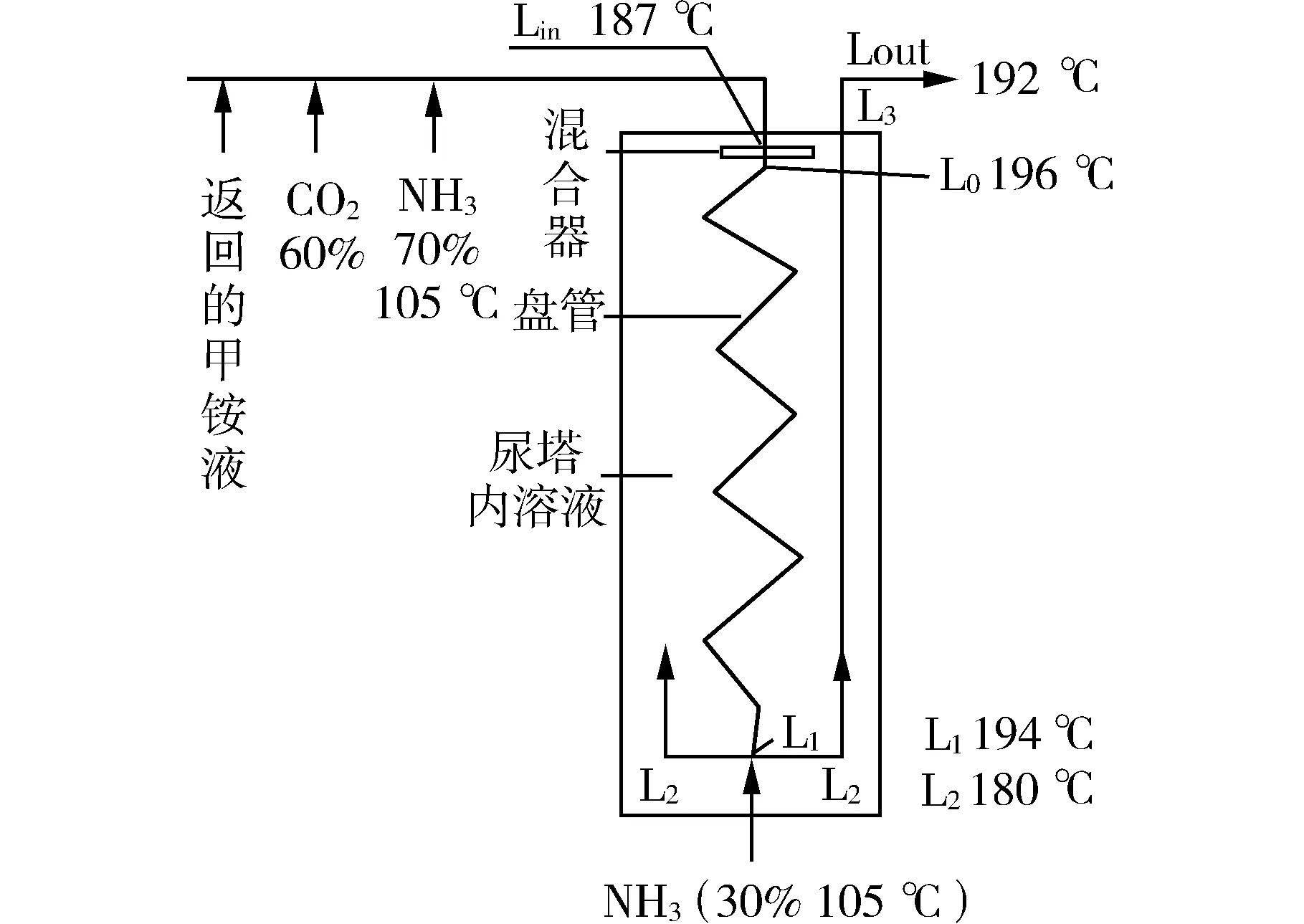
圖7 UTI逆流等溫尿塔示意圖
物流說明
(1)頂部進入盤管混合器的物料Lin
由三股物料組成:F1——返回的中壓甲銨液(115 ℃);F2——CO2原料氣(60%);F3——70%的進料液氨(105 ℃)。此三股物流一起進入尿塔頂部混合器(t187 ℃),理想混合后,將物料均勻分配至十字盤管,進入各支配管,支配管是由多股支盤管組成的換熱盤管。降低頂部物料的NH3/CO2,使混合物創建高溫條件,在21.38 MPa高壓狀態下,L0的溫度會升高到196 ℃左右。該溫度高于合成出塔液溫度192 ℃,為兩者之間的正常換熱創造了條件。
(2)盤管內物流L0-L1
盤管內物流由上而下流動。當十字盤管內的高溫物流與管外冷液流(即尿塔內合成熔融液)逆向接觸,基于管壁兩邊存在溫度差,盤管內的氣態CO2與NH3會發生甲銨生成反應,而溶解于氨-甲銨熔融液中,反應放出的熱量通過管壁源源不斷地傳遞給管外,作為甲銨脫水轉化為尿素所需的熱量。盤管內溫度則由最高點196 ℃逐漸降低,至L1點194 ℃左右。
(3)盤管外尿塔內物流L2
盤管內的混合物到達合成塔底部時(L1),從盤管開口端排出,與從合成塔底部進入的約30%的預熱液NH3(溫度約105 ℃)混合,溫度降為180 ℃左右。混合后成為L2,即尿塔底部的氨-甲銨熔融液,尿素含量近于零。L2基本為全液相。
L2向上緩慢流動。隨著時間的推移,溶液中的甲銨發生脫水反應,生成尿素和水。反應所需熱量來自于盤管內氣態CO2生成甲銨而放出的熱量。隨著尿素轉化率的升高,溶液中高沸點物質尿素和水的濃度逐漸升高,溶液的沸點亦逐漸升高,故而上行之尿素合成溶液的溫度也隨之升高,此過程一直持續到塔頂,幾乎達化學平衡。溫度由塔底的180 ℃升至192 ℃。
下面將用熱力學分析法來考察UTI提供的各溫度點的性質和特點,并討論尿塔內的全液相流、盤管設置要求等等,供參考。
5 UTI逆流等溫尿素合成的熱力學分析
高壓條件下尿素物系的熱力學、動力學模型是解讀UTI工藝合成反應過程參數的鑰匙。
為此,本文構筑了UTI尿素合成條件下的相圖,用來討論逆流等溫尿素合成反應過程。
圖8(a)由三個t-NH3/CO2相圖組成。
p22 MPa條件下NH3-CO2(H2O/CO20.85)似二元相圖,介穩態,無尿素,見B1Z1C1。B1Z1C1陰影包絡部分為液相區,之外是氣液共存區或氣相區[示于圖8(b)]。
p17 MPa條件下NH3-CO2(H2O/CO20.85)似二元相圖,穩態,見B2Z2C2。B2Z2C2陰影包絡部分為液相區,之外是氣液共存區或氣相區。
p22 MPa條件下NH3-CO2(H2O/CO20.85)似二元相圖,穩態,見B3Z3C3。B3Z3C3陰影包絡部分為液相區,之外是氣液共存區或氣相區。
有了上述三個相圖,就可以分析UTI尿素合成反應過程。p22 MPa亞穩態相圖可以用來描述入塔三物料之混合過程及之后在盤管內物料的化學反應復合化工過程。
p17 MPa穩態相圖可以用來分析盤管之外尿塔內物系的合成反應復合化工過程。
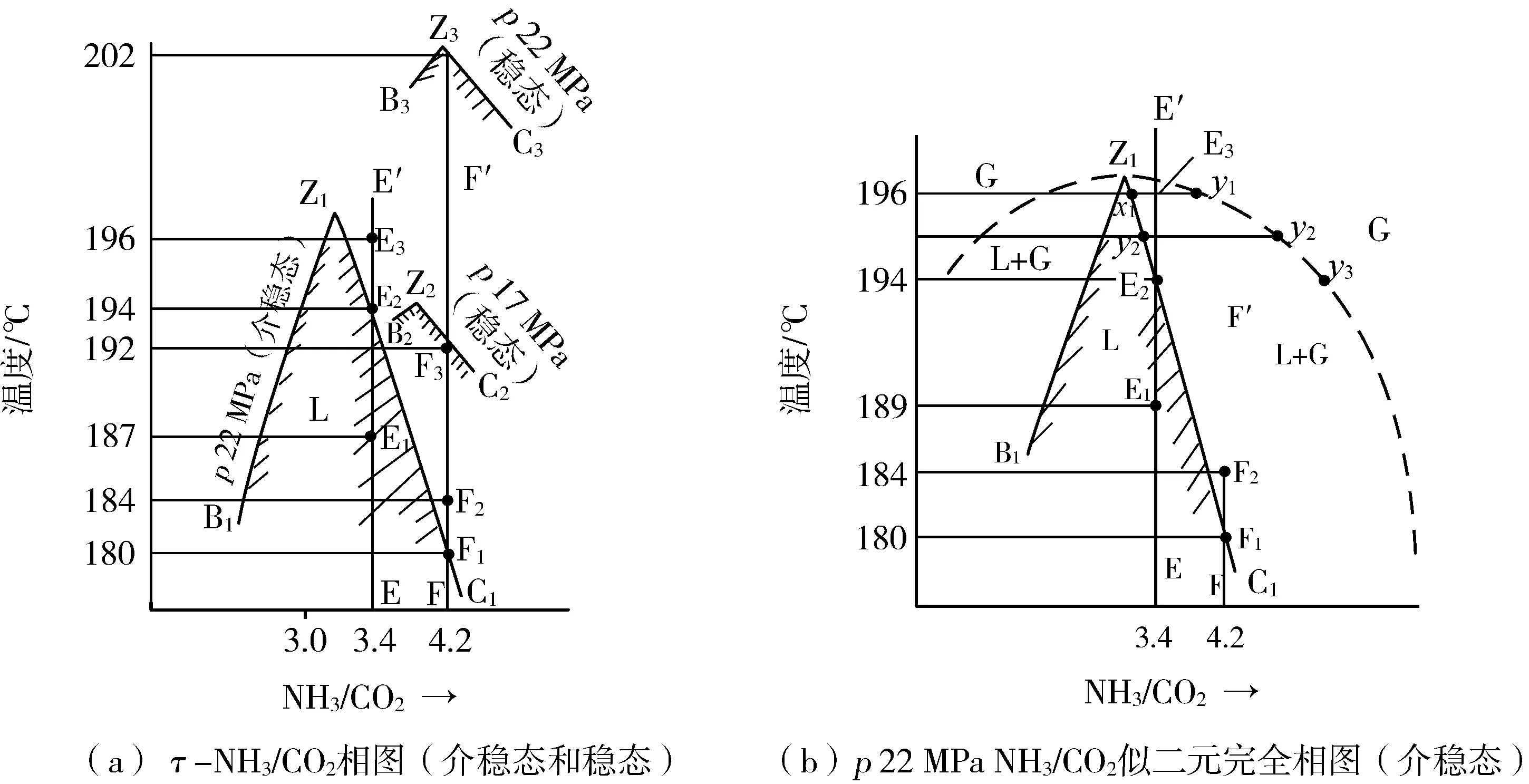
圖8 壓力p 22 MPa條件下NH3-CO2(H2O/CO2 0.85)似二元介穩態和穩態相圖
圖8(a)中第一個相圖——p22 MPa介穩態相圖,即B1Z1C1是不完全相圖,圖中只繪出了液相線。因此,該圖難以描述氣液共存狀態下物系的變化規律。而圖8(b)是其完全相圖,繪有平衡態氣相線,可以詳細分析物系在氣液共存狀態下的變化規律。
下面用圖8對UTI逆流等溫尿素合成的反應過程作剖析。
5.1 頂部物料NH3/CO2的熱力學分析
為了創建頂部高溫,首先必須確定合理的NH3/CO2。由亞穩態相圖可知,物系在共沸點(NH3/CO23.0~3.1)Z1溶液沸點溫度t3約198 ℃,是相圖最高點。共沸點兩邊的溶液沸點均下降。在合成工藝條件NH3/CO2為4.2時,沸點降為180 ℃左右。因此,為了創建頂部高溫,必須調整物料的NH3/CO2。
考慮到操作波動性,共沸點NH3/CO23.0~3.1并不適宜。將NH3/CO2選擇在4.2~3.1之間偏共沸點的優惠值最為合理。由物料衡算可知,UTI選擇的頂部物料NH3/CO2之值為3.4。此時計算得頂部加入的原料液氨為70%,底部加入30%。由此可在亞穩態相圖上作出合成頂部物料操作線E-E′。
5.2 混合過程的熱力學分析
進入合成塔頂部的物料有三股:返回的中壓甲銨液(液態);原料CO2氣(超臨界態),60%;原料液氨(亞臨界態),70%。頂部物料的操作線為E-E′,其混合過程系統性質的變化可用EE′線說明。
在理想狀態下,其混合過程可以描述如下。
(1)超臨界態CO2(g)和亞臨界態液氨(l1),經氣液主體[液相主體為返回的甲銨液(l2)]的氣膜層、液膜層擴散轉移至液相主體,并溶入主體流,放出熱量Q1。
(2)液相主體流中的液NH3(l2)與液CO2(l2)反應生成液態甲銨并放出強熱量Q2,化學反應式如下:
(3)在絕熱條件下,放出的熱量使混合物溫度升高,圖8(a)、(b)中的操作線EE′可用來描述物系在升溫過程中的相平衡變化規律。
由相圖性質可知,EE′液態(氨-甲銨熔融態)物系的沸點E2為194 ℃。在194 ℃以下物系保持液態,物系壓力小于外壓(即操作壓力)p22 MPa。溫度大于194 ℃時,EE′物系在外壓下呈氣液共存狀態。
甲銨生成反應是強放熱反應。在絕熱狀態下,放出的熱量Q2將促使100 ℃左右的EE′物料之溫度急劇升高,經過E1187 ℃,繼續升高,直到E2,194 ℃沸點狀態,此時物系壓力p物=p外。若此時熱量仍有多余,將使液態甲銨分解為CO2和NH3氣體,物系溫度亦將繼續升高,在外壓下物系成為氣液共存狀態(平衡態)。當物系到達E3時ΔQ=0,由相圖[圖8(a)、(b)]得t196 ℃,液相為x1,氣相為y1。
由此可見,UTI低NH3/CO2的頂部進料,仍存在過熱現象,即發生液態甲銨再分解為CO2和NH3的現象。但是這一現象是在高溫下(194~196 ℃)進行,并且據分析是在進入盤管后發生的。創建的高溫為之后盤管的甲銨生成熱向尿塔溶液傳遞創造了條件。
另外,值得關注的是相圖上液相狀態點E1,187 ℃,其對應于流程圖(圖7)為混合器入口點Lin,說明進入混合器的物系為液相,無氣相。
混合器兼具分配器功能。混合器輸出的液態物流,為溶液均勻分布到各支盤管提供了有力保障。若為氣液混合,則均勻分配到支盤管是困難的。
本文已用熱力學分析法考察了流程圖(圖7)上各關鍵溫度點,詳見表3。

表3 UTI流程圖各溫度點的位置及性質
5.3 盤管內物系的熱力學分析
UTI設置十字盤管的目的為,將盤管內的氣相CO2和NH3冷凝,生成甲銨液,并將甲銨反應熱傳遞至盤管外面的尿素合成液,以作為溶液中甲銨脫水轉化為尿素所需之熱。
由熱力學第二定律知,熱量傳遞轉移的條件是高溫物料之熱量向低溫物料轉移。若盤管內物料的溫度低于盤管外的溫度,那么必然會進行相反的過程,即盤管外熱量向盤管內傳遞,這樣,盤管內物料的放熱反應也就不可能進行,具體來講,盤管內甲銨生成反應也就不可能進行。由此可見,調節塔頂物料配比使之呈高溫狀態是實現熱量傳遞的重要條件。
UTI將頂部物料的NH3/CO2設置為3.4,由相圖E-E′線可得在絕熱狀態下,溫度可升高到196 ℃。為實現盤管內熱量向盤管外轉移創造了條件。
若NH3不作頂底兩部分分配,而全部從塔頂加入,也即物系NH3/CO2不加調整,為原始進料值4.2,則在相圖(圖7)B1Z1C1上可得其組成線為F-F′。可以分析,在p22 MPa下其終態氣液共存平衡物系的溫度將定格在184 ℃。在如此低的溫度下,當然不可能將盤管內的熱量向管外轉移,氣相中的NH3與CO2也就不可能冷凝生成甲銨了。這樣盤管等于白設了。
接下來考察UTI設置的盤管在正常狀態下發生的熱力學過程。
UTI盤管內的熱力學過程有二:第一步為熱物流形成階段;第二步為主體部分,熱物流中的熱量從高溫向低溫轉移。
(1)盤管初始段,Lin→L0
冷物流轉變為熱物流過程。
前已述,以UTI提供的溫度數據為基礎,用熱力學分析法,可知從混合器輸出至各支盤管的物料是過熱態熔融液。熱熔融液在各支盤管內均勻分配并釋放熱量,使物系溫度升高達到沸點194 ℃,繼而發生部分液態甲銨分解為氣態CO2和NH3的現象。這時原為純液態的物系轉化為高溫呈平衡態的氣液兩相物系L0。
各支盤管內的終態物料L0,在相圖(圖8)上對應點為E3,溫度196 ℃,為氣液共存平衡狀態。
經過上述過程入盤管的冷物流已轉化為熱物流,其過程的熱力學分析前已述。本過程各節點的溫度變化示于圖9。
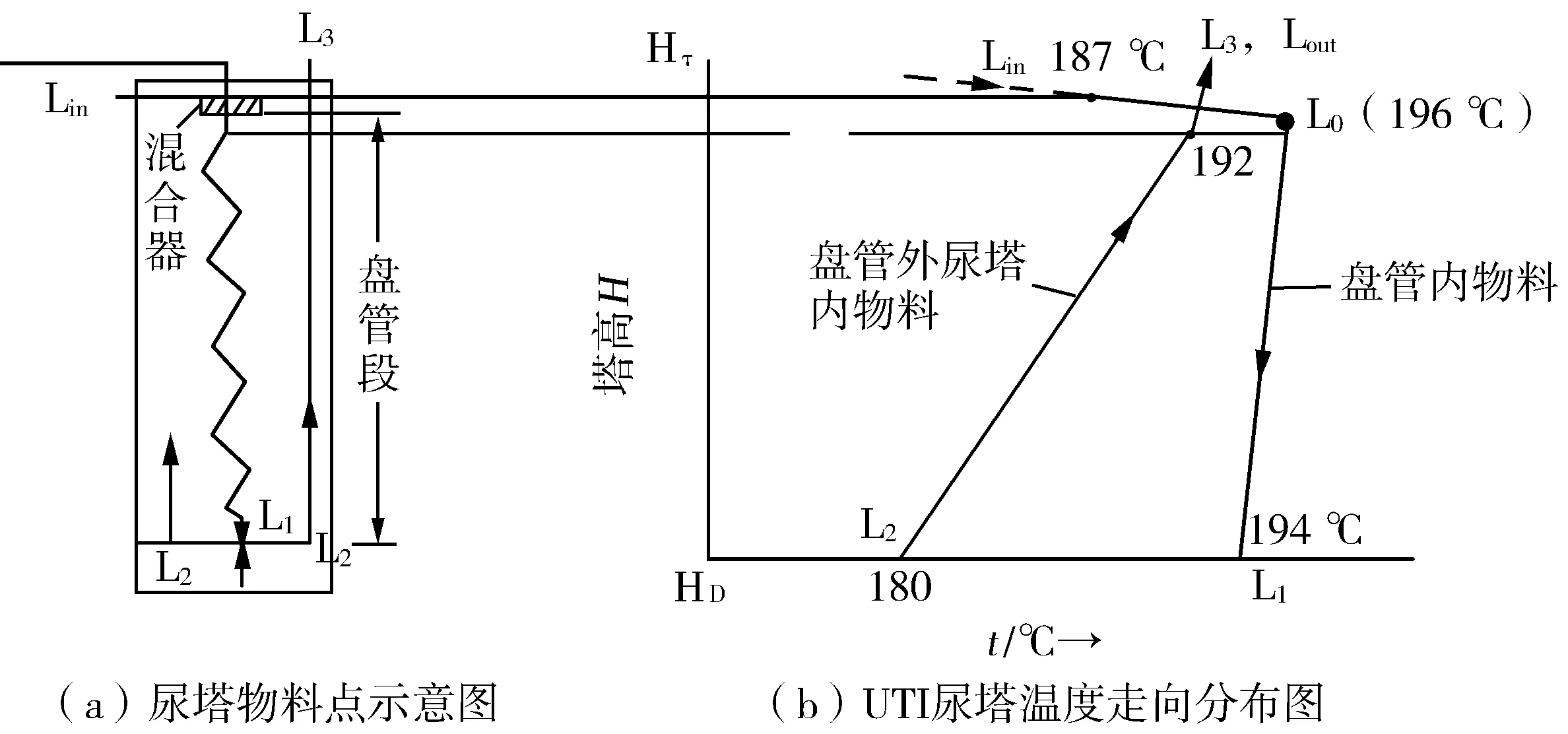
圖9 UTI尿塔物料溫度變化示意圖
從Lin到L0是一段變化極快,但物料向下移動距離很短的一段,估計約0.5 m,占盤管的很小一部分。但本過程十分重要,為后續盤管向管外溶液傳遞熱量創造了條件。
(2)盤管主體傳輸熱量段,L0→L1
當盤管內氣液兩相共存物料L0往下流動時,接觸盤管外冷物料尿素合成液L3,t192 ℃,由于盤管內的溫度(196 ℃)高于管壁外的溫度(192 ℃),導致L0中熱量向管壁外溶液L3傳遞,L0溫度下降,物系由氣液平衡態變成液態,因而在氣液之間存在傳質推動力,氣相中的CO2與NH3冷凝為液態甲銨,化學反應式為:

放出的甲銨反應熱QAM輸送給盤管外的尿素合成液,作為甲銨脫水熱QU,反應式如下:

這樣盤管內熱物料L0在往下流動過程中,氣態CO2與NH3不斷冷凝,放出的甲銨反應熱源源不斷傳遞給管外,供作尿素生成熱。此過程一直持續到L1。
上述的熱力學過程用相圖來說明更為清晰:圖8(b)中的E3對應于L0物料,E3物系是一氣液共存物系,平衡態時液相為x1,氣量為y1,t196 ℃。
由于E3物系向外界輸出熱量,E3溫度下降,液相量增加x2,氣相量降低y2。在理想狀態下,最終物系到達E2,194 ℃,沸點狀態,物系中氣相CO2和NH3全部冷凝進入液相。以全液相的物流輸出。
盤管內溫度變化見圖9,從塔頂以下1 m處的L0(196 ℃)氣液物料共同往下流,溫度微降,直到塔底,成為全液相物流L1,溫度194 ℃。
(未完待續)

