外傷性遲發(fā)顱內出血的相關因素及其與凝血異常的關系
王 偉, 沈旭明, 徐 清, 左 剛
(江蘇省太倉市第一人民醫(yī)院 神經外科, 江蘇 太倉, 215400)
外傷性遲發(fā)顱內出血在顱腦外傷中較為常見,約20%~50%的患者會發(fā)生遲發(fā)顱內出血,且死亡率也顯著高于未發(fā)生遲發(fā)出血者[1]。一旦發(fā)現(xiàn),若不及時治療,則會造成不可逆的腦損害,使患者喪失接受手術搶救的最佳時機,嚴重危及生命。近年來,隨著醫(yī)療技術的發(fā)展及神經外科醫(yī)生對疾病認識的改善,臨床上已逐漸認識到遲發(fā)顱內出血的重要性。有研究[2-3]報道,顱腦外傷可使凝血發(fā)生異常,而檢測凝血指標對于評估病情進展及判斷預后具有重要意義。本研究通過回顧性分析本院收治的236例顱腦外傷患者的臨床資料,旨在探討外傷性遲發(fā)顱內出血的相關因素及其與凝血異常的關系,現(xiàn)報告如下。
1 資料與方法
1.1 一般資料
選擇2011年9月—2013年9月在本院就診的顱腦外傷患者236例,入院時,所有患者即行急診頭顱計算機斷層掃描(CT),結果顯示23例發(fā)生顱內少量出血,2例出血較多,其余均未發(fā)現(xiàn)顱內出血或腦挫裂傷。首次CT后6~24 h行第2次CT檢查,部分患者因癥狀未緩解或加重于3~6 h行第2次檢查。入選標準: ① 受傷后6 h內入院; ② 入院時即行急診頭顱CT; ③ 頭顱CT檢查≥2次,且其報告必須有審核人與報告人。排除標準: ① 既往治療方案不詳; ② 近1個月內使用溶栓或抗凝藥物; ③ 伴有血液系統(tǒng)疾病; ④ 首次頭顱CT檢查后,住院期間發(fā)生肢體骨折,或頭部、腹部、胸部等部位再次受傷。所有患者中,男146例,女90例;年齡12~84歲,平均(45.6±21.3)歲;<40歲126例,≥40歲110例;合并糖尿病23例,合并高血壓20例,同時合并糖尿病、高血壓及慢性阻塞性肺疾病或其中的2種13例;單純頭外傷145例,伴有其他部位損傷91例;傷后2 h內就醫(yī)143例, 2 h后就醫(yī)93例;格拉斯哥昏迷評分(GCS)≥14分108例, <14分128例;傷后發(fā)生嘔吐85例,未發(fā)生嘔吐151例;治療中使用止血藥物198例,未使用止血藥物38例。根據(jù)顱內出血情況,將患者分為遲發(fā)出血組和非遲發(fā)出血組,前者為首次頭顱CT未發(fā)現(xiàn)顱內出血,而第2次檢查顱內有出血,或原有出血部位出血量增加>5 mL(根據(jù)CT測量徑線計算);后者為首次與第2次CT檢查均無明顯變化,或原有出血部位出血量增加≤5 mL。
1.2 方法
收集所有患者的CT影像學資料,比較2組入院后2~12 h的常規(guī)凝血指標,包括凝血酶原時間(PT)、凝血酶時間(TT)、纖維蛋白原(FIB)、血小板計數(shù)(PLT)、活化部分凝血活酶時間(APTT)及凝血酶原國際標準化比率(INR),并分析外傷性遲發(fā)顱內出血的相關危險因素及其與凝血異常的關系。
2 結 果
2.1 臨床資料分析
236例患者中,未發(fā)生遲發(fā)顱內出血199例(84.3%), 發(fā)生遲發(fā)顱內出血37例(15.7%), 其中發(fā)生腦內出血或腦挫裂傷26例(70.3%), 硬膜下及硬膜外出血各4例(10.8%), 硬膜下及腦內同時出血3例(8.1%)。
37例遲發(fā)顱內出血患者中, 4例出現(xiàn)較大腦內血腫,但腦池、腦室受壓較輕,且中線結構移位不明顯,經輸注新鮮血漿、恢復凝血功能后,血腫逐漸消失; 3例因血腫明顯增大而引發(fā)占位效應,經開顱血腫清除術后逐漸恢復。
2.2 遲發(fā)顱內出血相關因素分析
男性、有并發(fā)癥、GCS評分低及凝血功能異常的患者遲發(fā)顱內出血的發(fā)生率明顯高于女性、無并發(fā)癥、GCS評分高及凝血功能正常的患者,差異有統(tǒng)計學意義(P<0.05或P<0.01), 見表1。
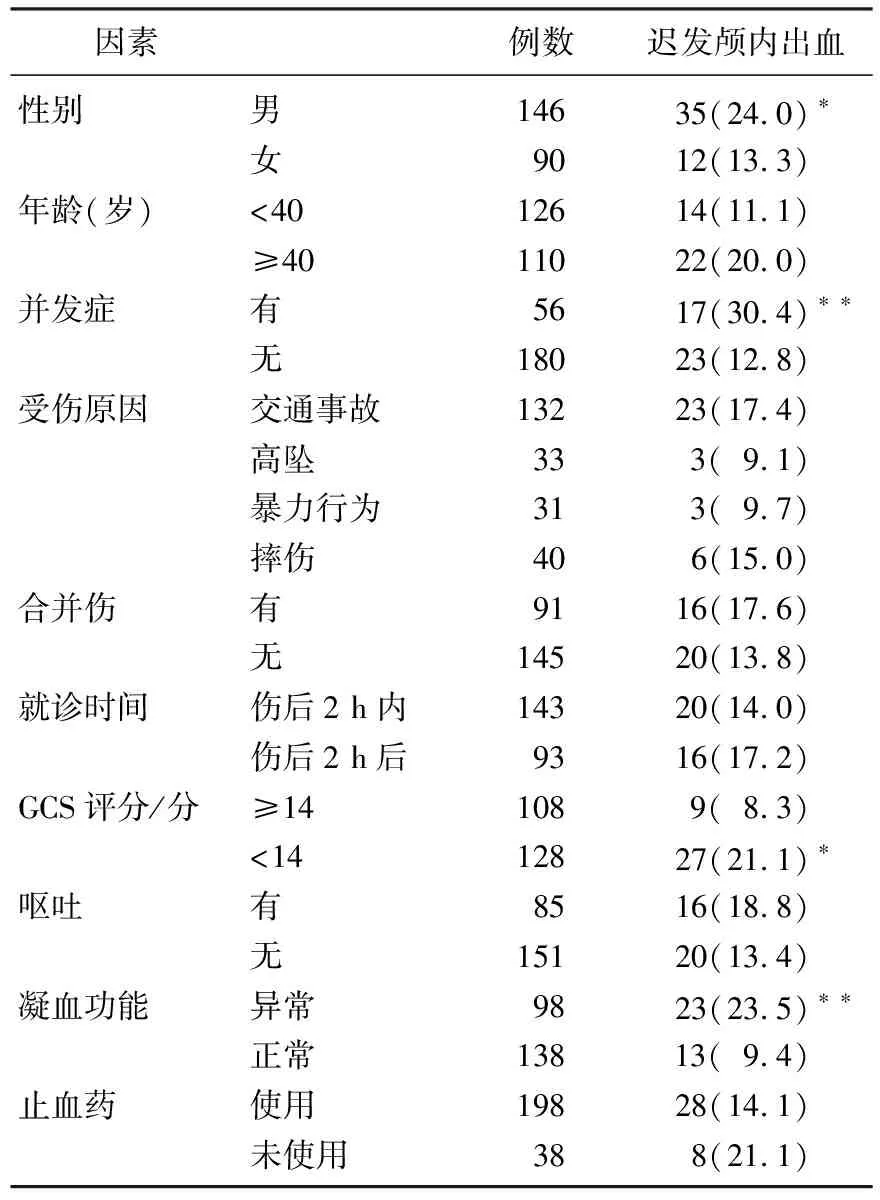
表1 遲發(fā)顱內出血相關危險因素分析[n(%)]
及凝血功能正常者比較,*P<0.05,**P<0.01。
2.3 2組各凝血指標比較
遲發(fā)出血組患者PT、TT、APTT及INR均顯著長于或高于非遲發(fā)出血組,而PLT明顯低于非遲發(fā)出血組,差異有統(tǒng)計學意義(P<0.05或P<0.01),見表2。
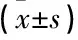
表2 2組各凝血指標比較
2.4 出血率與凝血指標異常數(shù)的關系
根據(jù)凝血指標異常的數(shù)目,將其分為無異常、1項異常、2項異常及≥3項異常。經統(tǒng)計分析可知,遲發(fā)顱內出血的發(fā)生率隨著異常數(shù)目的增加而升高;1項異常與無異常間出血率比較無顯著差異(P>0.05),而2項異常與1項異常間出血率比較差異顯著(P<0.05), 提示當凝血指標異常≥2項時,遲發(fā)顱內出血的發(fā)生率顯著升高。
3 討 論
外傷性遲發(fā)顱內出血是臨床常見的顱腦外傷,通常指首次頭顱CT掃描未發(fā)現(xiàn)顱內出血,而后檢查發(fā)現(xiàn)顱內出血,或原有出血部位出血量增加[4]。腦內出血或腦挫裂傷是其最常見的出血部位,其次為硬膜外及硬膜下出血。既往研究[5]報道,遲發(fā)性顱內出血的發(fā)生率高達50%, 其中腦內出血或腦挫傷、硬膜外及硬膜下出血的發(fā)生率分別為80%、23%和13%,而及時、有效的診治對于挽救患者的生命具有重要臨床意義。本研究236例患者中,僅37例(15.7%)發(fā)生遲發(fā)顱內出血,發(fā)生率明顯降低,其中腦內出血或腦挫裂傷、硬膜下及硬膜外出血、硬膜下及腦內同時出血的發(fā)生率分別為70.3%、10.8%、10.8%和8.1%, 略低于Oertel等[5]研究結果。
顱腦外傷通常會導致凝血異常。一方面,當大腦受到創(chuàng)傷時,富含凝血活酶的腦組織會釋放大量外源性凝血因子進入血液,同時因創(chuàng)傷所致的病理改變也可損傷血管內皮,使外源性與內源性凝血途徑被激活,從而啟動凝血與纖溶作用,造成局部凝血功能障礙[6];另一方面,顱腦外傷時釋放的皮質激素、兒茶酚胺等也可引發(fā)血小板聚集,消耗大量血小板及凝血因子,導致纖溶亢進,最終引發(fā)遲發(fā)性顱內出血。為了進一步判斷病情進展及預后情況,有必要對纖溶和凝血指標進行檢測[8]。本研究結果顯示,遲發(fā)出血組患者PT、TT、APTT及INR均顯著長于或高于非遲發(fā)出血組,而PLT明顯低于非遲發(fā)出血組,進一步證實凝血異常可引發(fā)遲發(fā)性顱內出血,且當2項或2項以上凝血指標異常時,更應值得注意。
Takahash[9]研究發(fā)現(xiàn),糾正凝血異常可在一定程度上防治遲發(fā)性顱內出血,但在高凝期若進行抗凝治療,有可能會增加出血量。在纖溶亢進期,且大量凝血因子被消耗時,通過輸注新鮮血漿來補充適當凝血因子、糾正凝血異常,也可緩解并預防遲發(fā)性顱內出血。本研究中4例遲發(fā)性顱內出血患者出現(xiàn)較大腦內血腫,但經輸注新鮮血漿、恢復凝血功能后,血腫逐漸消失。此外,男性、有合并癥、GCS評分低及凝血功能異常的患者遲發(fā)顱內出血的發(fā)生率明顯高于女性、無并發(fā)癥、GCS評分高及凝血功能正常的患者,提示性別、有無并發(fā)癥、GCS評分及凝血異常與遲發(fā)顱內出血明顯相關。女性發(fā)生顱內出血的概率明顯低于男性,考慮與女性體內黃體酮及雌激素發(fā)揮的神經保護功能有關,前者可以使細胞膜穩(wěn)定、谷氨酸受體受阻,并可增強γ氨基丁酸受體,而后者則可減少細胞膜分裂,降低脂質過氧化及血小板的聚集與凋亡,同時增加腦血流[10]。入院時,遲發(fā)出血組患者的GCS評分低于非遲發(fā)出血組,表明顱腦原發(fā)損傷越嚴重,越容易造成遲發(fā)出血。與非顱腦外傷組比較,顱腦外傷組更容易發(fā)生凝血異常,如發(fā)生彌散性血管內凝血, FIB降低或APTT、TT延長等均可使死亡率明顯升高,可見凝血功能是否正常與遲發(fā)顱內出血有關[11], 這與本研究結果一致。
綜上所述,性別、有無并發(fā)癥、GCS評分及凝血異常是引發(fā)遲發(fā)顱內出血的主要危險因素,且當2項或2項以上凝血指標異常時,更易導致遲發(fā)顱內出血。由于此類患者預后較差,因此及時發(fā)現(xiàn)并進行有效治療很重要。
[1]Joseph B, Pandit V, Aziz H, et al. Clinical outcomes in traumatic brain injury patients on preinjury clopidogrel: A prospective analysis[J]. J Trauma Acute Care Surg, 2014, 76(3): 817.
[2]Maegele M. Coagulopathy after traumatic brain injury: incidence, pathogenesis, and treatment options[J]. Transfusion, 2013, 53(Suppl 1): 28S.
[3]Joseph B, Hadjizacharia P, Aziz H, et al. Prothrombin complex concentrate: an effective therapy in reversing the coagulopathy of traumatic brain injury[J]. J Trauma Acute Care Surg, 2013, 74(1): 248.
[4]耿炯, 羊正祥, 繆偉峰, 等. 25例急性外傷性硬膜下血腫快速自行消散臨床體會[J]. 中華實用診斷與治療雜志, 2008, 22(11): 866.
[5]Oertel M, Kelly D F, McArthur D, et al. Progressive hemorrhage after head trauma: predictors and consequences of the evolving injury[J]. J Neurosurg, 2002, 96(1): 109.
[6]Idris Z, Muzaimi M, Hussin S, et al. Association of perioperative factor XIII activity levels and other haemostatic markers with the risk of postoperative intracranial haematoma in a selected cohort of neurosurgical patients[J]. Acta Neurochir (Wien), 2012, 154(5): 887.
[7]羅安志, 龍鴻川, 闞奇?zhèn)? 等. 顱腦外傷遲發(fā)顱內出血與凝血異常關系研究[J]. 中華實用診斷與治療雜志, 2010, 24(10): 971.
[8]李鋼, 徐如祥, 柯以銓. 顱腦損傷后凝血紊亂研究的新進展[J]. 中華神經醫(yī)學雜志, 2006, 5(6): 646.
[9]Takahashi H. Fibrinolytic parameters: an admission prognostic marker of head injury in patients who talk and dicteriorate[J]. J Neurosurg, 1997, 85(5): 768.
[10]朱萬祥, 陸華, 惠國禎. 對沖遲發(fā)性腦內血腫[J]. 中華創(chuàng)傷雜志, 1999, 15(3): 150.
[11]Wu X, Du Z, Yu J, et al. Activity of factor VII in patients with isolated blunt traumatic brain injury: association with coagulopathy and progressive hemorrhagic injury[J]. J Trauma Acute Care Surg, 2014, 76(1): 114.

