人結直腸黏膜層淋巴管微細分布及超微結構
趙斌 陳福軍 于海濤 付巖 王錫山
結直腸癌是常見的惡性腫瘤之一,淋巴道轉移是其廣泛播散的主要途徑。近年來,隨著癌細胞淋巴道轉移機理研究的不斷深入,人體各部位器官內淋巴管的分布規律和形態特征的研究已見一些文獻報道。本文應用半薄切片、光鏡觀察及超薄切片電鏡觀察的方法研究了人結直腸黏膜層內淋巴管的微細分布和超微結構,以期為進一步探討結直腸癌淋巴道轉移機制提供必要的基礎材料。
材料與方法
一、一般資料
哈爾濱醫科大學附屬腫瘤醫院結直腸外科住院手術患者40例,均為單發、無遠處轉移腫瘤。結腸標本取材部位距腫瘤大于10 cm,直腸標本為距腫瘤下緣大于3 cm。全層取材。標本以中性福爾馬林及戊二醛固定。共40個蠟塊。
鼠抗人D2-40單克隆抗體、鼠抗CD34單克隆抗體、PV-6002二步法免疫組化檢測試劑盒、ZLI-9032濃縮型DAB試劑盒均購自中杉金橋生物技術有限公司。
二、方法
中性福爾馬林固定標本經病理科脫水-透明-浸臘-包埋常規處理。共40個蠟塊標本,每塊以10 um厚切片,連續切片切3張,一張經HE染色,另二張采用免疫組化EnVision二步法染色。切片分別標記D2-40及CD34,D2-40陽性而同部位CD34陰性者為淋巴管陽性。戊二醛固定標本經超薄切片,J EM2120 透射電鏡觀察。HE染色用來排除腫瘤侵潤。
常規脫蠟、水化組織切片。組織切片抗原修復——微波加熱。3%H2O2孵育10 min,PBS沖洗,2 min3次。加一抗,4度冰箱過夜。PBS沖洗2 min 3次,加PV-6002室溫孵育30 min,PBS沖洗2 min 3次。DAB顯色10 min,自來水沖洗,封片。
結 果
一、光鏡觀察結果
CD34與D2-40染色無交叉。圖1和圖2為CD34染色未見棕黃色,圖3和圖4為D2-40染色,于相同部位見棕黃淋巴管染色。
在光鏡下,結直腸壁分4層:即黏膜層、黏膜下層、肌層和漿膜層,各層均含有淋巴管,黏膜層淋巴管,多位于黏膜固有層的深層。在黏膜肌內也可見到毛細淋巴管,并向下深入至黏膜下層,可能是黏膜層毛細淋巴管與黏膜下層毛細淋巴管之間的吻合管(圖5)。固有層內孤立淋巴小結周圍可見淋巴管(圖6)。黏膜層淋巴管管壁較薄,多為單層內皮組成,形狀不規則,可呈現為擴張、圓形、橢圓形、多角形或閉鎖的條索狀,有時管壁不完整。
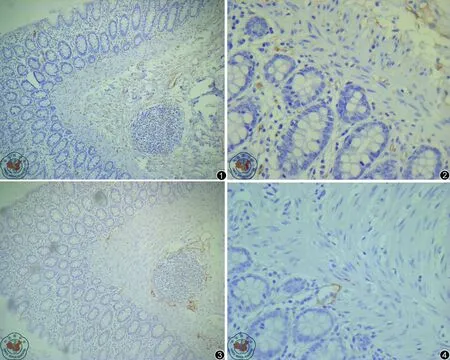
圖1 J EM2120透射電鏡下CD34免疫組織化學染色圖像(10×10);圖2 J EM2120透射電鏡下CD34免疫組織化學染色圖像(10×40);圖3 J EM2120透射電鏡下D2-40免疫組織化學染色圖像(10×10);圖4 J EM2120透射電鏡下D2-40免疫組織化學染色圖像(10×40)

圖5 光鏡下結腸壁組織圖像,可見黏膜層毛細淋巴管與黏膜下層毛細淋巴管之間的吻合管(10x10);圖6 光鏡下結腸壁組織圖像,可見固有層內淋巴管(10x10)
二、電子顯微鏡觀察結果
我們也發現黏膜層可見毛細淋巴管,位于黏膜固有層與黏膜肌層之間,官腔狹窄,僅由一層內皮細胞構成,無孔窗,無周細胞,基膜不連續,可見鑲嵌連接,胞質細胞器少。
三、CD34染色廣泛存在于黏膜固有層及黏膜肌層,管腔小,管壁薄,數量多。
討 論
迄今為止,有關淋巴管形成與腫瘤轉移及預后的研究才剛剛起步,主要原因是缺乏淋巴管特異標記物。常規組織學切片HE染色無法確切區分淋巴管及血管,近年來,隨著一系列淋巴管標記物的相繼出現,使腫瘤淋巴管生成與腫瘤轉移及預后關系的研究逐漸成為繼腫瘤血管之后的新研究熱點[1]。
D2-40是腎小球足突細胞膜表面的跨膜粘蛋白,分子量為40 kDa,參與足細胞足突的形成和塑形。Geleff等[2]于1999年首次報道在淋巴系統中D2-40似乎僅在被覆單層內皮細胞的小淋巴管,如終末淋巴管顯色,這些小淋巴管同時也表達VEGFR-3。它既不能使細胞或平滑肌的大淋巴管顯色,也不能使淋巴結內的高內皮靜脈顯色。超微結構研究也表明D2-40主要表達于淋巴管內皮細胞的腔面,少部分表達于非腔面和細胞間質。而在大淋巴管及血管內皮中均不表達。其特異性明顯高于目前常用的淋巴管標記物VEGFR-3、VEGF-C等。本研究發現D2-40標記的淋巴管染色清晰,提示D2-40是研究腫瘤微淋巴管特異性相對較高的標記物。
通過淋巴管和血管轉移是胃腸道惡性腫瘤轉移的重要途徑,惡性腫瘤細胞通過淋巴管和血管可以轉移到原發腫瘤以外的器官,大量臨床研究表明LVD與胃癌和結直腸癌的預后顯著相關[3,4];除此之外,惡性腫瘤細胞還借助血管提供其生長所需的營養物質,并借助血管和淋巴管的引流維持組織的滲透壓[5]。因此,研究淋巴管和血管分布和生成特點有助于我們加深了解腫瘤的發生和發展機制。
當腫瘤細胞局限于黏膜內時,腫瘤細胞對氧氣和養分的需求增加較小,正常的血管供應可以滿足腫瘤細胞生長的需要。但腫瘤細胞的代謝較為旺盛,導致腫瘤組織的滲透壓在該階段增加較快。因此,需要更多的淋巴管引流組織液以維持組織滲透壓。
長期以來,絕大多數學者認為正常大腸黏膜層內不存在微淋巴管,所以大腸腺瘤即使癌變,如未突破基底膜,也不會發生轉移。故WHO2000年分類建議放棄使用“原位癌”的概念,而改用“高級別上皮內瘤變”。這樣命名的主要目的是防治過度治療。然而我們的研究發現,在正常大腸黏膜層內也有微淋巴管,且位于黏膜肌層兩側,在黏膜肌內,也可見到毛細淋巴管,并向下深入至黏膜下層,與黏膜下層毛細淋巴管之間吻合,這與部分報道結直腸固有層存在淋巴管[6]觀點不符,與既往經典的組織學描述更不一致。WHO 2000年結直腸癌定義為腫瘤穿透黏膜肌層到達黏膜下層,沒有對侵及黏膜肌層作描述,認為結直腸高級別上皮內瘤變不發生轉移,然而,蔡宏等人的回顧性研究證實,結直腸癌浸潤至黏膜肌層時有發生轉移的可能[7].這是否與黏膜層存在淋巴管有關。He等[8]研究了從骨髓獲得的內皮祖細胞及既存的淋巴管內皮細胞,在腫瘤淋巴管新生中不同的促進貢獻度。在腫瘤或VEGF-C誘導的新生淋巴管模型中,沒有發現作了遺傳標記的骨髓內皮祖細胞有明顯的作用。在腫瘤周邊區域,淋巴管新生的程度與淋巴管密度有相關性,不過雖然存在淋巴管新生,在淋巴管網發育不全的VEGF-C(+/-)小鼠卻沒有發生腫瘤淋巴管轉移。研究顯示:在腫瘤淋巴管新生和腫瘤細胞經淋巴管轉移的過程中,新形成的淋巴管是從既存的淋巴管網通過發芽方式產生的,而來源于骨髓的內皮祖細胞在其中只起很小或不起作用。Achen等[9]的研究結果顯示,腫瘤在缺氧情況下分泌VEGF-C,通過旁分泌方式到達局部淋巴管,與VEGFR-3結合,促進淋巴管內皮細胞以出芽方式向腫瘤組織生長,新生淋巴管可到達腫瘤周圍甚至進入瘤內,增加腫瘤轉移的機會。因此,黏膜層存在淋巴管可作為早期轉移的解剖學依據。
早期腫瘤轉移的因素很多,正常大腸黏膜層內存在微淋巴管這一發現的生物學意義仍有待于進一步觀察。
[1] Krishnan J,Kirkin V,Steffen A,et al.Differential in vivo and vitroexpression of vascular endothelial growth factor(VEGF)-C and VEGF-D in tumors and its relationship to lymphatic metastasis in immunocompetent rats.Cancer Res,2003,63:713-722.
[2] Karpanen T,Egeblad M,Karkkainen MJ,et al.Vascular endothelial growth factor C promotes tumor lymphangiogenesis and intralymphatic tumor growth.Cancer Res,2001,61:1786-1790.
[3] Liang P,Hong JW,Ubukata H,et al.Increased density and diameter of lymphatic microvessels correlate with lymph node metastasis in early stage invasive colorectal carcinoma.Virchows Arch,2006,448:570-575.
[4] Matsumoto K,Nakayama Y,Inoue Y,et al.Lymphatic microvessel density is an independent prognostic factor in colorectal cancer.Dis Colon Rectum,2007,50:30-31.
[5] Schoppmann SF.Lymphangiogenesis,inflammation and metastasis.Auticancer Res,2005,25:4503-4511.
[6] World Health Organization classification of tumor.Pathoiogy and genetics of tumours of the digestivesystem.IARC,2000:105-118.
[7] 蔡宏,莫善兢,師英強,等.早期結直腸癌淋巴結轉移的基礎和臨床研究.中國實用外科雜志,2005,25(5):273-276.
[8] He Y,Rajantie I,Ilmonen M,et al.Preexisting lymphatic endothelium but not endothelial progenitor cells are essential for tumor lymphangiogenesis and lymphatic metastasis.Cancer Res,2004,64(11):3737-3740.
[9] Achen MG,McColl BK,Stacker SA.Focus on lymphangiogenesis in tumor metastasis.Cancer Cell,2005,7(2):121-127.

