正交試驗法優化苦豆子總生物堿的超聲提取工藝
寧夏職業技術學院 寧夏中藥材開發與利用工程技術研究中心,寧夏 銀川 750021
正交試驗法優化苦豆子總生物堿的超聲提取工藝
李軍郝彩琴馬小蘭王海霞王建建冷曉紅
寧夏職業技術學院 寧夏中藥材開發與利用工程技術研究中心,寧夏 銀川 750021
目的優選苦豆子中總生物堿的超聲提取工藝。方法以總生物堿提取率為指標,采用單因素和正交試驗考察料液比、超聲溫度、乙醇濃度、超聲時間、提取次數對提取工藝的影響,確定最佳提取工藝。結果各因素對超聲提取工藝的影響順序為超聲溫度>料液比>超聲時間>乙醇濃度; 最佳提取工藝為用65%乙醇,按料液比1:16,溫度30℃,超聲提取2次,每次20min。結論優選的提取工藝穩定可行,提取率高。
苦豆籽;總生物堿;正交試驗;超聲提取
苦豆子(SophoraalopecuroidesL. ) 是寧夏地區重要的藥用植物資源,野生資源分布較廣[1]。苦豆子藥用部位為花期的干燥地上部分稱“苦豆草”及成熟的種子稱“苦豆籽”。含有苦參堿(Matrine)、氧化苦參堿(Oxymatrine)、槐果堿( Sophocarpine)、槐定堿( Sophridine)、苦豆堿(Aloperine)等20多種生物堿[2],其中以槐定堿的含量最高[3]。苦豆子總生物堿不僅具有抗癌、抑癌、抑制和殺滅各種微生物的藥理活性,而且對免疫系統、神經系統、心血管系統有廣泛的藥理作用[4]。目前苦豆籽提取主要為超聲波、回流提取苦參堿[5、6],以及微波法和傳統方法提取總生物堿[7]。鑒于超聲波在中藥成分提取中可縮短提取時間,提高效率[8]。且以苦參堿為指標的提取不能完全反映總生物堿的提取率。因此,本研究以苦豆籽總生物堿的提取率為指標,通過超聲波提取法進行單因素和正交試驗對影響總生物堿提取率的因素進行優化,選出最佳的提取工藝條件,為苦豆籽中總生物堿的提取及其產業化生產提供實驗依據。
1 儀器及試藥
1.1 儀器 HT-600A型超聲波儀(天津東康科技有限公司);TU-1810型紫外分光光度計(北京普析通用儀器有限公司);AE-240電子天平(上海梅特勒-托利多有限公司);DKB-8A 電熱恒溫水槽(上海精宏儀器設備有限公司);130-A 型高速粉碎機(長沙市中南制藥機械廠)。
1.2 試藥 苦豆籽藥材(采于鹽池縣花馬池鎮),經鑒定為豆科槐屬植物苦豆子(Sophora alopecuroides L.)種子;槐定堿標準品(批號:110784-200303,中國藥品生物制品檢定所)。其余試劑均為分析純,水均為純化水。
2 方法與結果
2.1 總生物堿含量測定
苦豆籽總生物堿含20多種化合物,以槐定堿的含量最高,參考相關文獻[9]采用溴麝香草酚藍比色法以槐定堿為指標成分測定苦豆籽總生物堿含量(λ=410nm)。
2.1.1 標準曲線的制作 精密稱定槐定堿對照品5.01mg,置5ml容量瓶中,加無水乙醇溶解并稀釋至刻度,搖勻即得槐定堿對照液。取上述溶液0、20、40、60、80、100、120、140μl,分別置于50 ml的磨口錐形瓶中,揮盡乙醇,加溴麝香草酚藍pH=7.6緩沖液12ml、氯仿12ml,密塞劇烈振搖2min,靜置2h后分出氯仿層,以同法處理無槐定堿對照液為空白,于410nm處測定提取液的吸光度[8],以吸光度為橫坐標,氯仿層濃度為縱坐標得回歸方程:A=0.0131C+0.0002,r=0.9999。
2.1.2 含量測定 分別吸取提取液1ml,稀釋至10ml,吸取0.2ml至錐形瓶中,加入溴麝香草酚藍pH =7.6緩沖液12ml,氯仿12ml,密塞振搖2min,靜置2h,分取氯仿層,以一定濃度的乙醇0.2ml,溴麝香草酚藍pH=7.6緩沖液12ml和氯仿12ml同比操作為空白,于410nm處測定提取液的吸光度,從制作的標準曲線中查得相應的生物堿濃度,并算出苦豆籽總生物堿的提取率。
2.1.3 精密度實驗 取同一批次提取的苦豆籽提取液,按照“2.1.2”項的方法操作,平行測定6次吸光度值,6次測定結果的RSD為0.57%,說明儀器精密度良好。
2.1.4 穩定性實驗 取同一批次提取的苦豆籽提取液,按“2.1.2”項的方法操作,每隔30min于410nm波長處測定吸光度,共測5次,5次結果的RSD 0.45%,表明樣品溶液在120min 內測定穩定。
2.1.5 重復性實驗 取同一批次提取的苦豆籽提取物,按“2.1.2”項的方法平行制備6份供試品溶液,并測定吸光度,6次測定結果的RSD為1.13%,說明方法重復性較好。
2.2 單因素試驗
2.2.1 料液比 準確稱取5份10.0g的苦豆籽粉,分別置于三角瓶中,加入80、120、160、200、240 ml 55%乙醇,浸泡1h,超聲波處理20 min后,濾過,濾液作為提取液。按照“2.1.2”項的方法測定生物堿提取率。由圖1可知,當溶劑用量達到1∶24 時,苦豆子中生物堿提取率最高,考慮工業化生產中料液比不宜過大。因此,選擇1∶16、1∶20、1∶24作為正交試驗的3個考察水平。
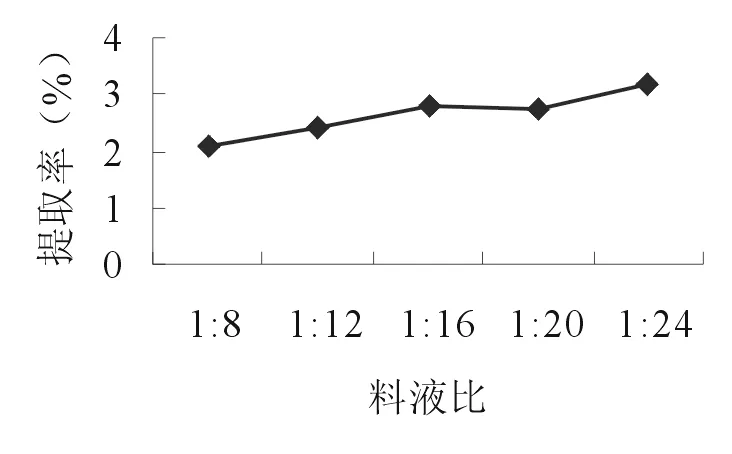
圖1 料液比對提取率的影響
2.2.2 超聲提取時間 準確稱取5份10.0g的苦豆籽粉,分別置于三角瓶中,各加入160 ml 55%乙醇,浸泡1h,分別超聲處理10、20、30、40、50min后,濾過,濾液作為提取液。按照“2.1.2”項的方法測定生物堿提取率。由如圖2可知,在10~30min內,苦豆籽總生物堿的提取率隨著超聲時間基本保持不變,以后隨著時間的延長,提取率有所下降。因此,選擇10,20,30min 3個水平進行正交試驗。
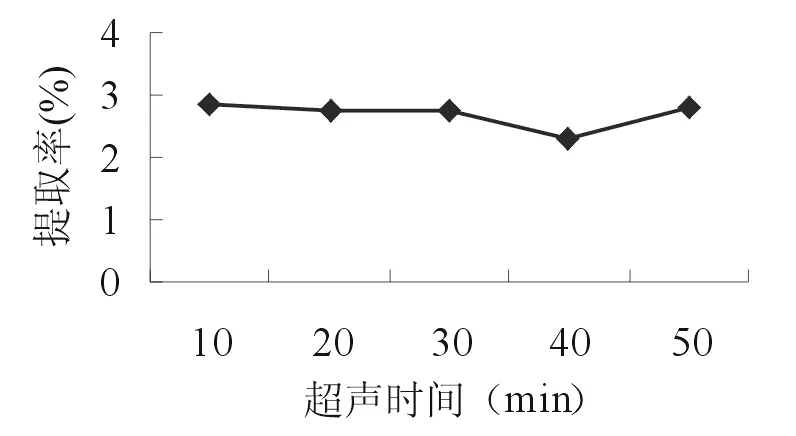
圖2 超聲提取時間對提取率的影響
2.2.3 超聲提取次數 準確稱取1份10.0g的苦豆籽粉,分別置于三角瓶中,各加入160 ml 55% 乙醇,浸泡1h,分別超聲提取1次、2次、3次、4次、5次(每次超聲20min)后,濾過,濾液作為提取液。按照“2.1.2”項的方法測定生物堿提取率。有圖3可知,隨著超聲提取次數的增加,提取率逐漸降低,其中第3次超聲提取的生物堿提取率只有0.09%,考慮生產成本和收率的關系,故選擇超聲提取2次。

圖3 超聲提取次數對提取率的影響
2.2.4 超聲溫度 準確稱取4份10.0g的苦豆籽粉, 分別置于三角瓶中,各加入160 ml 55%乙醇,20、40、60、 80℃浸泡1h,分別在20、40、60、80℃超聲20min后,濾過,濾渣繼續超聲1次,合并濾液作為提取液。按照“2.1.2”項的方法測定生物堿提取率。由圖4可知,苦豆籽總生物堿的提取率在40℃時最高。因此,選擇30、40、50℃ 3個水平進行正交試驗。
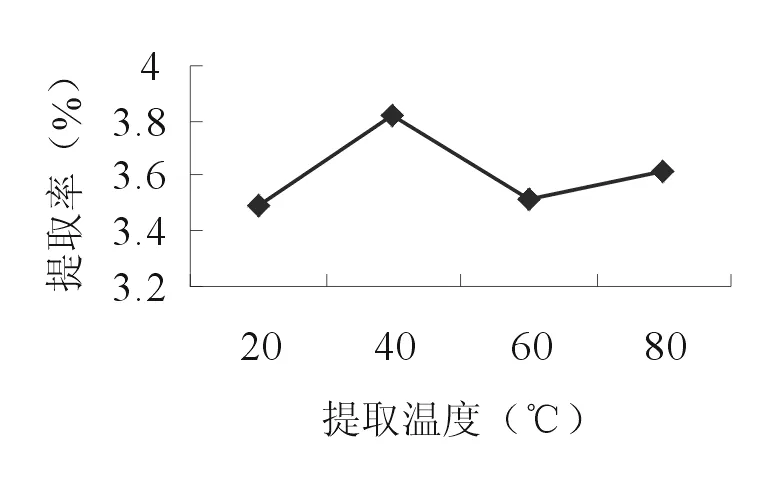
圖4 超聲溫度對提取率的影響
2.2.5 溶劑濃度 準確稱取4份10.0g的苦豆籽粉,分別置于三角瓶中,加入160 ml45、55、65、75%的乙醇,浸泡1h,超聲處理2次,每次20min,合并濾液作為提取液。按照“2.1.2”的方法測定生物堿提取率。由圖5可知,苦豆籽總生物堿的提取率隨著溶劑濃度增加,提取率先增加后降低。因此,選擇45、55、65% 3個水平進行正交試驗。
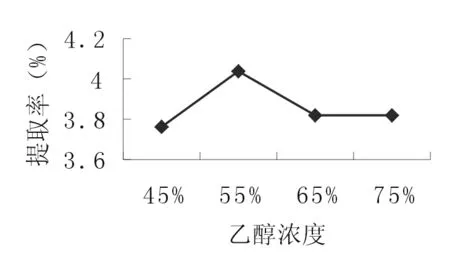
圖5 溶劑濃度對提取率的影響
2.3 正交試驗設計 準確稱取9份苦豆籽粉,每份10.0g,以上述單因素試驗結果為依據,確定溶劑濃度、料液比、超聲時間、超聲溫度這四個因素做正交試驗,采用L9 (34 ) 正交表(見表1)進行試驗,確定最佳的提取條件。由表2可知,四個因素對提取率的影響主次順序為B> A> D >C。由表3的方差分析可知,四個因素對苦豆籽總生物堿提取率無顯著性影響,但溫度對生物堿提取率的影響較重要,其他因素影響較小。綜合考慮生產實際過程及正交實驗結果,選擇最佳的提取工藝條件是:A1B1C3D2,即用65%乙醇,按料液比1∶16,溫度30℃,超聲提取2次,每次20min。
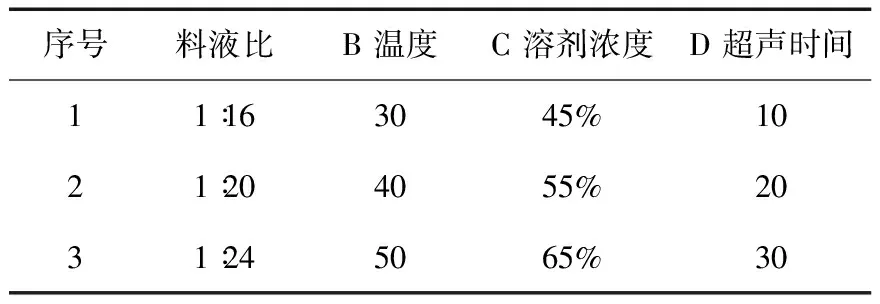
表1 正交試驗因素水平表L9 (34)
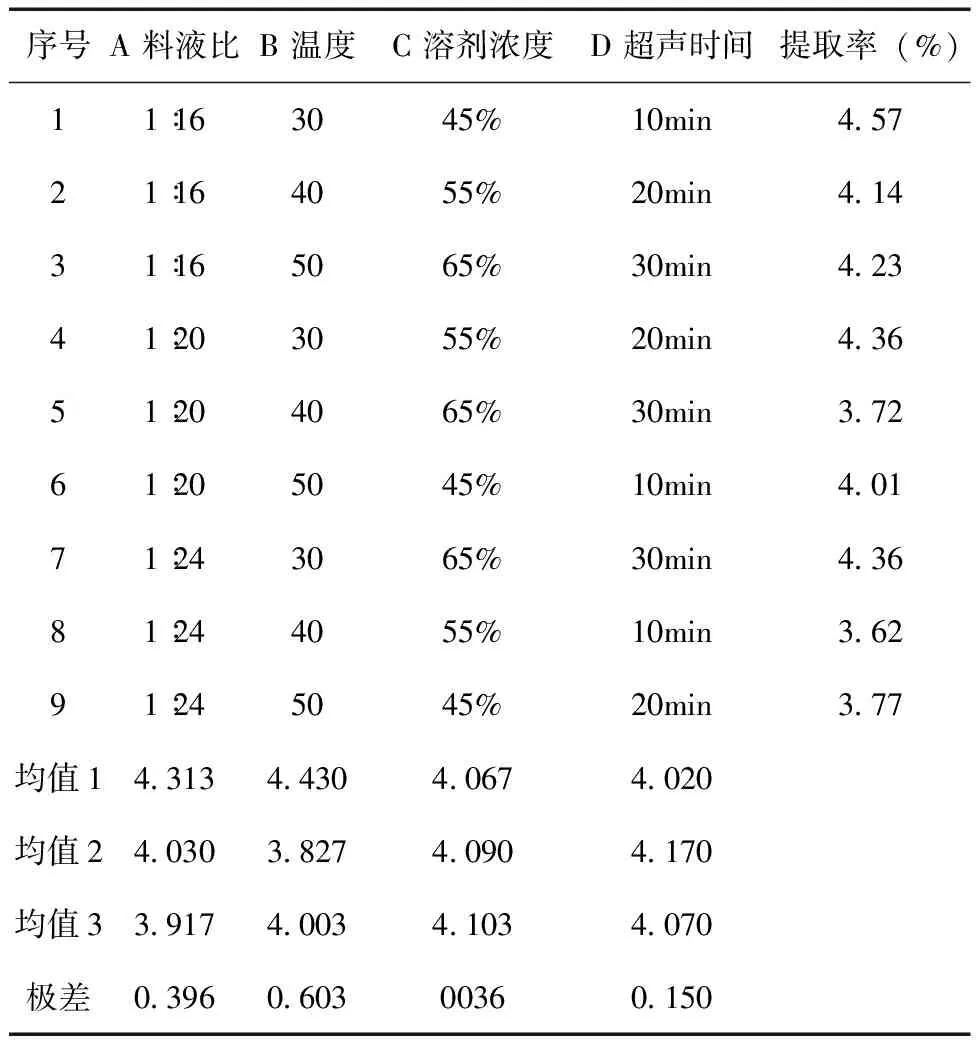
表2 正交試驗結果
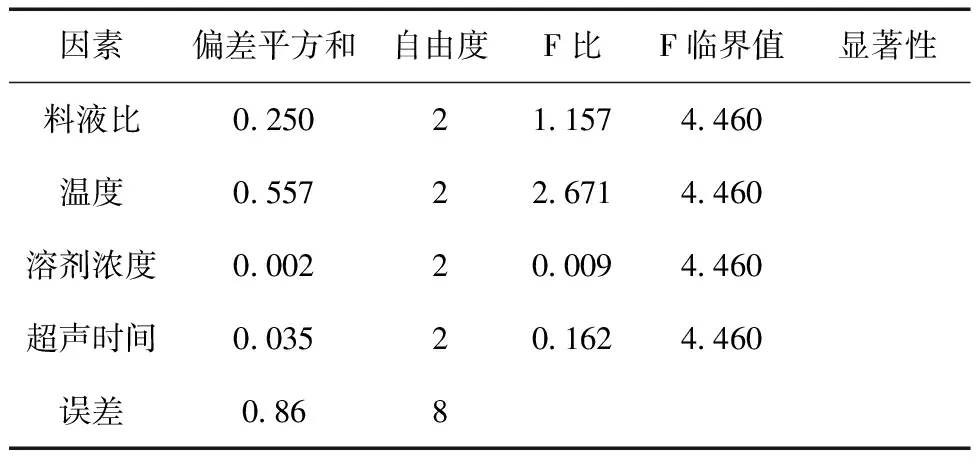
表3 方差分析表(α=0.05)
2.4 驗證試驗 準確稱取3份10.0g的苦豆籽粉,分別置于三角瓶中,各加入160 ml 65% 乙醇,30℃浸泡1h,超聲2次,每次20min,濾過,合并濾液作為提取液。按照“2.1.2”項的方法測定生物堿提取率。其提取率分別為4.55%、4.68%和4.59%,均值4.60%(RSD 1.45%),高于正交試驗中的最高值,表明該工藝切實可行。
3 討論
超聲波提取法在中藥成分提取中的應用越來越廣,且用于生物堿的提取[10],且具有節約時間、節省成本、提取率高、純度好等優點,對于能源消耗大、成本高、生產周期長的中藥規模生產有一定的應用價值[11、12]。本試驗以苦豆籽總生物堿的提取率為指標,采用超聲提取苦豆籽總生物堿,可保證較高的提取效率且節約成本,為苦豆籽總生物堿的中試放大提供了工藝參數,為工業化生產提供了實驗依據。
據報道,生物堿類成分的提取多用甲醇、乙醇等有機溶劑或1%左右的酸水(硫酸或醋酸)[13]。甲醇由于有毒,且不環保,工業生產中使用很少,而乙醇提取比酸水提取徹底,雜質少、提取時間短。故本試驗選擇乙醇作為溶劑進行超聲提取。
試驗選擇了料液比、超聲時間、超聲提取次數、超聲提取溫度和溶劑濃度,尚有溶劑pH值、浸潤時間、超聲功率等因素可供選擇。而在預實驗中發現溶劑pH值、浸潤時間和超聲功率對苦豆籽總生物堿的提取率影響很小,因此后續的試驗中只選擇了試驗的五個因素。其中超聲提取次數經過單因素試驗,超聲提取第2次的提取率為0.42%,第3次的提取率僅有0.09%,故選擇超聲提取2次,未將其作為正交因素之一。正交試驗結果表明,四個因素對苦豆籽總生物堿提取率無顯著性影響,但溫度對生物堿提取率的影響較重要,其他因素影響較小[14]。溫度不宜過高,可能是溫度太高會使生物堿的結構不穩定,發生分解,且溫度太高,乙醇揮發嚴重,也會影響生物堿的提取[15]。另外,料液比對生物堿提取率的影響不大,可能是由于溶劑量的增大使其他成分的溶出率增大從而影響生物堿的溶出,導致提取率變化不大甚至下降[16]。正交試驗為不完全組合性試驗,對其優選出的最佳工藝要進行驗證[17],工藝驗證結果顯示,優選的工藝合理、可行,可用于苦豆籽總生物堿的提取工藝。
[1] 張清云,楊朝霞,趙曉莉,等.寧夏苦豆子資源的保護及其開發利用[J].資源開發與市場, 2011,27(10): 897-899.
[2] 楊巧麗,顧政一,黃華.中藥苦豆子的研究進展[J].西北藥學雜志,2011,26(3): 232-236.
[3] 仲仁山.苦豆子研究及其應用[M].銀川:寧夏人民出版社,983:5.
[4] 梁樣紅,劉穎男,陳光曉,等.苦豆子生物堿的提取方法[J].吉林醫藥學院學報,2008,29(3):168-170.
[5] 余永婷.超聲波提取苦豆子生物堿的工藝研究[J].中國食品添加劑,2008,69(3):69-72.
[6] 張為民,蒲鵬,張德剛,等.從苦豆子種子中提取生物堿的方法研究[J].中國農學通報,2005,21(2):7-9.
[7] 李永春,葉新紅,舒翔,等.微波法提取苦豆子生物堿的研究[J].中國食品添加劑.2008,19(5):73-76.
[8] 邱靖,陳永勝,穆莎茉莉,等.響應面分析法優化超聲提取蓖麻堿工藝[J].天然產物研究與開發,2013,25(8):1124-1129.
[9] 李軍,冷曉紅,郝彩琴.苦豆草生物堿提取方法的研究[J].安徽農學通報,2010,16(17):47-48.
[10] 蘭衛,陶寧,哈木拉提·吾甫爾.胡蘆巴堿超聲提取工藝研究[J],中草藥,2012,43 (11):2200-2202.
[11] 歐小宏,王曉,楊雁,等.正交試驗法優選三七皂苷成分超聲提取工藝[J].中國現代中藥,2012,14(4):48-52.
[12] 朱曉偉,陳建平,布仁,等.超聲提取蒙藥漏蘆花中總皂苷工藝研究[J].中南藥學,2013,11(11):812-814.
[13] 王緒英,向紅,左經會,等.超聲提取永思小檗鹽酸小檗堿工藝的優化[J].南方農業學報,2012,43(4):502-505.
[14] 黃曉玲,鄭兆廣,封亮,等.正交試驗優化板藍根總生物堿的提取工藝[J].中國實驗方劑學雜志,2013,19(9):66-68.
[15] 王玉玲,曾會明,張建秋,等.超聲提取白刺中總生物堿及大孔樹脂純化的工藝研究[J].中南林業科技大學學報,2013,33(1):109-113.
[16] 楊丹丹,莫佳佳,陳林玲,等.超聲提取款冬花中綠原酸的工藝研究[J].中華中醫藥學刊,2013,31(1):118-120.
[17] 梁潔,柳賢福,孫正伊,等.正交實驗法優化龍眼葉提取工藝[J].中國民族民間醫藥,2013,22(1):22-25.
OptimizationofUltrasonicExtractionProcessforTotalAlkaloidsfromSophoraAlopecuroidesL.byOrthogonalTest
Li Jun Hao Cai-qin Ma Xiao-lan Wang Hai-xia Leng Xiao-hong
Ningxia Collage of Vocation and Technology,Ningxia Engineering Technology Research Center of Chinese Herbs Development and Utilization, Yinchuan 750021,China
ObjectiveTo optimize ultrasonic extraction process of total alkaloids from Sophora Alopecuroides L..MethodWith extraction rate of total alkaloids as index,effects of liquid-solid ratio,ultrasonic temperature, ethanol concentration,ultrasonic time, extraction times on extraction process were investigated by single factor test and orthogonal test.ResultThe influencing order of each factors on ultrasonic extraction process of total alkaloids was ultrasonic temperature>liquid-solid ratio>extraction time>ethanol concentration. Optimum extraction process was as following: ultrasonic extracted 2 times with 16 times the amount of 65% ethanol, 20 min one time, ultrasonic temperature 30℃.ConclusionsThis optimized process was stable and feasible with high extraction rate.
Sophora Alopecuroides L.,Total alkaloids, Orthogonal design, Ultrasonic extraction
R284.2
A
1007-8517(2014)08-0024-03
2014.02.10)

