低溫干燥過程中LEA-motif對熱敏性藥物胰島素的活性保護研究
張 燕,李代禧,郭柏松,翟 振,劉 立,楊春生,余華星
(1.上海理工大學食品科學與工程研究所,上海 200093;2.上海東富龍科技股份有限公司凍干工藝研究室,上海 201108)
胚胎發育晚期豐富蛋白[1](LEA)是植物胚胎發育后期種子中大量積累的富含甘氨酸、賴氨酸、組氨酸和其他親水氨基酸的一類蛋白質,因此,LEA蛋白具有很高的親水性以及熱穩定性[2]。LEA蛋白的無序性使其在干燥時,能適應熱敏性蛋白的形狀,吸附在蛋白表面,形成保護層,防止熱敏性蛋白的脫水變性、聚集變性和受熱變性[3-4]。
為了驗證LEA蛋白的保護性,我們選擇典型的熱敏性蛋白藥物——胰島素活性單體作研究對象,第3組 LEA蛋白(AaVLEA1)[5]的特征重復片段(LEA-motif,LEAM)作為保護劑,研究 LEA-motif對熱敏性蛋白藥物的干燥活性保護作用。
1 實驗部分
1.1 材料與儀器
豬胰島素,醫藥級;LEA蛋白特征重復片段(LT130325-LT342888,純度 95.47%);無水硫酸鈉、乙醇胺、磷酸均為分析純。
Waters e2695高效液相色譜儀;Waters e2695分離模塊和Waters2998光電二極管檢測器;LYO-0.2凍干機;XS205天平。
1.2 實驗方法
胰島素濃度為5 mg/mL,加入LEA-motif保護劑,其與胰島素六聚體的摩爾比分別為1∶0,1∶3(即LEA-motif與胰島素單體的摩爾比為 1∶0,1∶18)。
用凍干機進行冷凍干燥。首先將藥物在-45℃預凍 1 h。然后抽真空,一次干燥溫度-35℃,干燥室內真空度為0 Pa,干燥18 h。解析干燥溫度為25℃,直至干燥過程結束,這個過程共持續6 h。凍干結束后,用橡皮塞封玻璃瓶,保存在冰箱中。
1.3 分析方法
1.3.1 胰島素三維結構分析 胰島素采用蛋白質數據庫中的晶體結構(3inc[6])作為初始結構,用Arguslab軟件構建其三維分子模型。
1.3.2 效價分析 HPLC法[7]用十八烷基硅烷鍵合硅膠作為填充劑(4.6 mm ×250 mm,5μm);以0.2 mol/L硫酸鹽緩沖液(無水硫酸鈉28.4 g加水溶解后加磷酸2.7 mL,乙醇胺調節pH值至2.3,加水至1 000 mL)-乙腈(74∶26)為流動相;柱溫為40℃;檢測波長為214 nm;流速1 mL/min。實驗樣品用0.01 mol/L鹽酸溶液制成40 U/mL的溶液,注入液相色譜儀20μL,記錄色譜圖。另取胰島素對照品適量,同法測定。按外標法以峰面積計算效價[8]。
2 結果與討論
2.1 干燥前后胰島素三維結構的變化
在干燥模擬后,在不同水分含量下,添加LEA-motif保護劑前后各個胰島素的三維活性結構見表1。

表1 干燥后胰島素的三維結構比較Table1 3D structures comparison of driedinsulin
由表1可知,沒有LEA保護的胰島素干燥后,整體結構發生很大變化,許多疏水殘基外翻暴露于胰島素單體的分子表面,α-螺旋明顯減少,并大部分轉化為無規則卷曲和β-扭轉,三維結構徹底變形,而且這種變性趨勢隨著干燥程度的增加而增加,這樣嚴重變性的胰島素即使在水溶液中也不可能恢復到初始三維活性結構。然而,添加18 LEA-motif保護劑的胰島素,隨著水分含量的減少,胰島素三維活性結構始終與初始結構沒有明顯區別,且二級結構也保持較好,LEA-motif對胰島素的生物活性保護效果明顯。
2.2 氨基酸殘基B因子分析
B因子也被稱為溫度因子,反映蛋白質分子由于熱振動和構象變化而引起的振動程度[9]。B因子越高,相應部位的構象就越不穩定,表示殘基柔性越強[10]。圖1為胰島素主鏈上各氨基酸殘基的B因子曲線圖。

圖1 水分含量為1.77%時,胰島素主鏈B因子大小Fig.1 B-factor of insulin with water content of 1.77%
由圖1可知,在相同狀態下,β鏈上的數據跳躍更大,說明胰島素β肽鏈氨基酸殘基比α鏈上的更不穩定,殘基柔性越強。未加保護劑的胰島素兩條肽鏈上的氨基酸殘基B因子變換幅度大。這都說明,在干燥過程中,未加任何保護劑的胰島素熱穩定性差,易變形。
添加LEA-motif保護劑后,B因子大小明顯降低很多,且振幅減弱,說明氨基酸殘基更加穩定,殘基部位剛性更強,說明LEA-motif在干燥過程中能維持胰島素的三維活性結構以及二級結構,不因水分缺失而引起胰島素結構變形。與前面分析的三維活性結構分析一致。
2.3 胰島素體系內氫鍵分析

圖2 水分子(A)和LEA-motif(B)分別與胰島素之間的氫鍵數目曲線圖Fig.2 H-bonding number between water(A),LEA-motif(B)and insulin during desiccation
由圖2可知,在干燥過程中,隨著水分含量的減少,水分子與胰島素之間的氫鍵急劇減少(圖2A),而保護劑與胰島素之間形成的氫鍵顯著增多(圖2B),說明LEA-motif能迅速適應缺水環境,形成適應胰島蛋白的形狀,較好的吸附在其表面,形成保護層,保護胰島素不因缺水而受到傷害,很好地維持胰島素的活性結構。這與水替代學說基本一致[11]。再者,蛋白質多肽主鏈中形成的氫鍵決定蛋白質的二級結構,LEA-motif保護的胰島素,主鏈間的氫鍵數目比未加任何保護劑的胰島素主鏈間的多(如圖3A),主鏈間形成的氫鍵可以保護胰島素的二級結構不被破壞,維持三維活性結構的穩定性。
另外,未加保護劑的胰島素隨水分含量的減少,其分子內氫鍵增加顯著(圖3 B),表明胰島素分子內部無序連接的增大,無序連接增大會引起體積的皺縮和親水面積的減小。這些現象均表明其整體三維結構發生了重大變化。

圖3 胰島素主鏈間(A)和胰島素內(B)的氫鍵數目Fig.3 H-bonding number in insulin system during desiccation
2.4 效價分析
圖4 是未加保護劑的胰島素六聚體和添加3 LEA-motif的胰島素六聚體體系(胰島素單體與LEA-motif的摩爾比為1∶18)的3次平行實驗結果的平均值所繪制的色譜圖。圖中第1個峰為LEA-motif特征峰,第2個峰為胰島素特征峰,峰面積大小反應了胰島素六聚體干燥后的活性結構保護效果。
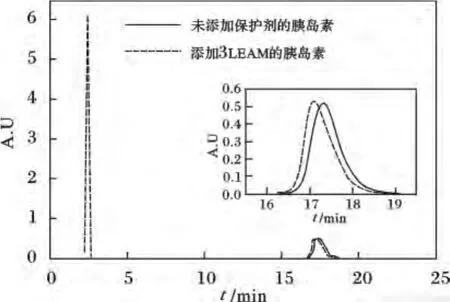
圖4 未加保護劑胰島素和添加3 LEA-motif的胰島素干燥后的色譜圖Fig.4 HPLCcurves of various rehydrated insulin hexamer after dried
凍干胰島素與初始胰島素(初始豬胰島素經高效液相色譜法測得的峰面積為28 146 905.67 μV·s,效價40 U)的效價比繪制的柱形圖,見圖5。
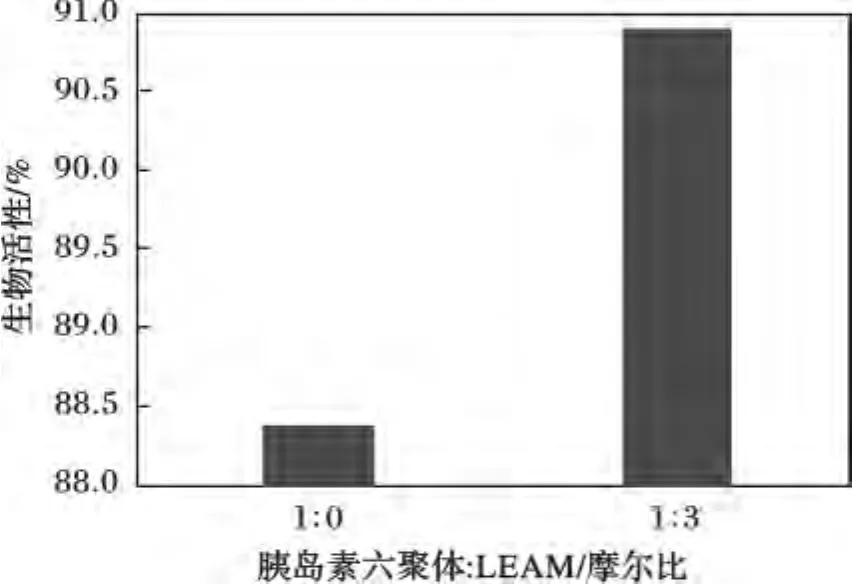
圖5 添加LEA-motif的胰島素與未加保護劑的胰島素凍干后的活性變化Fig.5 Bioactivity of dried insulin in two insulin systems
由圖5可知,未加保護劑的胰島素凍干后效價降低了12%左右,這是由于胰島素六聚體在凍干過程中,受溫度和水分的影響,活性結構輕微發生了變化,從而引起效價降低。添加保護劑后,豬胰島素的效價比明顯提高。說明在凍干過程中,LEA-moitf對胰島素有明顯的保護效果。
3 結論
LEA-motif在干燥過程中能有效限制胰島素的有害熱運動,很好的保護其生物活性結構。LEA-motif保護的胰島素氨基酸殘基振動明顯降低,剛性越強,說明氨基酸殘基更加穩定,胰島素結構在保護劑的作用下得到了很好的保持,胰島素具有較高的穩定性。這主要是隨著水分含量的減少,LEA-motif逐漸取代水分子胰島素形成氫鍵,又因為靜電相互作用的影響,LEA-motif形成適應胰島素的形狀,吸附在其表面,形成保護層,保護胰島素的活性結構。LEA-motif保護的胰島素六聚體凍干后活性更好。
[1] Zhou L,Ji X N,He F,et al.Structure and function of LEA protein in higher plants[J].Journal of Tropical Organisms,2012,3(2):191-196.
[2] Li J,Zhao C Y,Zhang F S,et al.LEA protein and plant stress tolerance[J].Plant Physiology Journal,2010,46(11):1101-1108.
[3] Goyal K,Walton L J,Tunnacliffe A.LEA proteins prevent protein aggregation due to water stress[J].Biochemical Journal,2005,388(1):151-157.
[4] Chakrabortee S,Boschetti C,Walton L J,et al.Hydrophilic protein associated with desiccation tolerance exhibits broad protein stabilization function[J].Proceedings of the National Academy of Sciences of the USA,2007,104(46):18073-18078.
[5] Daixi L,Xiaoming H.Desiccation induced structural alterations in a 66-amino acid fragment of an anhydrobiotic nematode late embryogenesis abundant(LEA)protein[J].Biomacromolecules,2009,10(6):1469-1477.
[6] Krishna R S,Pattabhi V,Rajan SS.Metal induced conformational changes in human insulin:Crystal structures of Sr2+,Ni2+and Cu2+complexes of human insulin[J].Protein and Peptide Letters,2011,18(5):457-466.
[7] Emami J,Hamishehkar H,Najafabadi A R,et al.A novel approach to prepare insulin-loaded poly(lactic-Co-glycolic acid)microcapsules and the protein stability study[J].Journal of Pharmaceutical Sciences,2009,98(5):1712-1731.
[8] State Pharmacopoeia Committee.PRC Codex[M].Beijing:China Medical Science Press,2010:845-846.
[9] Zhang H,Zhang T,Chen K,et al.On the relation between residue flexibility and local solvent accessibility in proteins[J].Proteins:Structure,Function,and Bioinformatics,2009,76(3):617-636.
[10] Pan X Y,Shen H B.Robust prediction of B-factor profile from sequence using two-stage SVR based on random forest feature selection[J].Protein and Peptide Letters,2009,16(12):1447-1454.
[11] Golovina E A,Golovin A V,Hoekstra F A,et al.Water replacement hypothesis in atomic details:Effect of trehalose on the structure of single dehydrated POPC bilayers[J].Langmuir,2010,26(13):11118-11126.

