鎂法脫硫系統脫硫液中重金屬的去除研究
張亞斌
(山西大學工程學院,山西太原 030013)
由于微量重金屬就會對人體造成很大的危害并且容易在人體內富集,使得關于重金屬污染與防治的研究倍受重視[1]。應用氧化鎂進行脫硫后產生大量MgSO4溶液,對MgSO4溶液進行循環濃縮以后可以回收MgSO4·7H2O結晶,然而脫硫液的濃縮過程勢必造成重金屬的富集[2-3]。氫氧化鎂作為一種“綠色安全水處理劑”在重金屬去除方面有良好的效果[4]。文獻[5-10]用氫氧化鎂乳液處理含有單一重金屬的廢水,去除效果顯著。對于含有多種重金屬的混合溶液的處理,H.Scherzberg等[11]用氫氧化鎂脫除廢水中的重金屬離子, 例如 Cu2+、Fe2+、Cr3+、Pb2+等能全部脫除,Ni2+、Cd2+脫除效果一般,對于汞不適用。絡合劑如EDTA和氨的存在對銅和鉛的脫除有干擾。氯化鎂和燒堿沉淀法所得到的氫氧化鎂有利于改善沉降性能,但其脫除能力相對較弱。水合法氫氧化鎂可提供較好的脫除性能,但沉降速度較慢。T.S.R?tting 等[12]用一柱形裝置,將菱鎂礦煅燒得到的氧化鎂作為吸附劑,用于脫除Ni2+、Cd2+、Co2+3種重金屬離子。氧化鎂首先與水生成氫氧化鎂,使得pH上升到8.5左右,然后絮狀氫氧化鎂又與Co2+、Ni2+反應生成氫氧化物形式沉淀,經過濾后得到出水。進水重金屬離子質量濃度高達75 mg/L,出水能夠降到10 μg/L。由于電廠氧化鎂法脫硫廢液所含硫酸鎂質量分數依然能夠達到15%以上,因此,脫硫廢液的繼續回收利用顯得十分必要。
1 實驗部分
1.1 主要儀器設備及材料
儀器:IRIS Intrepid型電感耦合等離子體原子發射光譜儀 (ICP-AES);數顯磁力攪拌器;10 mL針管;0.6 μm水樣過濾器;PHS-3C型酸度計。
材料:乙酸鉛[Pb(CH3COO)2·3H2O]、氯化鉻(CrCl3·6H2O)、 硝 酸 鎘 [Cd(NO3)2·4H2O]、 硫 酸 錳(MnSO4·H2O)、硫酸鐵、氫氧化鈉、鹽酸、無水硫酸鎂,以上試劑均為分析純;氫氧化鎂乳液自制。
1.2 實驗方法
移取100 mL已知重金屬濃度的MgSO4溶液于350 mL燒杯中,調整初始pH為5,加入一定量的Mg(OH)2乳液,攪拌一定時間后,靜置并過濾分離,稀釋10倍后用ICP-AES進行金屬離子濃度的檢測。
2 實驗結果與討論
2.1 對脫硫液結晶濃縮過程中重金屬的富集實驗
進入MgSO4結晶回收系統的脫硫液需要在脫硫系統中經過多次循環氧化濃縮,再冷卻結晶使MgSO4·7H2O與脫硫液進一步分離,使得脫硫液中各種雜質離子濃度增大。為了控制氯對脫硫系統的影響,需要對結晶后的脫硫液按一定比例進行回流和排放。如果此時脫硫液中重金屬含量過大,將會污染脫硫液的二次結晶及外排水。表1是某電廠氧化鎂法脫硫液濃縮結晶后幾種主要重金屬的含量變化情況。
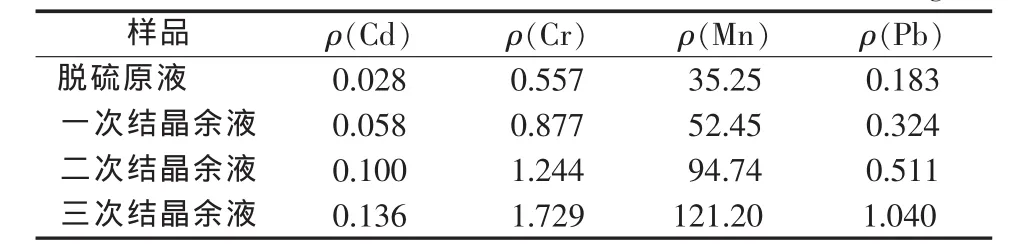
表1 脫硫液中重金屬的ICP-AES檢測結果 mg/L
由于脫硫液經過了蒸發濃縮和結晶析出,使得每次檢測的水樣體積相差約40%~50%,重金屬元素大多在余液中濃縮,同時結晶中也會富集更多的雜質離子從而影響產品品質。此時余液就必須進行重金屬的去除以達到工業外排標準要求,同時減少回流液對再次結晶純度的影響。
2.2 模擬脫硫液中重金屬的去除
當MgSO4結晶后脫硫液中剩余MgSO4的質量分數在26%左右,因此模擬水樣配制成26%MgSO4的溶液,向其中加入一定量重金屬鹽使Pb2+質量濃度達到 25 mg/L、Cr3+質量濃度達到 70 mg/L、Cd2+質量濃度達到5 mg/L、Mn2+質量濃度達到20 mg/L。依照1.2中方法向含重金屬的MgSO4溶液中加入質量分數為16.1%的Mg(OH)2乳液。實驗結果如圖1所示。由圖1可以看出,Pb2+的去除效率一直穩定保持在100%,在 Mg(OH)2乳液加入量為 10 g/L時 Pb2+和Cr3+的去除率都能達到95%以上,說明重金屬間的共沉淀效果明顯;同時在重金屬離子間存在競爭吸附作用,因此Pb2+、Cr3+這2種離子的吸附明顯高于 Cd2+、Mn2+。 而 Cd2+、Mn2+的去除率緩慢增長,由于錳的質量濃度是鎘的4倍,其吸附量高于鎘,因此Mg(OH)2對這4種重金屬離子的吸附量大小排序為 Cr3+>Pb2+>Mn2+>Cd2+。
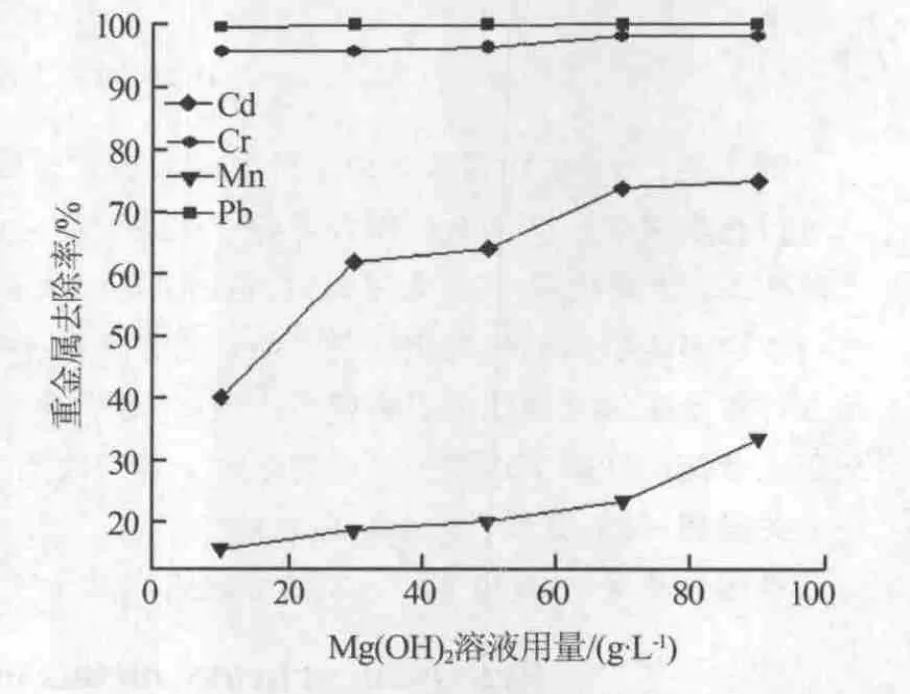
圖1 MgSO4溶液中各重金屬的去除規律
Mg (OH)2乳液加入量為 10、30、50、70、90 g/L時,溶液pH分別為 6.93、7.24、7.47、7.6、7.74。Mg(OH)2乳液達到 90 g/L 時,pH 仍然只有 7.74,說明MgSO4溶液中大量 Mg2+的存在抑制了 Mg(OH)2中OH-的解離。結合圖1可知,在低pH時Cd2+、Mn2+的去除率都不高,當pH到達7.47以后Cd2+、Mn2+去除率有明顯提高。
2.3 Mg(OH)2的回收再利用
由于 Mg(OH)2的溶度積 KSP[Mg(OH)2]=1.2×10-11,尤其在MgSO4溶液中Mg2+的同離子抑制作用使得Mg(OH)2主要以顆粒形式存在于溶液中。根據上述實驗結果可以看出,去除MgSO4溶液中的重金屬所用的Mg(OH)2量比在純水中要大很多,所以Mg(OH)2的回收再利用就顯得十分重要。將使用過的Mg(OH)2沉淀物抽濾壓干,置于400℃馬弗爐中輕燒2 h,得到輕燒氧化鎂。用此氧化鎂代替Mg(OH)2進行對Pb2+的去除實驗,結果如表2所示。
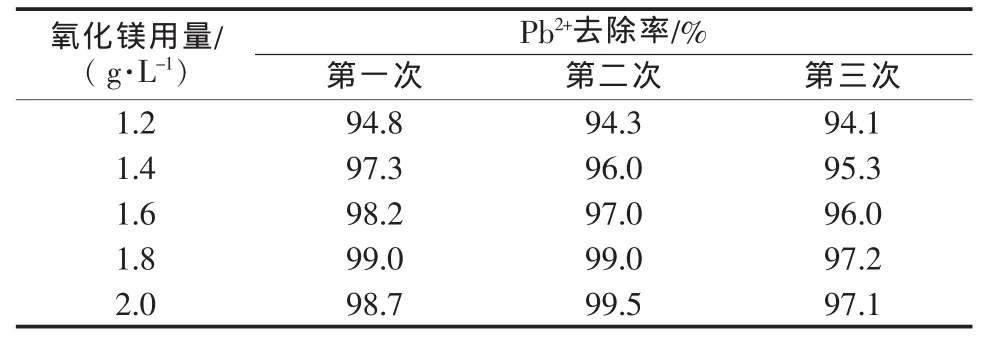
表2 連續3次輕燒氧化鎂的去除效果
對于含有25 mg/L Pb2+的MgSO4溶液,輕燒后的氧化鎂對重金屬的吸附效果依然很好,第三次輕燒后氧化鎂用量在1.6 g/L時Pb2+的去除效率為96%,能使鉛的排放達到國家規定的1 mg/L的標準。在進行了3次輕燒脫水后,2.0 g/L的氧化鎂的去除效率依然達97%以上,說明這種水處理劑可以多次使用。
2.4 pH對重金屬脫除的影響
溶液中重金屬對pH的變化非常敏感,當pH降低時溶液中已經沉淀的重金屬有溶解的傾向。用70 g/L的Mg(OH)2乳液處理的特定濃度重金屬溶液,當通過攪拌及靜置以后加入濃鹽酸分別調節pH為 7、6、5、4,同時進行 200 r/min 攪拌,當 pH 相對穩定后靜置10 min,然后吸取上清液過濾后檢測溶液中重金屬含量,結果見圖2。由圖2可知,Pb2+的去除率隨著pH的降低并沒有明顯的變化,原因可能是Mg(OH)2對鉛的吸附力很強,氫離子更容易替換出被吸附的其他離子。并且在pH=5時Pb2+、Cr3+、Mn2+的去除率相對于最高去除率的降低都小于50%,只有Cd2+的去除率降低了64.3%,說明在微酸性環境中Mg(OH)2乳液對重金屬的吸附脫出相對比較穩定。
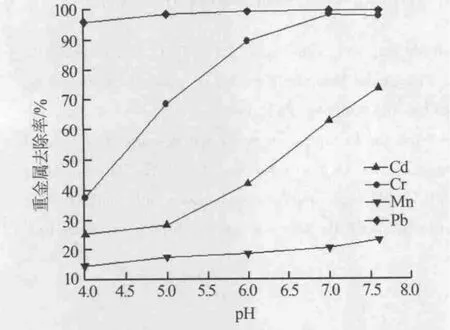
圖2 pH與重金屬脫除率的關系
氧化鎂脫硫液的最終pH一般在5.5~6.5左右,很少會降低到4以下,因此總體來說,通過加入過量的Mg(OH)2處理脫硫液中的重金屬效果穩定并且去除率很高。考慮到MgSO4溶液吸附重金屬后Mg(OH)2的難沉淀特點,完全可以對返回制漿系統的脫硫液不進行過濾,直接用吸附過重金屬的Mg(OH)2進行煙氣脫硫;或者對回流脫硫液不進行重金屬處理,直接進入制漿系統利用氧化鎂脫硫劑進行重金屬的去除。
3 結論
對于含Pb2+、Cr3+、Cd2+、Mn2+的 MgSO4溶液,Mg(OH)2的去除效果明顯。 Pb2+、Cr3+的去除率基本不隨處理劑的改變而變化,Cd2+、Mn2+的去除效果一般,需要調節 pH 來使 Cd2+、Mn2+沉淀。Mg(OH)2作為處理劑以化學吸附為主,所以經過煅燒得到的氧化鎂可以重復利用。降低pH會減弱Mg(OH)2的去除效果,但是當pH降到5時,4種重金屬的去除率減少不多,說明Mg(OH)2的吸附作用較強。電廠氧化鎂法脫硫由于涉及到濃縮結晶,使得脫硫廢液重金屬濃度高于國家的排放標準,因此必須要進行處理;更重要的是由于脫硫廢液中硫酸鎂含量很高,本著節能減排的要求,硫酸鎂的回收也是十分必要的。對于鎂法脫硫技術來說,氫氧化鎂作為水處理劑能夠達到一種理想效果就是無其他無機鹽類的引入就能達到很好的脫除重金屬的效果,同時處理過的脫硫液還能返回脫硫濃縮系統繼續濃縮生產MgSO4·7H2O結晶。這樣使得電廠鎂法脫硫技術能夠得到更廣泛的推廣和應用,增強了此技術的優勢。
[1]武漢大學.分析化學[M].2版.北京:高等教育出版社,1993:308-314.
[2]柴明,崔可,徐康富,等.氧化鎂濕法煙氣脫硫回收工藝的技術經濟可行性初步分析[J].環境污染治理技術與設備,2006,7(4):38-40,73.
[3]崔可,柴明,徐康富,等.回收法氧化鎂濕法煙氣脫硫機理與工藝基礎研究[J].環境科學,2006,27(5):846-849.
[4]郭如新.氫氧化鎂應用近期進展[J].海湖鹽與化工,2001,30(4):25-27.
[5]姜述芹,于秀娟,周保學,等.含鉻廢水的氫氧化鎂凈化研究[J].哈爾濱工業大學學報,2004,36(8):1080-1084.
[6]馮雪冬,馬艷飛.氫氧化鎂對Cr(Ⅲ)吸附特性研究[J].中國礦業,2009,18(2):101-104.
[7]馬艷飛,王九思,宋光順,等.氫氧化鎂對廢水中鎘(Ⅱ)吸附性能的研究[J].蘭州鐵道學院學報,2003,22(4):120-122.
[8]趙大傳,樊瑞雪,楊厚玲,等.氫氧化鎂對廢水中鎳(Ⅱ)吸附性能的研究[J].山東建筑大學學報,2007,22(5):421-424.
[9]于泊蕖,呂樹芳,馬建薇.鎂劑在重金屬離子脫除方面的應用研究進展[J].煤炭技術,2010,29(5):218-221.
[10]程國斌,吳艷平,馬偉.鎂化合物在工業廢水處理中的研究應用現狀[J].工業水處理,2006,26(7):7-10.
[11]Scherzberg H,Kaps S,Schultheis B.Binding of heavy metals from salt-containing waters by magnesium hydroxide[J].Freiberg.Forschungsh.A,2000(59):170-190.
[12]R?tting T S,Cama J,Ayora C.Use of caustic magnesia to remove cadmium,nickel,and cobalt from water in passive treatment systems:column experiments[J].Environmental Science&Technology,2006,40(20):6438-6443.

