5-ALA表面修飾TiO2誘導的光動力療法體外滅活HL60細胞實驗研究*
林柏瀚,陳 麗,洪旭亮,肖 化,艾保全,熊建文*
(1.華南師范大學物理與電信工程學院,廣東廣州 510006;2.廣東工業大學物理與光電工程學院,廣東廣州 510006)
光動力療法作為一種臨床治療癌癥的方法,具有靶向性好(僅將光敏劑周圍的病變細胞作為目標)以及對病患傷害小的優點,因此被廣泛地應用于腫瘤的治療[1]。在光動力療法中,光敏劑吸收特定波長的光,將能量轉移到分子氧,進而產生一系列的活性氧,起到滅活癌細胞的作用[2]。5-氨基乙酰丙酸(5-ALA)屬于有機酸類,是生物合成光敏劑原卟啉IX(PPIX)的前體物,是臨床上應用最廣泛的光敏藥物,基于5-ALA的PDT(ALA-PDT)已成功用于膀胱癌、皮膚癌和食道癌等癌癥的治療[3]。然而,如何提高其對白血病腫瘤細胞的滅殺靈敏度,以及應對多類型的癌癥仍然是ALA-PDT所迫切需要解決的問題。
最近幾年,二氧化鈦(TiO2)憑借良好的生物相容性、環境友好性以及對腫瘤細胞的選擇性,TiO2開始成為一種潛在的光敏劑,應用于PDT研究中[4-7]。在紫外光波輻照下,TiO2表面產生光生空穴-電子對,光生空穴能夠跟溶液中的水或者羥基反應,生成活性氧,從而誘導滅活癌細胞[8,9]。研究表明,利用TiO2表面獨特的物理和化學性質,通過羧基(-COOH)與TiO2表面羥基(-OH)的鍵合,可將一些帶有羧基的染料分子或者有機酸類包覆在TiO2的表面,提高 TiO2光電轉化效率,光催化效率和分散性[10-14]。因此,本文將帶有羧基的5-ALA包覆在TiO2納米顆粒的表面,并使用傅里葉紅外光、拉曼光譜以及紫外-可見光吸收光譜對制備的樣品進行了表征,利用相襯顯微鏡對PDT作用前后的細胞進行細胞無損形態學觀察。我們的目的在于利用TiO2的運載作用提高PDT靶向作用,從而達到提高5-ALA體外滅活HL60細胞的效率,并對5-ALA/TiO2體外滅活HL60細胞作用機理作了初步探討。
1 材料與方法
1.1 細胞株
HL60細胞株,由中山大學實驗動物中心細胞庫提供。
1.2 試劑與儀器
TiO2(P25,德國 DEGUSSA),5-ALA(上海先輝醫藥),CCK-8試劑(日本同仁化學研究所),RPMI-1640培養基(美國Gibco),傅立葉紅外光譜儀(美國Nicolet 6700),激光顯微拉曼光譜儀(香港Renishaw雷尼紹),超聲儀器(上海科導),U-3010紫外可見光度計(日本日立),相襯顯微鏡(天津拓普儀器),XDS-1A倒置顯微鏡(廣州光學儀器),自動細胞計數器(美國Invitrogen),LPE-1A激光功率能量計(北京物科光電),PDT反應室(自行設計),SW-CJ型潔凈工作臺(蘇州安泰空氣技術),HH.CP-TW80升二氧化碳培養箱(上海一恒科技),DG5031型酶聯免疫檢測儀(南京華東電子),96孔培養板,6孔培養板,細胞計數板及其他常規器皿,403 nm光源(自行設計)。
1.3 實驗方法
1.3.1 5-ALA表面修飾的二氧化鈦納米顆粒(5-ALA-TiO2)的制備 在暗室條件下,稱量2.62 mg的5-ALA和3.2 mg的TiO2,分散于裝有5mL超純水的玻璃試管中,密封并震蕩搖勻,TiO2懸浮于溶液中,隨后將試管置于超聲加熱器中,40℃超聲處理4 h,使材料充分反應。5-ALA和TiO2的混合摩爾比例為:1∶2。作為對比,在相同的條件下制備TiO2和5-ALA樣品。
1.3.2 細胞培養 HL60細胞培養在胎牛血清含量10%的 RPMI-1640培養基,并置于 37℃,5%CO2,95%空氣濕度的培養箱中培養,取指數生長期的細胞進行實驗。
1.3.3 細胞活性檢測 采用與傳統的細胞活性檢測方法MTT法相比,操作方便、簡潔、靈敏度高、重復性好的 CCK-8(Cell Counting Kit-8)法[15,16],以 490 nm為測量波長,630 nm為參比波長對細胞進行活性檢測,降低實驗誤差。
2 實驗結果與討論
2.1 樣品光譜分析
2.1.1 傅里葉紅外光譜與拉曼光譜分析 在樣品中,TiO2納米粒子與5-ALA分子可能的結合方式主要為兩種,一種為普通的物理附著,一種為化學結合。圖1為TiO2和5-ALA/TiO2傅里葉紅外光譜。圖1(A)為純TiO2的譜線,3350 cm-1附近為TiO2表面羥基峰,圖1(B)為表面包覆了5-ALA的TiO2的譜線,由圖可見,在1430 cm-1附近和1730 cm-1附近出現了羧酸酯(-COOTi-)特征峰,這說明,5-ALA與TiO2表面活性較高的羥基發生了類似于羧酸和醇生成脂的反應。此外,圖1(B)中可觀察到3350 cm-1附近的羥基峰相對圖1(A)對應峰有所減弱,這是因為5-ALA與TiO2表面的羥基反應,消耗了部分羥基,導致3350 cm-1處的峰減弱,這進一步說明兩者確實發生反應。該反應可寫成:
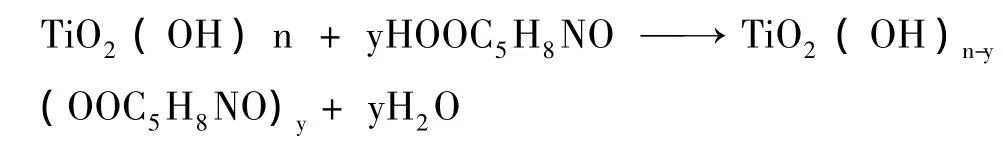
這表明5-ALA與TiO2通過羧基以及羥基的鍵合成功的結合,而不是普通的物理附著。這一點在圖2得到了驗證,5-ALA/TiO2的拉曼光譜中1423 cm-1附近和1728 cm-1可以很清楚地觀察到羧酸酯(-COOTi-)的特征峰。
2.1.2 紫外可見光光譜分析 圖3是純TiO2以及5-ALA/TiO2的紫外可見光吸收光譜。5-ALA與TiO2二者結合之后對TiO2在可見光范圍吸收的影響較為明顯,也進一步說明二者之間結合緊密。圖中,純TiO2在400 nm附近的吸收較弱,當5-ALA結合在TiO2表面時,樣品在400 nm附近的吸收明顯增強。樣品在可見光范圍吸收增強,能夠提升樣品在可見光照射下的光催化活性,于是在一定程度上提高樣品滅活癌細胞的效率。
以上分析說明了制備的樣品中5-ALA與TiO2結合緊密,并且在可見光范圍吸收增強,可作為一種新型的光敏藥物用于后續的細胞滅活實驗。
2.2 5-ALA/TiO2介導的 PDT體外滅活 HL60細胞實驗
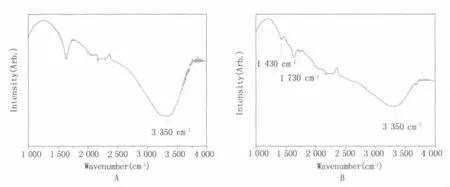
圖1 TiO2和5-ALA/TiO2傅里葉紅外光譜Fig.1 The FTIR spectra of TiO2and 5-ALA/TiO2
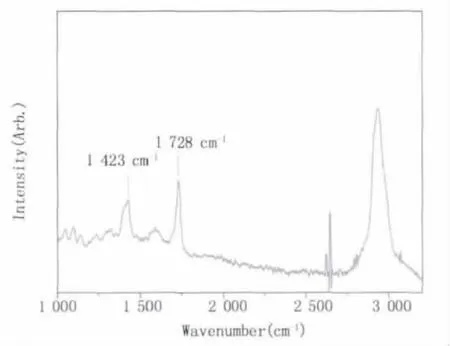
圖2 5-ALA/TiO2的拉曼光譜Fig.2 Raman spectra of 5-ALA/TiO2
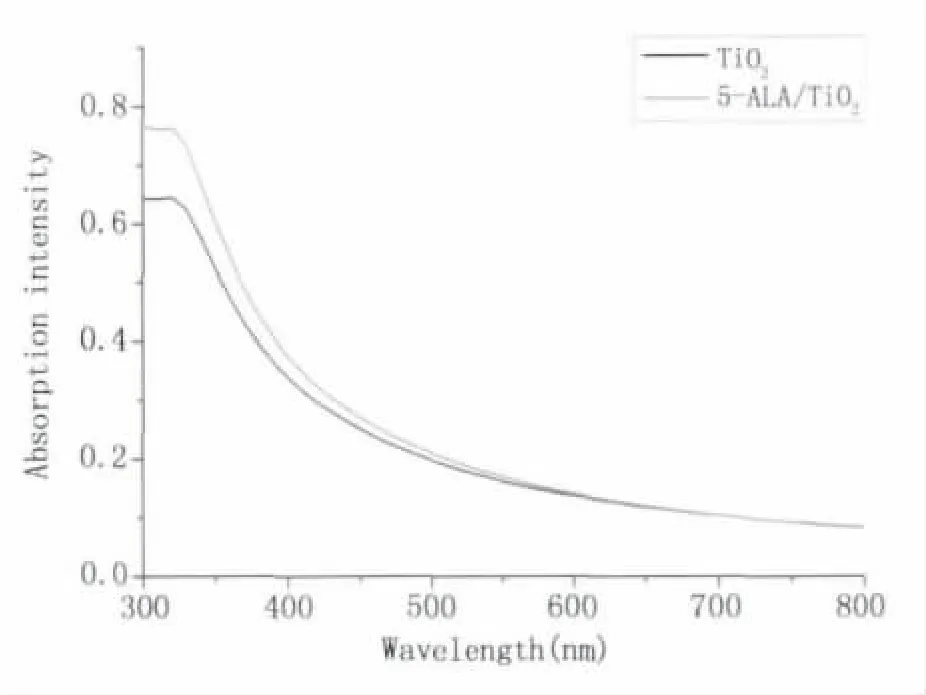
圖3 TiO2和5-ALA/TiO2的吸收光譜Fig.3 The absorption spectrum of TiO2and 5-ALA/TiO2
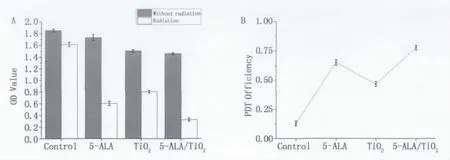
圖4 各實驗組OD值與PDT效率Fig.4 OD value and PDT efficiency of different groups
將對數生長期HL60細胞接種于2塊96孔培養板中,編號分別為A、B,每塊培養板劃分為4組,分別為 Control組、TiO2組、ALA組、5-ALA/TiO2組。B板置于培養箱中培養24小時后,ALA組加適量的ALA,使培養液中ALA的終值濃度為1 mmol/L;TiO2組加適量的TiO2,使培養液中 TiO2的終值濃度為160μg/mL;5-ALA/TiO2組加適量制備好的摩爾比為1∶2的5-ALA/TiO2,使培養液中5-ALA終值濃度為1 mmol/L、TiO2終值濃度為2 mmol/L(160μg/mL)。放回培養箱中繼續培養;B板放培養箱中培養24小時后接受光照(光功率5 mW/cm2,光劑量18 J/cm2,光波長403±6 nm),然后放回培養箱中繼續培養24小時;A板置于培養箱中培養48小時,不光照。每個實驗條件設3個復孔,每孔總體積200μL,細胞接種濃度1×105個/mL。采用CCK-8法進行細胞活性檢測。得出各組的OD值如圖4(A)。
由圖4(A)可知,在無光照情況下,5-ALA、TiO2、5-ALA/TiO2組細胞的OD值相對于各自對應的無光照細胞組的OD值無明顯變化,這表明各組樣品對細胞沒有暗毒性;光照后,各Without radiation組細胞的OD值均高于Radiation組細胞的OD值,此外在5-ALA/TiO2作用下接受光輻照后的細胞相對成活率要低于TiO2或5-ALA單獨作用下接受光輻照后細胞的相對成活率。圖4可知,5-ALA/TiO2的滅活效率相對于5-ALA和TiO2有明顯提高,達到了77.9%。
結合前面的光譜分析,滅活效率提高的可能機理是:首先5-ALA分子與TiO2納米顆粒結合緊密,PDT實驗中TiO2納米顆粒作為藥物載體,5-ALA易于集中作用,在小區域范圍內5-ALA濃度增大,轉化和聚集的PpIX增多,另外在TiO2納米顆粒的牽引下,更多的5-ALA進入細胞內,提高5-ALA的利用率,從而提高滅殺效率;其次TiO2納米顆粒吸收了較短波長的光以后被激發,并將能量轉移至5-ALA,光能利用效率加大,從而提高了對HL60細胞的滅殺效率。
2.3 相襯顯微鏡細胞形態學無損觀研究
2.3.1 相襯顯微鏡細胞形態學無損觀察 利用相襯顯微鏡觀察5-ALA/TiO2作用過程中細胞形態變化,相比掃描電鏡,相襯顯微鏡觀測是一種對細胞無損的觀察方法,無需對細胞進行前期固定處理,幾乎不影響細胞,保持細胞原始狀態,利于我們初步探討5-ALA/TiO2滅活細胞的機理。圖5(A)以及圖5(E)均為PDT作用前的細胞,此時的細胞飽滿,輪廓清晰,與周圍環境有明顯的界限,由于細胞表面平整光滑,整個細胞在視場中較為明亮。當光照15分鐘時,由圖5(B)可知此時的細胞邊緣開始模糊,細胞膜出現褶皺,此時細胞在視場中較為暗淡,這表明所制備藥物在光能的激發下開始與細胞膜發生作用。圖5(C)光照時間30分鐘后的表面,此時細胞在視場中與圖5(B)中細胞一致,較為模糊暗淡,然而此時的細胞膜開始出現破裂(圖中左上角處),并且在破裂處可以看到細胞內物質外流,這說明了所制備的藥物能夠有效地破壞細胞膜。光照1小時后,圖5(D)顯示細胞萎縮變形,部分成碎片。對比圖5(A)和圖5(F)可知,PDT作用后,視場內的細胞明顯減少,只剩余少數細胞殘骸,其形貌與圖5(D)一致。

圖5 PDT作用前后的細胞形態學觀察(A:作用前的細胞;B:作用15分鐘的細胞;C:作用30分鐘的細胞;D:作用1小時的細胞;E:作用前細胞;F:作用后的細胞)Fig.5 The morphology of untreated and treated HL60 cells(A:The untreated cells;B:Cells treated by 15 minutes PDT;C:Cells treated by 30 minutes PDT;D:Cells treated by 1 hour PDT;E:The untreated cells;F:The treated cells)
2.3.2 藥物作用機理探討 以上觀察表明,隨著光照時間的增加,即光劑量的增加,藥物對光子吸收越多,與周圍環境作用產生的活性氧越多,于是對細胞的破壞能力就越強。相襯顯微鏡細胞形態學無損觀察表明,5-ALA/TiO2對細胞的部分作用靶點首先是細胞膜,藥物通過與細胞膜接觸并在光子激發下釋放活性氧,誘導細胞膜破裂,隨后細胞內部營養物質以及一部分細胞器流失,從而誘導細胞凋亡。相襯顯微鏡細胞形態學觀察進一步表明,制備的藥物能夠有效抑制細胞生長。此外,在幾幅圖片中都可以看到細胞內有一些細小的斑點,這有可能是進入細胞內部的部分納米粒子。
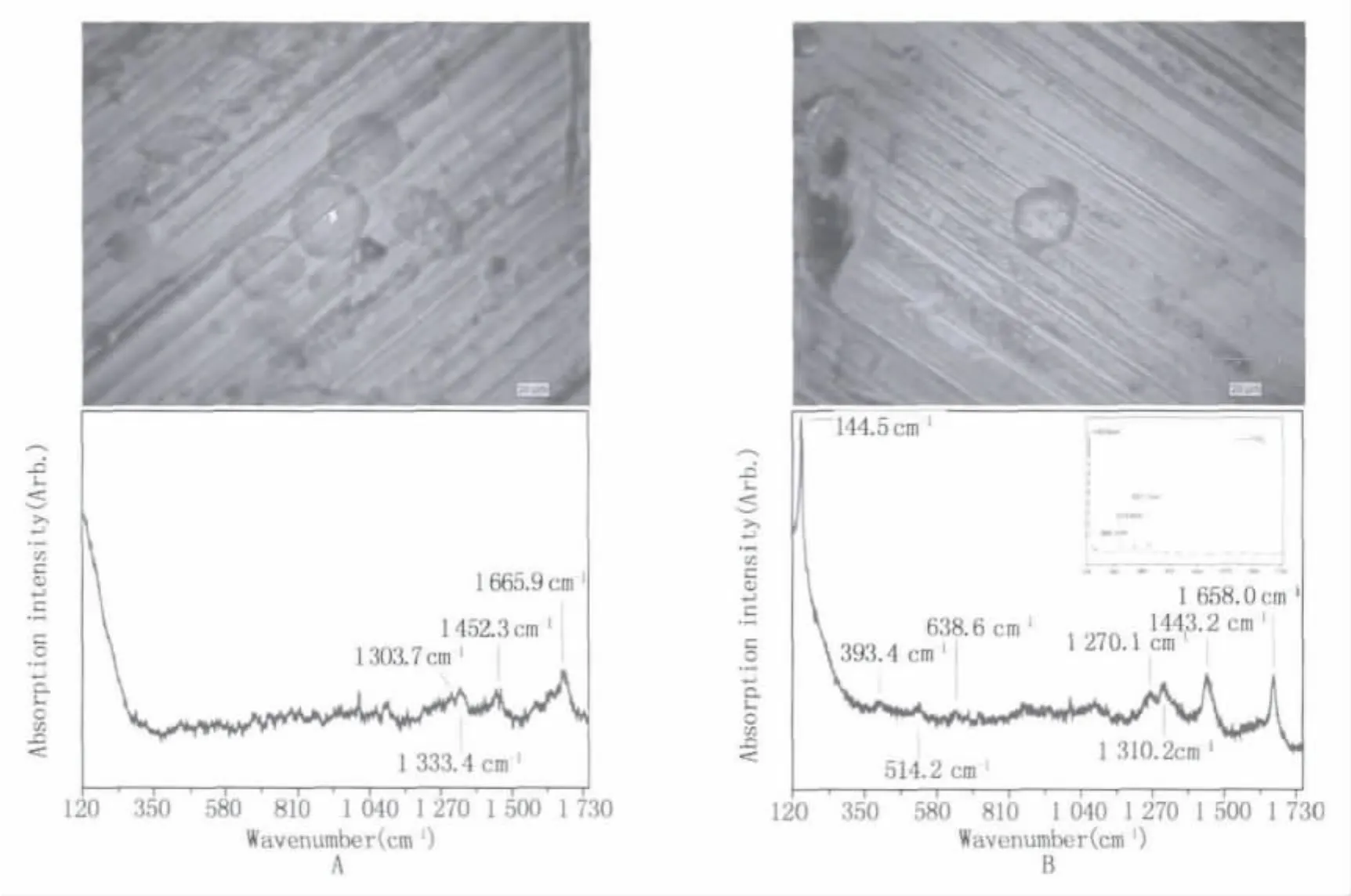
圖6 激光顯微拉曼光譜檢測圖(A:HL60細胞拉曼光譜;B:加入TiO2培養24 h的HL60細胞)(附圖為TiO2的拉曼光譜)Fig.6 The Micro Raman spectroscopy picture(A:The Micro Raman spectroscopy picture of HL60 cells,B:The Micro Raman spectroscopy picture of HL60 cells cultured with TiO2for 24 h)(The attached picture is the Micro Raman spectroscopy picture of TiO2)
2.3.3 激光顯微拉曼光譜儀檢測細胞內納米粒子 圖6(A)是HL60細胞激光顯微拉曼光譜檢測圖,6(B)是與適當濃度TiO2一起培養24 h的HL60細胞的檢測圖。實驗中,我們將激光光斑聚焦在細胞上(圖6上圖),得到細胞的拉曼光譜(圖6下圖)。由圖A可知,HL60細胞的拉曼光譜在波數120 cm-1附近出現較強的峰,波數 1303.7 cm-1,1333.4 cm-1,1452.3 cm-1和 1665.9 cm-1出現峰。圖 B 顯示,與TiO2一起培養的HL60細胞拉曼光譜在圖6(A)對應波數處附近均出現峰并在波數144.5 cm-1出現新峰,在波數 393.4 cm-1,514.2 cm-1和 638.3 cm-1位置微隆起,對比純TiO2的拉曼光譜(圖B虛線圖),可知此時的HL60細胞內存在TiO2納米粒子。對比A、B兩圖可知,細胞對應峰以及TiO2對應峰的位置均發生不同程度的偏移,并且B圖的峰強度得到了增強,這表明,加入TiO2納米粒子以后,TiO2納米粒子與HL60細胞發生一定的相互作用。以上分析可知,TiO2納米粒子在與細胞一起培養的過程中,能夠進入細胞,并與細胞發生一定的相互作用。
3 結論
我們將傳統光敏劑5-ALA與TiO2結合,利用傅里葉紅外光譜、拉曼光譜以及吸收光譜對制備的樣品進行表征,結果表明5-ALA與TiO2結合緊密且5-ALA提高了TiO2在可見光范圍的吸收;在5-ALA/TiO2介導的PDT體外滅活HL60細胞實驗研究中,由于TiO2納米粒子使5-ALA相對集中,提高了靶向性;5-ALA與TiO2之間的能量交換提高了光能利用率,提高了細胞滅活效率;此外,利用相襯顯微鏡對PDT過程中細胞形態學變化進行無損觀察,初步探討了5-ALA/TiO2誘導細胞凋亡的機制,結果顯示藥物首先與細胞膜發生作用,隨著輻照時間的增加,藥物對細胞膜破壞更加明顯,導致細胞膜破裂,胞內營養物質流失,最終誘導細胞凋亡,PDT滅活效率達到77.9%,而激光顯微拉曼光譜檢測表明TiO2能夠進入細胞內部,并與細胞發生相互作用。至于5-ALA/TiO2在細胞中的精確定位,及其對細胞內部的具體作用機制我們將在后續的實驗研究中探討。實驗最終表明,通過表面修飾法制備的5-ALA/TiO2能夠有效抑制HL60細胞生長,是治療白血病的一種潛在的光敏劑。
[1]ALLISON R R,SIBATA C H.Oncologic photo dynamic therapy photosensitizers:a clinical review[J].Photodiagosis and Photodynamic Therapy,2010,7(2):61-75.
[2]JUZENAS P,CHEN W,SUN Y P,et al.Quantum dots and nanoparticles for photodynamic and radiation therapies of cancer[J].Advanced Drug Delivery Reviews,2008,60(15):1600-1614.
[3]AGOSTINIS P,BERG K,CENGEL K A,et al.Photodynamic therapy of cancer:an update[J].CA Cancer Journal for Clinicians,2011,61(4):250-281.
[4]WANG C,CAO S,TIE X,et al.Induction of cytotoxicity by photoexcitation of TiO2can prolong survival in gliomabearing mice[J].Molecular Biology Reports,2011,38(1):523-530.
[5]STEFANOU E,EVANGELOU A,FALARAS P.Effects of UV-irradiated titania nanopatecles on cell proliferation,cancer metastasis and promotion[J].Catalysis Today,2010,151(1-2):58-63.
[6]LEE C,HONG C,KIM H,et al.TiO2nanotubes as a therapeutic agent for cancer thermotherapy[J].Photochemistry and Photobiology,2010,86(4):981-989.
[7]LóPEZ T,ALVAREZ M,GONZáLEZ R D,et al.Synthesis,characterization and in vitro cytotoxicity of Pt-TiO2nanoparticles[J].Adsorption,2011,17(3):573-581.
[8]WANG J,GUO Y,LIU B,et al.Detection and analysis of reactive oxygen species(ROS)generated by nano-sized TiO2powder under ultrasonic irradiation and application in sonocatalytic degradation of organic dyes[J].Ultrasonics Sonochemistry,2011,18(1):177-183.
[9]THEVENOT P,CHO J,WAVHAL D,et al.Surface chemistry influences cancer killing effect of TiO2nanoparticles[J].Nanomedicine,2008,4(3):226-236.
[10]XU J,ZHAI C,ZHENG B,et al.Large efficiency improvement in nanoporous dye-sensitized solar cells via vacuum assistant dye adsorption[J].Vacuum,2012,86(8):1161-1164.
[11]LEE K E,GOMEZ M A,ELOUATIK S,et al.Further understanding of the adsorption mechanism of N719 sensitizer on anatase TiO2films for DSSC applications using vibrational spectroscopy and confocal raman imaging[J].Langmuir,2010,26(12):9575-9583.
[12]MARINADO T,HAHLIN M,JIANG X,et al.Surface molecular quantification and photoelectrochemical characterization of mixed organic dye and coadsorbent layers on TiO2for dye-Sensitized solar cells[J].J Phys Chem C,2010,114(27):11903-11910.
[13]鄒玲,烏學東,陳海剛,等.表面修飾二氧化鈦納米粒子的結構表征及形成機理[J].物理化學學報,2001,17(4):305-309.ZOU Ling,WU Xuedong,CHEN Haigang,et al.Structural characterization and formation mechanism of surface-modified titanium dioxide nanoparticles[J].Acta Phys-Chim Sin,2001,17(4):305-309.
[14]李宗威,朱永法.TiO2納米粒子的表面修飾研究[J].化學學報,2003,61(9):1484-1487.LI Zongwei,ZHU Yongfa.Study on the Surface-modification of TiO2nanoparticles[J].Acta Chmica Sinica,2003,61(9):1484-1487.
[15]ZENG H,KORBELIK M,MCLEAN D I,et al.Monitoring photoproduct formation and photobleaching by fluorescence spectroscopy has the potentialto improve PDT dosimetry with a verteporfin-like photosensitizer [J]. Photochem Photobiol,2002,75(4):398-405.
[16]熊建文,肖化,張鎮西.MTT法和CCK-8法檢測活細胞活性之測試條件比較[J].激光生物學報,2007,16(5):526-531.XIONG Jianwen,XIAO Hua,ZHANG Zhenxi.Experimentalresearch on different detection conditions between MTT and CCK-8[J].Actalaser Biology Sinica,2007,16(5):526-531.

