老年人非酒精性脂肪肝與胰島素抵抗的關系
王西鳳,邢 華
(首都醫科大學宣武醫院綜合科,北京 100053)
隨著我國居民生活水平的提高,近年來非酒精性脂肪肝(nonalcoholic fatty liver,NAFLD)發病率逐年增高,成為常見的肝病。NAFLD是彌漫性肝細胞大泡性脂肪變為主要特征的臨床病理綜合征,包括單純性脂肪肝、脂肪性肝炎、脂肪性肝纖維化和脂肪性肝硬化4個病理過程。NAFLD指患者肝內脂肪儲量>5%,并且排除乙醇、病毒、自身免疫和肝毒性藥物的使用等[1]。肥胖已被證實是非酒精性脂肪肝的高危因素,胰島素抵抗與NAFLD的關系成為目前研究的熱點[2]。本研究對老年NAFLD患者與非NAFLD的臨床資料、生化指標及胰島素抵抗指數等進行了調查,探討老年人NAFLD與胰島素抵抗的關系。
1 資料與方法
1.1 一般資料
收集2008-09~2012-10在我院內科住院的≥60歲的老年患者112例,其中男90例,女22例,年齡60-87歲,平均(69.76±9.49)歲。NAFLD 的診斷以B超影像學檢查來確診,并且排除就診前有糖尿病史、冠心病、心衰及嚴重感染者。112例患者分為2組:非NAFLD組60例和NAFLD組52例。非 NAFLD 組年齡(70.6±10.3)歲,NAFLD 組年齡(68.8±8.2)歲,非 NAFLD 組男性 49例,占81.7%,NAFLD組男性41例,占78.8%,兩組間年齡和男女比例無統計學差異,具有可比性。
NAFLD診斷標準:2006年中華醫學會肝臟病學分會提出的標準[3],具備以下3項腹部超聲異常發現中的任意兩項或兩項以上者可診斷為NAFLD。①肝臟近場回聲彌漫性增強(明亮肝),回聲強度高于腎臟;②肝內管道結構顯示不清;③肝臟遠場回聲逐漸衰減。
排除標準:①男性每日飲用乙醇>20g,女性每日飲用乙醇>10 g;②存在可導致脂肪肝的全身性疾病以及正在服用或近期曾服用可引起血清ALT和GGT升高的藥物的患者;③乙型肝炎、丙型肝炎、自身免疫性肝病等慢性肝病以及肝臟惡性腫瘤、感染及膽道疾病。
1.2 方法
所有研究對象在入院后測量身高、體重、腰圍(肋骨下緣與髂前上棘連線中點的經線)、臀圍(股骨粗隆水平的經線),并計算體質量指數(BMI)、腰臀比(WHR),第2天清晨采空腹靜脈血測總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDLC)、低密度脂蛋白膽固醇(LDL-C)、丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、血肌酐(Cr)、空腹血糖(FPG)、空腹胰島素(FINS)。胰島素抵抗指數(HOMA-IR)=FBG(mmol/L)×FINS(mU/L)/22.5。
1.3 統計學分析
2 結果
2.1 兩組間一般資料比較
兩組間 BMI、WHR、TC、TG、CRP、HDL-C、LDLC、ALT、Cr、FPG、FINS 和HOMA-IR 比較見表1。NAFLD 組 BMI、WHR、TG、ALT、FPG、FINS 和HOMA-IR較非NAFLD組高,差異有統計學意義。
2.2 Logistic回歸分析
將BMI、WHR、TG、ALT 和HOMA-IR 作為自變量,將是否為非酒精性脂肪肝作為應變量,進行Logistic回歸分析顯示:BMI、WHR、TG、HOMA-IR 是非酒精性脂肪肝的獨立影響因素。
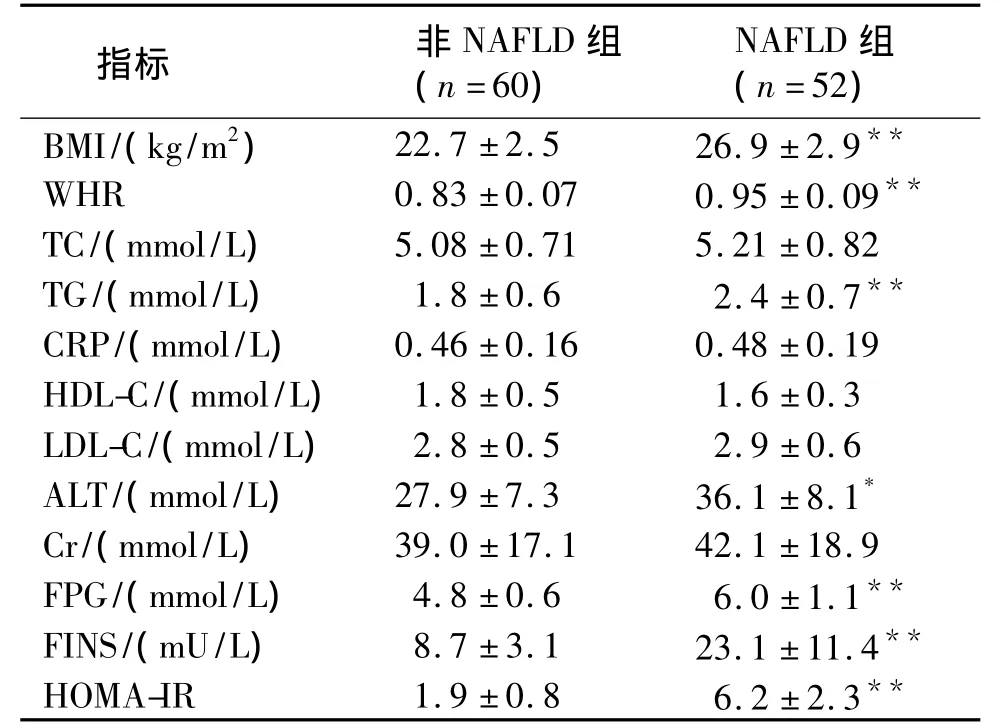
表1 兩組間一般資料分析Table 1 Comparison of baseline between two groups

表2 多因素Logistic回歸分析結果Table 2 The multivariate Logistic regression analysis of risk factors for NAFLD
3 討論
NAFLD的發病機制主要為游離脂肪酸增多引起的胰島素抵抗和氧化應激,胰島素抵抗是指外周組織對胰島素的敏感性及反應性降低,胰島素的生物學效應下降。很多研究提示NAFLD可能是胰島素抵抗在肝臟的一種表現[4]。NAFLD可導致肝硬化、肝細胞癌和肝功能衰竭,但其主要的死亡原因卻是心腦血管事件[5]。很多研究發現NAFLD可能與心血管疾病發生的風險增加密切相關,NAFLD時通過更嚴重的胰島素抵抗、持續性的高胰島素血癥、脂代謝的紊亂以及亞臨床炎癥狀態等危險因素一起促成動脈粥樣硬化的發生和發展[6]。甚至有人提出NAFLD不僅可能是心血管疾病發生的一個標志,甚至可能作為一個媒介誘發了心血管疾病[7]。
本研究顯示,NAFLD 組 BMI、WHR、TG、ALT 和HOMA-IR較非NAFLD組高。肥胖患者的NAFLD的患病率比體重正常的人要高出4-6倍[8]。肥胖由于可誘發胰島素抵抗,導致周圍組織攝取和利用葡萄糖能力下降,肝攝取游離脂肪酸增加;同時腹內脂肪分解形成的FFA也更容易通過門靜脈系統進入肝臟,作為底物合成TG;此外肝細胞將脂肪轉運出肝臟的能力受損,均促進了脂肪肝的形成[9]。高脂血癥中,高甘油三酯血癥患者較高膽固醇血癥患者NAFLD危險性更大[10]。ALT在肝細胞胞質內合成,是反映肝細胞炎癥的敏感指標,ALT水平與胰島素抵抗相關,可能是NAFLD的標志之一[11,12]。轉氨酶改變是胰島素抵抗引起肝臟脂質代謝異常和氧化應激增加導致肝細胞損傷以及肝臟脂肪沉積而引起的[13]。Adams等為期11年的隨訪研究結果表明在排除了其他肝臟疾病之后,以ALT>40 U/L診斷的NAFLD是發生2型糖尿病和MS的重要危險因素[14]。
本研究顯示,胰島素抵抗是NAFLD的獨立影響因素,提示胰島素抵抗加重NAFLD的病理進程,與以往研究結果一致[15]。胰島素抵抗主要通過加強周圍組織脂肪分解和高胰島素血癥兩個途徑導致脂肪在肝細胞內儲積。胰島素抵抗可減弱和/或破壞胰島素對脂肪代謝的調節作用,增加脂質溶解,提高循環中血游離脂肪酸濃度,血清中游離脂肪酸增多,而肝細胞對脂肪酸的高攝入導致線粒體氧化超載,加重肝細胞內脂肪酸的儲積。胰島素抵抗引起NAFLD的機制可能包括減少脂肪細胞膜上的蛋白脂酶、增加激素敏感脂酶的活性、增加肝脂酶活性等,導致肝細胞內游離脂肪酸增高、TG合成增加,從而引起肝細胞內TG過多積聚導致脂肪肝的形成[16]。游離脂肪酸增多,可以通過抑制胰島素釋放、干擾胰島素對血糖的正常作用來加重胰島素抵抗,還可阻斷絡氨酸磷酸化的細胞信號,因此,有學者提出非酒精性脂肪肝不但與胰島素抵抗伴隨,并且是胰島素抵抗的早期標志[17]。
綜上所述,老年人中胰島素抵抗與NAFLD關系密切,胰島素抵抗在NAFLD發生發展中起重要作用。因此,臨床上對于NAFLD患者應更多地關注于胰島素抵抗,改善胰島素抵抗及整體的代謝紊亂,預防心腦血管疾病的發生。
[1]Angulo P.Obesity and nonalcoholic fatty liver disease[J].Nutr Rev,2007,65(S1):S57-63.
[2]Gaggini M,Morelli M,Buzzigoli E,etal.Non-alcoholic fatty liver disease(NAFLD)and its connection with insulin resistance,dyslipidemia,atherosclerosis and coronary heart disease[J].Nutrients,2013,5(5):1544-1560.
[3]中華醫學會肝臟病學分會脂肪肝和酒精性肝病學組.非酒精性脂肪肝病診療指南[J].中華肝臟雜志,2006,14(2):161-163.
[4]Guenther B.Fatty acid-induced inflammation and insulin resistance in skeletal muscle and liver[J].Curr Sci Inc,2006,6:177-181.
[5]Ekstedt M,Franzen LE,Mathiesen UL,etal.Long-term follow-up of patients with NAFLDand elevated liver enzymes[J].Hepatology,2006,44:865-873.
[6]Ali R,Cusi K.New diagnostic and treatment approaches in nonalcoholic fatty liver disease[J].Ann Med,2009,41:265-278.
[7]原麗敏,劉青,郭蔚瑩,等.肥胖兒童非酒精性脂肪肝病與胰島素抵抗的關系[J].中國全科醫學,2008,11(11):1928-1929.
[8]Gupte P,Amarapurkar D,Agal S,etal.Non-alcoholic steatohepatitis in type 2 diabetes mellitus[J].Gastroenterol Hepatol,2004,19(8):854-858.
[9]Henao-Mejia J,Elinav E,Jin C,etal.Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity[J].Nature,2012,482(7384):179-185.
[10]Fan JG,Zhu J,Li XJ,etal.Prevalence of and risk factors for fatty liver in a general population of Shanghai,China[J].J Hepatol,2005,43(3):508-514.
[11]Schindhelm RK,Diamant M,Badker SJ,etal.Liver alanine aminotransferase,insulin resistance and endothelial dysfunction in normotriglyceridaemic subjects with type 2 diabetes mellitus[J].Eur J Clin Invest,2005,35(6):369-374.
[12]Schindhelm RK,Diam ant M,Dekker JM,etal.A1anine aminotransferase as a marker of non-alcoholic fatty liver disease in relation to type 2 diabetes mellitus and cardiovascular disease[J].Diabetes Metab Res Rev,2006,22(6):437-443.
[13]趙玲,杜娟,徐勉,等.2型糖尿病合并非酒精性脂肪性肝病與胰島素抵抗及血脂代謝紊亂的關系[J].中華內分泌代謝雜志,2012,28(1):16-20.
[14]Adams LA,Waters OR,Knuiman MW,etal.NAFLD as a risk factor for the development of diabetes and the metabolic syndrome:an eleven year follow-up study[J].Am J Gastroenterol,2009,104:861-867.
[15]Yoo HJ,Hwang SY,Cho GJ,etal.Association of glypican-4 with body fat distribution,insulin resistance,and nonalcoholic Fatty liver disease[J].J Clin Endocrinol Metab,2013,98(7):2897-2901.
[16]Bradbury MW.Lipid metabolism and liver inflammation.Hepatic fatty acid uptake:possible role in steatosis[J].Am JPhysiol Gastrointest Liver Physiol,2006,290(2):G194-G198.
[17]Roland M,Fairbank J.The Roland-Morris disability questionnaire and the oswestry disability questionnaire[J].Spine,2000,25(24):3115-3124.

