青年甲狀腺功能亢進癥合并腦梗死、腦萎縮1例及文獻復習
王科文,張亞萍,張 洋,趙明利
(中國人民解放軍第三醫(yī)院內分泌科,寶雞 721004)
甲狀腺功能亢進癥(簡稱甲亢)是指甲狀腺合成與分泌過量甲狀腺激素而引起的神經(jīng)、循環(huán)、消化等系統(tǒng)興奮性增高和代謝亢進為主要表現(xiàn)的一組疾病的總稱。臨床上以高代謝癥候群、甲狀腺腫大、突眼癥、神經(jīng)及心血管系統(tǒng)功能紊亂為主要特征,而引起腦梗死、腦萎縮特別是青年腦梗死、腦萎縮者較為罕見。青年缺血性腦梗死大多指40歲以下腦卒中患者,而短暫性腦缺血發(fā)作(TIA)約占中青年腦血管病病例的1/3,其發(fā)展成腦梗死的幾率較小,故在卒中人群中所占比例不高,但近年來發(fā)病率呈增高趨勢,青年(15-45歲)缺血性腦卒中發(fā)病率約為(2-10)/10萬人口,40歲以下腦卒中發(fā)病占全部腦卒中的10%-20%[1]。了解和掌握其致病病因和相關危險因素對指導治療和預防具有重要意義。我們現(xiàn)報道1例青年甲亢合并腦梗死、腦萎縮的病例資料,結合學習國內外相關文獻,以進一步了解和熟悉它的臨床特點和發(fā)病機制。
1 病例資料
患者,男性,24歲,主因“乏力、消瘦4年,間斷性左側肢體抽搐4 d”入院。患者4年前活動時突然出現(xiàn)雙下肢無力癥狀,發(fā)作時不能站立,休息后可緩解。同年參軍后在部隊訓練時多次出現(xiàn)四肢無力癥狀,口服氯化鉀溶液后癥狀逐漸好轉,后在長春市人民醫(yī)院檢查發(fā)現(xiàn)甲狀腺功能高于正常,診斷為“甲狀腺功能亢進癥”,給予口服“他巴唑片”抑制甲狀腺素合成及分泌治療,但患者依從性差,間斷口服藥物治療,未定期復診。近4年來出現(xiàn)消瘦、心慌、手抖癥狀。20d前因“他巴唑”供應中斷,自行停藥治療,4 d前出現(xiàn)發(fā)作性左側肢體抽搐、蜷縮不適,無大小便失禁、意識不清,每次持續(xù)約5 min后自行緩解。患者既往身體一般,無煙酒嗜好。入院查體:T 36.6 ℃,P 112 次/min,R 19 次/min,BP 140/80 mmHg,雙側甲狀腺Ⅱ度腫大,可聞及血管雜音,心肺腹查體未見明顯異常。神經(jīng)科查體:意識清醒,言語清楚、理解力、記憶力、定向力、計算力、判斷力及邏輯思維力基本正常,四肢肌力肌張力基本正常,感覺功能正常,生理反射對稱存在,左下肢Babinski征及其他病理反射(+),右下肢病理反射及腦膜刺激(-)。Glassgow意識評分14分。入科后再次出現(xiàn)左側肢體抽搐癥狀,伴舌根發(fā)硬,不能言語,頭顱CT示:①右側額葉深部及半卵圓區(qū)多發(fā)性腔隙性腦梗死;②腦白質脫髓鞘改變;③腦萎縮。輔助血常規(guī):中性粒細胞比率38.3%(參考值54%-62%);堿性磷酸酶221.00 U/L(參考值42-128 U/L);腎功測定:肌酐29.00 μmol/L(參考值44-133 μmol/L)、葡萄糖6.8 mmol/L(參考值3.9-6.1 mmol/L);同型半胱氨酸28.00μmol/L(參考值0-15 vmol/L);甘油三酯0.50 mmol/L(參考值0-1.71 mmol/L),總膽固醇2.46 mmol/L(0-5.17 mmol/L),高密度脂蛋白膽固醇0.91 mmol/L(參考值 0.83-2.80 mmol/L),低密度脂蛋白膽固醇 1.45 mmol/L(參考值 2.07-3.1 mmol/L)。甲狀腺功能測定:T33.433 ng/ml(0.72-1.9 ng/ml),T4212.378 ng/ml(41.0-120.2 ng/ml),F(xiàn)T311.833 pmol/L(3.3-8.5 pmol/L),F(xiàn)T4>200.000 pmol/L(10-24 pmol/L),hTSH 0.083 μU/L(0.4-4.0 μU/L),促甲狀腺受體抗體 TRAb 26.90 U/L(<5 U/L),抗甲狀腺微粒體抗體 TM-Ab 29.%(<15%),甲狀腺球蛋白抗體TG-Ab 54.00%(<30%),甲狀腺過氧化物酶抗體85.0%(<20%)。尿常規(guī)、糞常規(guī)、電解質、血凝四項、D-二聚體等均未見明顯異常。心電圖示:竇性心動過速。甲狀腺彩超檢查示:甲狀腺聲像圖改變符合甲狀腺功能亢進改變。頸部血管彩超:雙側頸動脈及椎動脈血流通暢。經(jīng)顱多普勒超聲(TCD)檢查發(fā)現(xiàn)腦血管輕度狹窄。頭顱MRI(增強)示:①右側額葉異常強化影,考慮缺血性改變;②雙側側腦室后角周圍及左側半卵圓中心腦白質點狀脫髓鞘;③腦萎縮(見圖1)。腦電圖檢查示:正常。
2 結果
2.1 療效
入院后給予抗甲狀腺藥物抑制甲狀腺素合成與分泌、改善循環(huán)、營養(yǎng)神經(jīng)、抗血小板聚集等對癥支持治療,半月后病情好轉出院,出院時Glassgow意識評分:15分。出院后繼續(xù)給予口服抗甲狀腺藥物等對癥支持治療,定期門診復查甲狀腺功能、血常規(guī)、頭顱CT等相關實驗室檢查,病人最終痊愈。
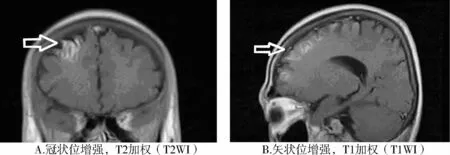
圖1 患者入院時行頭顱MRI(增強)示:腦梗死、腦萎縮
2.2 不良反應
患者在院外治療期間曾發(fā)生一過性白細胞計數(shù)減少,給予口服升白細胞藥物治療后白細胞計數(shù)恢復正常,之后復查血常規(guī)均在正常范圍,未發(fā)現(xiàn)其他明顯不良反應。
3 討論
甲狀腺是人體最大的內分泌腺,其分泌的甲狀腺激素在促進人體正常生長發(fā)育、物質能量代謝及維持神經(jīng)系統(tǒng)的興奮性等方面發(fā)揮著極其重要的作用,其功能異常可導致多系統(tǒng)多器官受損。早在1988年Petersen等報道甲亢與卒中發(fā)病可能相關[2],此后亦有研究表明甲亢可能增加老年人心源性卒中的風險[3]。但由于其發(fā)病機制的復雜性,甲亢與腦梗死之間的關系長期未能明確。青年甲亢合并腦梗死最早由Kushima等[4]于1991年報道,近年來隨著國內外對甲亢特別是青年甲亢合并腦梗死關注度的提高以及相關研究報道的增多,對甲亢與腦梗死二者之間關系的認識不斷提高,新的研究成果亦不斷涌現(xiàn)。近年研究發(fā)現(xiàn)甲亢患者患腦血管病的風險增高,2010年Sheu等[5]前瞻性調查研究大樣本的甲亢和不伴甲亢而因其他疾病為主訴就診的青年患者時發(fā)現(xiàn)5年內甲亢組腦梗死的發(fā)病風險是非甲亢組的1.44倍,由此可以看出甲亢明顯增加青年腦梗死的風險。2011年Brandt等報道甲亢同時還會增加腦卒中的死亡率[6]。盡管目前廣大學者對甲亢合并腦梗死有了初步的了解和掌握,但由于其發(fā)病機制長期以來未完全明確,故仍需進一步探討研究。
3.1 發(fā)病機制
甲亢合并缺血性腦梗死、腦萎縮的發(fā)病機制極為復雜,可能有以下幾個主要方面的原因。
3.1.1 自身免疫因素 甲亢是一種自身免疫性疾病,而近年來研究發(fā)現(xiàn)腦血管病也存在免疫功能異常改變,因此推測免疫介導是甲亢合并腦梗死發(fā)病的一個重要因素。免疫紊亂導致的動脈炎癥可能是甲亢患者顱內血管狹窄或呈煙霧樣改變的關鍵因素,而由免疫紊亂所產(chǎn)生的自身抗體可導致血小板活化聚集,激活某些淋巴因子以及免疫調節(jié)蛋白、細胞間黏附分子等,最新研究認為這些免疫因子與心腦血管病血栓形成有關,與Hwang等[7]研究報道甲亢患者有形成上矢狀竇血栓的潛在發(fā)病趨勢結果基本一致。在既往的機制研究中,Tendler等[8]研究認為甲亢合并腦血管狹窄或閉塞的患者,血管調節(jié)異常和細胞的增殖與甲狀腺激素的免疫刺激有關,而這種免疫刺激主要通過T細胞實現(xiàn),同時這種免疫機制也可以用來解釋腦梗死患者常合并其他免疫疾病(如抗磷脂綜合征、系統(tǒng)性紅斑狼瘡等)的原因。Shi等[9]研究發(fā)現(xiàn)甲狀腺自身抗體與年輕中風患者顱內動脈狹窄之間存在一定的聯(lián)系,潛在免疫發(fā)病機制有助于了解顱內動脈狹窄形成的免疫機制。本文患者也存在明顯的免疫紊亂證據(jù),其甲狀腺自身抗體明顯高于正常水平。以上這些都表明自身免疫因素可能在甲亢合并缺血性腦梗死、腦萎縮的發(fā)病中起著重要作用。
3.1.2 交感神經(jīng)興奮性增加 頸交感神經(jīng)興奮性增加導致顱內動脈痙攣,同時也是腦血管病的致病因素之一。甲亢患者過高的甲狀腺激素水平可能增強了顱內血管對交感神經(jīng)的反應,促進了顱內血管的病理改變。甲狀腺素分泌增加導致交感神經(jīng)興奮性增高,血中兒茶酚胺轉變?yōu)槿ゼ啄I上腺素增加,致使小動脈痙攣,血黏度增高。血黏度增高且小動脈痙攣易引起血管內膜損傷,黏附血小板隨之聚集,形成栓塞,引起腦血管病的發(fā)生。Czarkowski等[10]研究發(fā)現(xiàn)甲狀腺激素加速了甲亢患者的血管硬化,導致血管的韌性降低。動脈痙攣和血管硬化均為腦血管病的重要致病因素,可導致患者顱內血管的多發(fā)狹窄或閉塞,最終導致多發(fā)腦梗死。本例患者發(fā)生了右側額葉深部及半卵圓區(qū)多發(fā)性腔隙性腦梗死、腦萎縮,可能因甲狀腺素長期過高導致頸交感神經(jīng)興奮性增加,從而促進了腦血管病的發(fā)生、發(fā)展,最終導致了腦梗死、腦萎縮的發(fā)生。
3.1.3 動脈粥樣硬化因素 既往研究結果表明,甲亢時因甲狀腺激素分泌過多導致交感神經(jīng)興奮性增高,在加速糖吸收的同時增加糖原分解和糖異生作用,導致患者血糖增高或糖耐量異常,甚至發(fā)生糖尿病。糖耐量異常是腦梗死的重要危險因素之一,高血糖可進一步加重梗死后腦損害。同時甲亢患者過高的甲狀腺激素水平可能促使患者形成高同型半胱氨酸血癥。而糖耐量異常、高同型半胱氨酸血癥促使動脈粥樣硬化的形成和發(fā)展,所以臨床上對那些糖耐量異常或伴高同型半胱氨酸血癥等代謝異常的動脈粥樣硬化患者,尤其是青年患者,應特別注意其血液中游離甲狀腺素水平。本例患者輔助檢查結果提示高同型半胱氨酸血癥和空腹血糖高于正常,空腹血糖受損,提示發(fā)生腦動脈粥樣硬化風險較大。Ran等[11]在研究未經(jīng)治療的甲亢患者頸動脈僵硬度時發(fā)現(xiàn),在去除年齡、血脂水平等因素影響后,所有導致動脈僵硬的參數(shù)與血漿甲狀腺激素水平呈正相關,支持甲亢對動脈粥樣硬化有促進作用。腦萎縮指因各種原因導致腦組織本身發(fā)生器質性病變而產(chǎn)生萎縮的一類神經(jīng)精神性疾病,由遺傳、腦外傷、中毒后遺癥、腦梗死、腦炎腦膜炎、腦缺血、缺氧、腦血管畸形、腦部腫瘤、腦中風、癲癇長期發(fā)作、煙酒過度、營養(yǎng)不良、甲狀腺功能病變、腦動脈硬化、煤氣中毒、酒精中毒等多種病因引起,導致腦實質破壞和神經(jīng)細胞的萎縮、變形、消失,其中最主要的致病因素是腦血管長期慢性缺血而造成的,CT及MRI(核磁共振)等影像學檢查可發(fā)現(xiàn)。本例患者甲亢病情長期未控制,我們根據(jù)其病史特點,初步考慮為甲亢未控制,長期慢性腦供血不足所致腦梗死、腦萎縮。
3.1.4 心源性因素 甲亢時甲狀腺素分泌增加,增加心臟正性變時變性改變,除引起心肌收縮力加強、興奮性增高、耗氧量增加外,還可導致心臟瓣膜和心肌受累,引起心肌肥大,心臟負荷過重,心功能減退,瓣膜病變,可造成心律失常和附壁栓子形成或脫落而發(fā)生腦栓塞。
3.1.5 甲狀腺素增高因素 既往許多學者研究發(fā)現(xiàn)甲狀腺素增高會加重腦損傷,Rastogi等[12]研究發(fā)現(xiàn)誘導處于甲亢狀態(tài)的大鼠發(fā)生短暫性腦缺血發(fā)作,再灌注3 d后處死,甲亢組大鼠神經(jīng)功能缺損增加,病死率明顯高于非甲亢組,梗死面積的增加與甲狀腺素增高的劑量有關,這些研究支持甲狀腺素增高是獨立的危險因素。可能因過高的甲狀腺素明顯增加基礎代謝率,使包括大腦、心臟、肝臟等在內的多器官處于高代謝、高消耗狀態(tài),腦部能量代謝和氧消耗明顯增加,特別是血管狹窄的患者腦血管本身灌注儲備能力已有所下降,進一步加重腦損傷。
3.1.6 血管狹窄因素 血管狹窄是疾病發(fā)生的另一重要因素,但目前病因尚不清楚,Wakamoto等[13]報道了1例甲亢伴發(fā)腦出血的病例,血管造影發(fā)現(xiàn)頸內動脈末端血管狹窄,給予相應治療1年后復查血管造影顯示血管狹窄恢復,推測血管狹窄是由血管痙攣引起的。此外研究發(fā)現(xiàn)血液中超量的甲狀腺素可以改變血管的順應性,使血管收縮,增加交感神經(jīng)系統(tǒng)的敏感性,影響血管自身調節(jié),最終發(fā)生血流動力學改變,并通過增加頸動脈硬度,進一步加重血管損傷,血管硬度受血中甲狀腺素水平的影響,血中FT3和FT4濃度越大,血管越僵硬,控制甲亢后血管硬度明顯下降,說明甲亢時血管壁受到損傷。
此外,還有學者報道甲狀腺功能失調會導致凝血-纖溶系統(tǒng)平衡障礙。國內有學者研究發(fā)現(xiàn)甲亢患者凝血、抗凝及纖溶等系統(tǒng)均有不同程度的異常,表現(xiàn)為不同程度的凝血功能增強,但目前甲亢患者出現(xiàn)凝血功能異常的機制尚不清楚。甲亢患者往往體內抗血友病因子(vWF)、凝血因子Ⅷ、組織型纖溶酶原激活物t-PA等促凝因子明顯增高,紅細胞比積增加,血小板黏附作用增強,導致血流動力學異常,血流淤滯,使腦灌注量下降,并促進腦血栓形成[14]。
3.2 診斷及治療
綜上所述,甲亢與腦梗死、腦萎縮之間有著密切的關系。自身免疫因素、交感神經(jīng)興奮性增高、動脈粥樣硬化因素、心臟因素、甲狀腺素增高及血管狹窄等因素可能促進了甲亢合并腦梗死、腦萎縮的發(fā)生與發(fā)展。因此對于中青年甲亢患者,當突然出現(xiàn)肢體無力、四肢抽搐等神經(jīng)系統(tǒng)癥狀時,要想到腦梗死的可能,可先行腦CT檢查,必要時行頭顱MRI(增強),因MRI可以顯示更多的解剖結構,相應的疾病診治范圍也明顯得到了拓寬。有條件的醫(yī)院,可視病情進一步行血管造影術和單光子發(fā)射計算機斷層成像術(SPECT)。對腦梗死患者,尤其是血管造影提示血管狹窄的患者,在尋找病因時要考慮到甲亢的可能。
臨床上遇到青年腦梗死患者,未發(fā)現(xiàn)有其他卒中原因時,需要明確是否合并有甲亢,若有應及時行針對性治療。在治療腦梗死的同時,也要積極控制甲亢。抗甲狀腺藥物通過抑制甲狀腺過氧化物酶,進而抑制酪氨酸的碘化及耦聯(lián)而影響甲狀腺激素的代謝,同時還具有免疫調節(jié)作用,直接抑制甲狀腺細胞活性,并影響甲狀腺抗原表達,使自身抗體產(chǎn)生減少,從而緩解甲亢癥狀。對于那些血管造影術和SPECT顯示有嚴重腦灌注損傷和腦血管儲備能力下降的高危患者,要根據(jù)病情及時進行手術或介入治療[14],血運重建和抗甲狀腺藥物治療對于高危甲亢患者防止病情加重都是必需的。對于同時患有多發(fā)顱內動脈狹窄和甲亢的患者應積極控制甲狀腺素水平,預防腦血管病。若伴有顱內血管的狹窄或閉塞,據(jù)Ohba等[15]研究報道可以選擇單純藥物治療和/或在藥物治療的基礎上行頸淺動脈-大腦中動脈吻合術,至于手術治療有無必要,取決于患者血管狹窄或閉塞的形成機制。如果患者顱內血管的改變是因免疫因素導致或起主要作用,手術治療可能是必要的。此外,有國外學者[16]研究發(fā)現(xiàn)甲亢患者的甲狀腺素水平經(jīng)治療恢復正常后,血管造影結果顯示狹窄部位已恢復正常,患者神經(jīng)系統(tǒng)損害也因甲亢病情的控制而呈可逆性轉歸,預后良好,這說明治療甲亢是關鍵所在。如治療及時,患者大多可獲得較滿意療效,治療后神經(jīng)功能恢復也較好,不遺留有嚴重神經(jīng)功能缺損[15]。
[1]Jovicevic M,Divjaki,Slankamenac P,etal.Non-atherosclerotic arteriopathy as the cause of ischemic stroke among young adults[J].Med Pregl,2010,63(5-6):324-332.
[2]Petersen P,Hansen JM.Stroke in thyrotoxicosis with atrial fibrillation[J].Stroke,1988,19(1):15-18.
[3]Squizzato A,Gerdes VE,Brandjes DP,etal.Thyroid diseases and cerebrovascular disease[J].Stroke,2005,36(10):2302-2310.
[4]Kushima K,Satoh Y,Ban Y,etal.Graves’thyrotoxicosis and moyamoya diseases[J].Can J Neurol Sci,1991,18(2):140-142.
[5]Sheu JJ,Kang JH,Lin HC,etal.Hyperthyroidism and risk of ischemic stroke in young adults:a 5-year follow-up study[J].Stroke,2010,41(5):961-966.
[6]Brandt F,Green A,Hegedus L,etal.A critical review and metaanalysis of the association between overt hyperthyroidism and mortality[J].Eur J Endocrinol,2011,165(4):491-497.
[7]Hwang JU,Kwon KY,Hur JW,etal.The role of hyperthyroidism as the predisposing factor for superior sagittal sinus thrombosis[J].J Cerebrovasc Endovasc Neurosurg,2012,14(3):251-254.
[8]Tendler BE,Shoukri K,Malchoff C,etal.Concurrence of Graves’disease and dysplastic cerebral blood vessels of the moyamoya variety[J].Thyroid,1997,7(4):625-629.
[9]Shi Z,Zhang X,Chen Z,etal.Elevated thyroid autoantibodies and intracranial stenosis in stroke at an early age[J].Int J Stroke,2013,10(9):2171-2177.
[10]Czarkowski M,Hilgertner L,Powalowski T,etal.The stiffness of the common carotid artery in patients with Graves’disease[J].Int Angiol,2002,21(2):152-157.
[11]Ran Lee,Kihye Sung,Yong Mean Park,etal.A caseof moyamoya disease in a girl with thyrotoxicosis[J].Yonsei Med J,2009,50(4):594-598.
[12]Rastogil,Gupta S,Godbole MM.Pathophysiological basis for thyrotoxicosis as an aggravating factor in post-ischemic brain injury in rats[J].JEndocrinol,2008,196(2):335-341.
[13]Wakamoto H,Ishiyama N,Miyazaki H,etal.The stenoses at the terminal portion of the internal carotid artery improved after initiation of antithyroid therapy:a case report[J].No Shinkei Geka,2000,28(4):379-383.
[14]Erem C.Thyroid disorders and hypercoagulability[J].Semin Thromb Hemost,2011,37(1):17-26.
[15]Ohba S,Nakagawa T,Murakami H.Concurrent Graves’disease and intracranial arterial stenosis/occlusion:special considerations regarding the state of thyroid function,etiology,and treatment[J].Neurosurg Rev,2011,34(3):297-304.
[16]Nakamura K,Yanaka K,Ihara S,etal.Multiple intracranial arterial stenoses around the circle of Willis in association with graves’disease:report of two cases[J].Neurosurgery,2003,53(5):1210-1215.

