血清對U937細胞分化成熟及細胞周期的影響
曹林林,杜珍武,楊麒巍,侯治富*
(1.淄博市中心醫院 檢驗科,山東 淄博255036;2.吉林大學中日聯誼醫院 中心研究室,吉林 長春130033)
腫瘤細胞的分化程度是癌癥診斷和治療中一個重要的參考的數據,在研究腫瘤細胞分化過程中,發現細胞分化與細胞停滯聯系密切[1,2],每一次細胞分化都伴有細胞周期停滯[3]。
本研究利用乙酸肉豆蔻佛波醇(PMA)[4]體外誘導單核白血病細胞系——U937細胞分化為研究對象,通過對在有無血清培養條件下細胞形態及周期的變化,探討調控細胞分化成熟的機制,并為白血病的研究性治療提供依據。
1 材料與方法
1.1 實驗材料
U937細胞株來自吉林大學中日聯誼醫院中心研究室,胎牛血清(FCS),IMDM培養基,青鏈霉素均購于Hyclone公司,細胞周期檢測試劑盒購于碧云天生物技術公司,PMA購于美國Sigma公司。
1.2 U937細胞培養
將U937細胞株復蘇后接種于含15%胎牛血清和100ml/L青鏈霉素的IMDM培養基中。置于含有5%CO2,37℃培養箱內進行培養。
1.3 血清為培養調節因素情況下PMA誘導U937細胞分化
根據在U937細胞培養過程中是否添加血清與PMA,將細胞分成4組:①FCS組:U937細胞置于含有10%FCS的IMDM培養基內培養;②FCS+PMA組:U937細胞置于含有10%FCS與10ng/ml PMA的IMDM培養基內培養;③NOFCS組:U937細胞置于無FCS的IMDM培養基內培養;④NOFCS+PMA組:U937細胞置于無FCS但含有10 ng/ml PMA的IMDM培養基內培養。培養24h后應用倒置顯微鏡進行形態學觀察、貼壁率計算與細胞周期檢測。
1.4 血清恢復實驗
分別取NOFCS和NOFCS+PMA組培養24 h U937細胞,以1×106/瓶將其接種于含血清培養基的培養瓶內進行培養,培養24h后應用倒置顯微鏡進行形態學觀察、貼壁率計算以及細胞周期檢測。
1.5 分化后細胞的無血清培養
將FCS+PMA組細胞培養24h后,分別置于含有血清培養基與無血清培養基內,培養24h后應用倒置顯微鏡進行形態學觀察、貼壁率計算與細胞周期檢測。
1.6 細胞貼壁率測定
分別收集各組懸浮細胞與貼壁細胞,應用細胞計數儀(TC10,Bio-Rad)進行細胞計數,按照下面公式進行貼壁率計算:細胞貼壁率%=貼壁細胞數/(懸浮細胞數+貼壁細胞數)。
1.7 流式細胞術檢測細胞周期
取各組細胞,用PBS洗滌1次。經75%的冷酒精固定18h,1 000r/min離心5min,去除酒精,用PBS滌洗3次,加入PBS 0.5ml。用350目紗網過濾后加入RNA酶100μl振蕩,37℃水浴30min。加入碘化丙啶(PI)400μl振蕩,4℃30min后上流式細胞儀進行細胞周期分析。
1.8 統計分析
采用SPSS17.0軟件進行統計學處理,細胞貼壁率、細胞周期數據均以Mean±SD表示,組間比較采用單因素方差分析。
2 結果
2.1 血清對U937細胞分化過程的細胞形態影響
在FCS組細胞在血清培養基內為圓形、懸浮、分散生長(圖1A),FCS+PMA組細胞為貼壁生長,細胞相互粘附成團,細胞顆粒度增多(圖1B);NOFCS組細胞懸浮、分散生長(圖1C);NOFCS+PMA組細胞部分聚集生長,大部分細胞仍懸浮生長(圖1D),說明血清在PMA誘導的U937細胞分化過程對于細胞的形態具有一定影響。
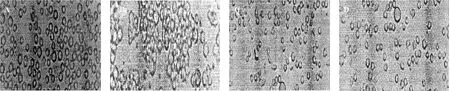
圖1 U937細胞在不同培養條件下形態學變化(200×)
2.2 血清對U937細胞分化過程的細胞貼壁率影響
FCS+PMA組細胞貼壁率明顯高于其他3組,而NOFCS+PMA組細胞的貼壁率與FCS組,NOFCS組無明顯差異,說明血清在PMA誘導的U937細胞分化過程對于細胞的貼壁具有一定影響。結果見表1。
2.3 血清對U937細胞分化過程的細胞周期影響
與FCS組(圖2A)相比,FCS+PMA(圖2B)、NOFCS(圖2C)和NOFCS+PMA組(圖2D)細胞周期的G1細胞明顯增多,而S期細胞明顯減少,相比有顯著差異,說明血清可以影響U937細胞的細胞周期改變,結果見圖2,表2。

表1 各組細胞的貼壁率
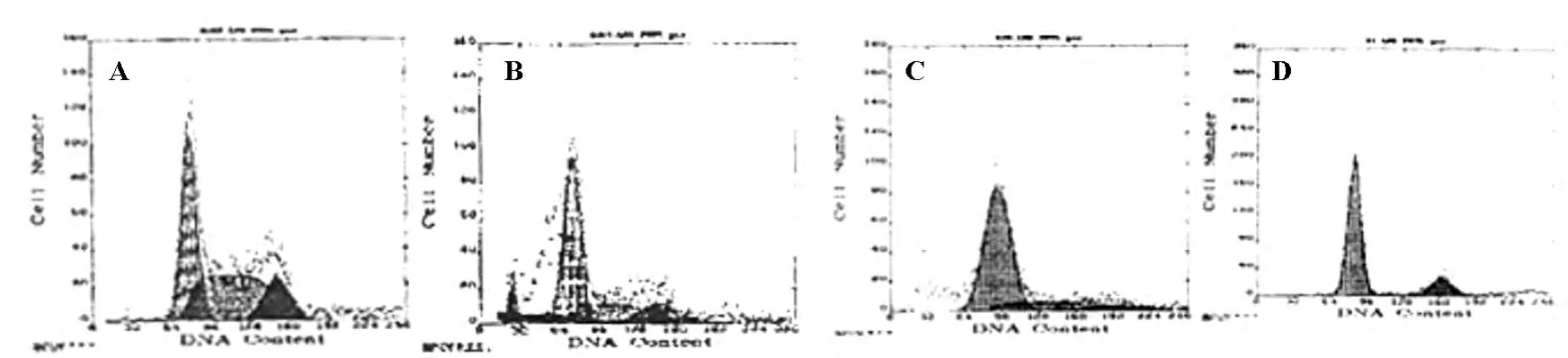
圖2 各組細胞的細胞周期直方圖

表2 各組細胞的細胞周期分布
2.4 血清恢復后細胞形態學觀察與細胞周期結果
NOFCS組與NOFCS+PMA組細胞置于含有15%血清培養基,培養24h后,NOFCS組細胞懸浮生長(圖3A),細胞周期結果分析顯示與血清恢復前NOFCS組相比,G1期細胞數目明顯減少,S期細胞明顯增多(圖4A,表3);NOFCS+PMA組細胞貼壁生長,聚集成團(圖3B),細胞周期結果分析顯示與血清恢復前NOFCS+PMA組相比,細胞周期無明顯改變(圖4B,表3)。
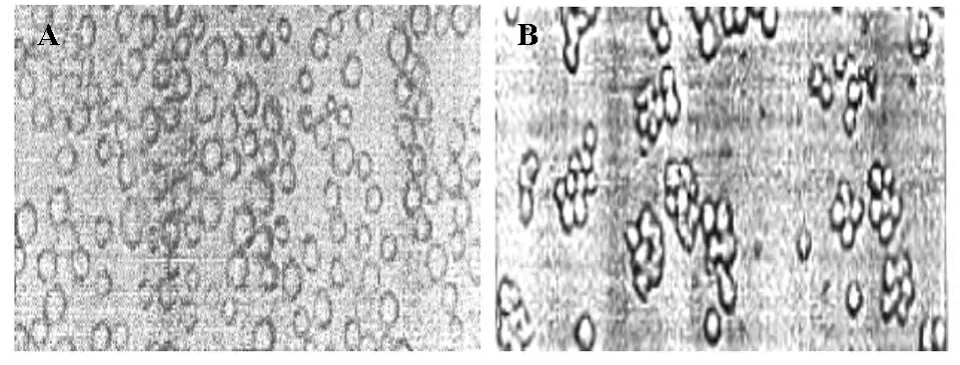
圖3 血清恢復后NOFCS組與NOFCS+PMA組細胞形態學觀察結果
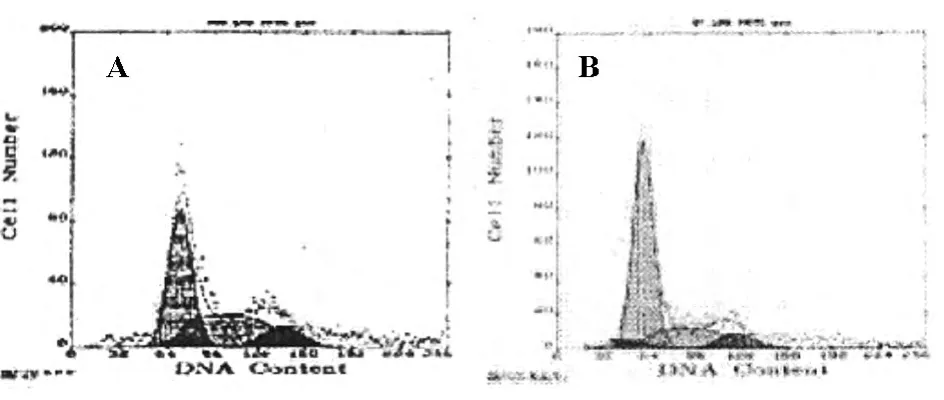
圖4 血清恢復后NOFCS組與NOFCS+PMA組細胞周期觀察結果
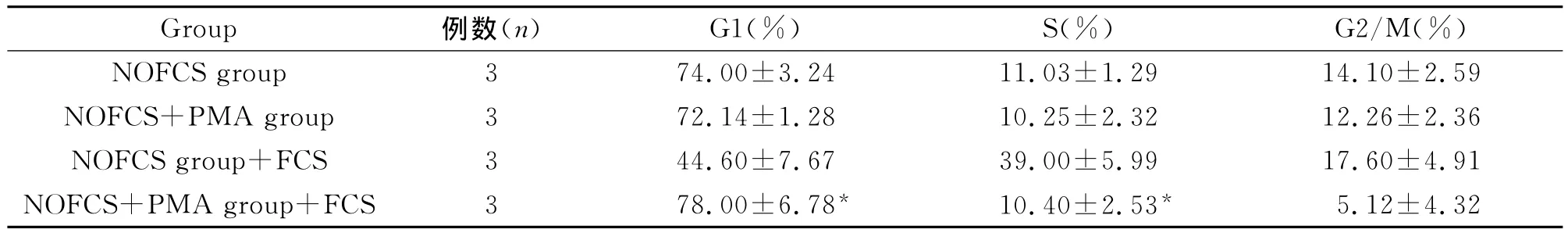
表3 血清作用前后U937細胞周期分布的變化
3 討論
U937細胞是一種前單核細胞株,其特點為經一定刺激后可向單核巨噬細胞方向分化,目前,U937細胞已經成為體外研究細胞分化機制常規使用的細胞模型之一。乙酸肉豆蔻佛波醇(Phorbol-12-myristate 13-acetata,PMA),是二脂酰甘油(DG)的類似物,可以進入細胞內,代替DG的活性激活蛋白酶(PKC)的活性[5],引起細胞內一系列的生物學效應。在體外,PMA可以誘導多種腫瘤細胞系的分化[6,7],是一種實用良好、性能穩定的誘導分化劑。在細胞培養過程中,血清作為獨立的影響因素,在腫瘤細胞體外生長過程中起著重要作用,主要由于血清含有細胞增殖與生存的必需營養素如某些生長因子。在無血清情況下,細胞停止增殖,細胞周期停滯于G1期,而這些細胞是否分化,各研究結論是不同的[8-11],主要是由于研究對象及所用誘導劑不同的緣故。本研究利用PMA誘導分化U937細胞,觀察并研究以血清作為調節因素情況下,U937細胞分化成熟及細胞周期的變化。
研究結果表明,在有血清培養條件下,經10ng/ml PMA作用24小時后,U937細胞形態學發生巨大變化,大量細胞由懸浮變為貼壁生長,細胞之間由分散狀態變為彼此粘附狀態,細胞形態由圓形變為多角形或橢圓形,細胞周期表現為G1期細胞明顯增多,S期細胞明顯減少,并出現細胞凋亡現象。通過細胞形態、貼壁率及細胞周期的改變,可見血清促進了細胞分化成熟,也說明細胞誘導分化成功。另外細胞周期測定結果顯示,未貼壁細胞凋亡率明顯高于貼壁細胞,可能是由于細胞貼壁生長后有利于細胞的存活。本實驗分別測定了在正常血清(FCS)、血清加PMA(FCS+PMA)、無血清(NOFCS)、無血清+PMA(NOFCS+PMA)4種情況下細胞周期的變化,FCS組與NOFCS組相比細胞周期停滯于G1期。血清恢復實驗結果表明,NOFCS+PMA組細胞周期仍停滯于G1期,而NOFCS組細胞周期開始恢復。出現這種現象的可能原因有兩個:一是PMA作用,因為在整個實驗過程中PMA在細胞體內不易代謝,可長期發揮作用。所以在血清恢復后可繼續發揮作用;二是據文獻報道在無血清情況下,細胞CyclinD表達會下降,但在血清恢復后,可能重新恢復表達,促進細胞周期的進程[12]。
細胞周期的進程主要由兩組相互消長的蛋白控制即細胞周期蛋白及細胞周期依賴性激酶、細胞周期蛋白依賴性激酶抑制蛋白[13]。對于細胞周期G1期的停滯可以通過下調細胞周期蛋白酶的活性或上調細胞周期蛋白依賴性激酶抑制蛋白活性來進行調控。本研究同時證實了PMA對U937細胞的分化發揮重要調控作用,有利于尋找新型抗白血病藥物,但具體的調控機制還在進一步探討之中。
[1]Pardee Ab.G1event and regulation of cell proliferation[J].Science,1989,246:603.
[2]Hayden A,Johnson PWM,Packham G,et al.S-adenosylhomocys-teine hydrolase inhibition by 3-deazaneplanocin A analogues induces anti-cancer effects in breast cancer cell lines and synergy with both histone deacetylase and HER2inhibition[J].Breast cancer research and treatment,2011,127(1):109.
[3]Saito Y,Miyahara R,Gopalan B,et al.Selective induction of cell cycle arrest and apoptosis in human prostate cancer cells through adenoviral transfer of the melanoma differentiation-associated-7(mda-7)/interleukin-24 (IL-24)gene[J].Cancer gene therapy,2005,12(3):238.
[4]Kikuchi H,Yuan B,Nishimura Y,et al.Cytotoxicity of Vitex agnus-castus fruit extract and its major component,casticin,correlates with differentiation status in leukemia cell lines[J].International Journal of Oncology,2013,43(6):1976.
[5]Blumberg.Protein Kinase C as the Receptor for the Phorbol Ester Tumor Promoters:Sixth Rhoads Memorial Award Lecture1[J].Cancer Research,1988,48:1.
[6]Zhou L,Shen L,Hu L,et al.Retinoid X receptor agonists inhibit phorbol-12-myristate-13-acetate(PMA)-induced differentiation of monocytic THP-1cells into macrophages[J].Molecular and cellular biochemistry,2010,335(1-2):283.
[7]Jalagadugula G,Dhanasekaran D N,Rao A K.Phorbol 12-Myristate 13-Acetate (PMA)Responsive Sequence in Gαq Promoter During Megakaryocytic Differentiation:Regulation by EGR-1and MAP Kinase Pathway[J].Thrombosis and haemostasis,2008,100(5):821.
[8]Huo XF,Yu J,Peng H,et al.Differential expression changes in K562cells during the hemin-induced erythroid differentiation and the phorbol myristate acetate (PMA)-induced megakaryocytic differentiation[J].Molecular and cellular biochemistry,2006,292(1-2):155.
[9]Gottipamula S,Muttigi MS,Kolkundkar U,et al.Serum-free media for the production of human mesenchymal stromal cells:a review[J].Cell Proliferation,2013,doi:10.1111/cpr.12063.
[10]Haddad H,Papoutsakis ET.Low oxygen tension and autologous plasma enhance T-cell proliferation and CD49dexpression density in serum-free media[J].Cytotherapy,2001,3(6):435.
[11]Xin-xin S,Duncan NA,Lin LIN,et al.Serum-free media for articular chondrocytes in vitro expansion[J].Chinese medical journal,2013,126(13):2523.
[12]Resnitzky D,Reed SI.Different roles for cyclins D1and E in regulation of the G1-to-S transition[J].Molecular Cell.1995,15(7):3463.
[13]Lim S,Kaldis P.Cdks,cyclins and CKIs:roles beyond cell cycle regulation[J].Development,2013,140(15):3079.

