開放創(chuàng)新范式下醫(yī)藥研發(fā)組織模式研究
王 勇
(北京交通大學(xué)中國產(chǎn)業(yè)安全研究中心,北京 100044)
以人類生命復(fù)雜現(xiàn)象作為研究對象的醫(yī)藥研發(fā)活動,在推動醫(yī)藥產(chǎn)業(yè)不斷發(fā)展前進的同時,為消除和緩解人類因疾病而遭受的疾苦,延長生命時間、提高生活質(zhì)量發(fā)揮著至關(guān)重要的作用。自現(xiàn)代醫(yī)學(xué)起步至今,醫(yī)藥研發(fā)活動已持續(xù)了近百年的時間,雖然取得了巨大的成就,但當前醫(yī)藥企業(yè)研發(fā)活動所遇到的瓶頸和效率低下的問題,一直困擾著醫(yī)藥研發(fā)企業(yè)。創(chuàng)新能力低下,在我國醫(yī)藥行業(yè)中尤為突出。因此探討新的科技、社會和經(jīng)濟環(huán)境下,如何提升醫(yī)藥企業(yè)研發(fā)效率和創(chuàng)新能力,具有非常現(xiàn)實的意義。
1 醫(yī)藥研發(fā)效率危機及其成因分析
近10年來,在世界醫(yī)藥范圍內(nèi),研發(fā)效率持續(xù)下降的趨勢引起了廣泛關(guān)注,這不僅表現(xiàn)為作為世界醫(yī)藥研發(fā)晴雨表的美國FDA每年新批準的新分子實體 (New molecular entities)數(shù)量一直處于低位徘徊,而與之相應(yīng)的則是全球醫(yī)藥研發(fā)費用的成倍增長。根據(jù)ATKearney(2012)的一份最新對比報告,1999—2001三年間,美國FDA批準的新分子實體 (NME)年均數(shù)量為29個,而2009—2011三年新批準的新分子實體 (NME)年均數(shù)量僅為26個[1]。在2001—2011年間的10年中,全球從事醫(yī)藥研發(fā)活動的企業(yè)從1167家上升到2455家,全球500強醫(yī)藥公司的研發(fā)費用更是由2001年的590億美元上升到2011年的1317億美元,剔除通脹因素,單位研發(fā)費用的投入產(chǎn)出大大降低。一個新藥從最初的先導(dǎo)化合物的篩選到成功推向市場,所需的研發(fā)費用已超過12億美元,研發(fā)周期也在10年以上[2]。Jack W.Scannell,etc.在《自然 -新藥研發(fā)綜述》中,通過將自1950至2010年60年間各年度10億美元研發(fā)費用所對應(yīng)的經(jīng)FDA批準上市的新藥數(shù)量進行相關(guān)分析,發(fā)現(xiàn)每隔9年,每10億美元研發(fā)支出所產(chǎn)出的新藥數(shù)量下降一半,并將這一現(xiàn)象稱為“反向摩爾定律 (Eoorm's law)”[3]。
從研發(fā)投資經(jīng)濟回報上看,研發(fā)投入產(chǎn)出下降更為明顯。麥肯錫的一份最近的分析表明,醫(yī)藥行業(yè)研發(fā)投入的經(jīng)濟回報從20世紀90年代的13%~15%下降為近5年的4%~5%。從價值角度看,也就是大多數(shù)研發(fā)投入活動是不創(chuàng)造價值的[4]。
近幾年來,雖然我國政府對新藥研發(fā)的扶持力度大大增強,但相對而言,我國醫(yī)藥企業(yè)的研發(fā)創(chuàng)新能力更為薄弱,通過國家食品藥品監(jiān)督管理局 (SFDA)審批的創(chuàng)新性新藥 (1.1和1.2類化學(xué)藥和1類生物藥)數(shù)量寥寥無幾,臨床研究新藥 (IND)數(shù)量也處于相對較低水平[5],具體如圖1所示。
從圖1可以看出,每年獲批的臨床研究新藥數(shù)量基本維持在20~30個內(nèi),而自2005年后,獲批上市的創(chuàng)新性新藥的數(shù)量只有1~2個,遠低于2005年以前的創(chuàng)新性新藥的年獲批數(shù)量。其中部分原因為自2007年起,新的《藥品注冊管理辦法》對新藥申請的審批要求更加嚴格,但更多的是與世界其他國家醫(yī)藥研發(fā)面臨相同的困境。
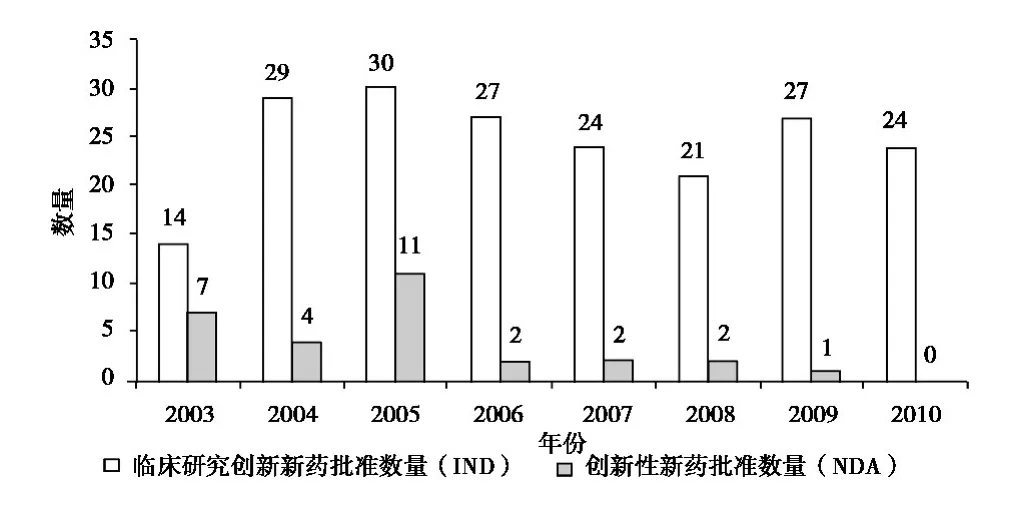
圖1 我國創(chuàng)新性臨床研究新藥與創(chuàng)新性新藥批準量
持續(xù)的研發(fā)效率困境,一種通常的解釋就是“低掛的蘋果”被摘掉,相對容易開發(fā)的新藥已被開發(fā),剩下的研發(fā)領(lǐng)域越來越難,所以導(dǎo)致研發(fā)效率低下。但如果綜合考慮科學(xué)技術(shù)的不斷進步,這種解釋是很難有說服力的。科學(xué)技術(shù)領(lǐng)域的進步,大大提高了醫(yī)藥研發(fā)者的工作效率,例如組合化學(xué)的發(fā)展已將化學(xué)工作者每年合成的類醫(yī)藥分子的數(shù)量相對20世紀80、90年代提高了800倍。DNA測序速度相對20世紀70年代第一個基因序列組的出現(xiàn)提高了10億多倍。現(xiàn)有醫(yī)藥研究領(lǐng)域發(fā)現(xiàn)的潛在的藥物靶點,如果按照現(xiàn)有的新藥開發(fā)速度,幾十年都用不完。
研發(fā)效率下降,本質(zhì)的原因在于現(xiàn)有研發(fā)組織模式存在缺陷。在過去的60年間,內(nèi)部集成式的企業(yè)實驗室以及封閉性創(chuàng)新,主導(dǎo)著醫(yī)藥企業(yè)的研發(fā)活動,各醫(yī)藥公司的研發(fā)活動均集中在公司的墻內(nèi)[6-7]。封閉式創(chuàng)新模式雖然成就過一些醫(yī)藥公司“重磅炸彈”藥的研制成功,并因?qū)@趦?nèi)的市場獨占,獲得巨大市場成功。但“重磅炸彈”的研發(fā)在某種程度上就是一種風險豪賭,國際大型醫(yī)藥公司鎩羽而歸的案例比比皆是,該模式下研發(fā)組織運作高昂的固定費用,使得醫(yī)藥企業(yè)難以為繼,這也是研發(fā)產(chǎn)出滯停,而投入急劇增長最終導(dǎo)致整個醫(yī)藥行業(yè)研發(fā)效率下降的根本原因。
2 基于開放式創(chuàng)新框架下的醫(yī)藥研發(fā)流程解構(gòu)
為提高研發(fā)效率,充分利用內(nèi)外部資源加速研發(fā)過程,縮短研發(fā)周期,提升研發(fā)效率,在全球化背景下的今天,開放式創(chuàng)新模式受到各行各業(yè)大量企業(yè)的青睞。
作為開放式創(chuàng)新理論的奠基人,Chesbrough認為開放式創(chuàng)新是一種新的范式,其核心是公司在尋求技術(shù)提升過程中,能夠和應(yīng)該利用內(nèi)、外的創(chuàng)意和內(nèi)、外部的路徑走向市場[8-9]。Gassmann和Enkel將開放式創(chuàng)新歸為三類的核心過程:①將外部知識用于企業(yè)內(nèi)部研發(fā)過程的“外部內(nèi)化”的過程;②將內(nèi)部知識通過授權(quán)、出售專利等方式“內(nèi)部外化”過程;③雙向的“耦合過程”[10]。根據(jù)這一分類,我們可以通過對醫(yī)藥研發(fā)流程進行解構(gòu),從而為確定各環(huán)節(jié)的研發(fā)組織模式奠定基礎(chǔ)。

圖2 醫(yī)藥研發(fā)流程解構(gòu)圖
傳統(tǒng)的新藥研發(fā)流程,涉及的可解構(gòu)分拆的環(huán)節(jié)多達7個,且每個環(huán)節(jié)所需的時間在1~2年間,整個新藥研發(fā)周期平均12年左右。研發(fā)起始環(huán)節(jié)的篩耗率非常高,一個先導(dǎo)化合物最終成為可上市的新藥的概率接近0,據(jù)統(tǒng)計,每5000~10000個化合物中才有一個有可能成為最終的上市新藥,可見,醫(yī)藥研發(fā)風險之高、難度之大超過了一般行業(yè)。
一個完整的新藥研發(fā)過程,可以分為“藥物發(fā)現(xiàn)階段”和“藥物開發(fā)階段”。藥物發(fā)現(xiàn)階段主要是利用病理醫(yī)學(xué)、基因?qū)W、藥理學(xué)、藥物化學(xué)、蛋白質(zhì)生物技術(shù)等多學(xué)科的知識和研究成果,進行潛在藥物分子實體的發(fā)現(xiàn)活動。藥物開發(fā)階段則主要是利用藥物發(fā)現(xiàn)階段的成功,利用轉(zhuǎn)化科學(xué)技術(shù),進行新藥的臨床試驗和開發(fā)活動。
在藥物發(fā)現(xiàn)階段,屬于潛在藥物發(fā)現(xiàn)階段,是多種學(xué)科,多機構(gòu)研究結(jié)果的交匯和融合,是基于龐大的科研網(wǎng)絡(luò)中各節(jié)點知識積累的演進,屬于知識創(chuàng)新階段。在這一階段,作為醫(yī)藥研發(fā)企業(yè),單憑自身的力量,難以獨自完成知識創(chuàng)新。因此,在藥物發(fā)現(xiàn)階段,作為有競爭力的醫(yī)藥企業(yè)的研發(fā)創(chuàng)新重心,往往并不是將研發(fā)活動局限于公司圍墻內(nèi)部【1】,而是企業(yè)要作為研發(fā)成果資源的整合者,不斷跟蹤和收集所關(guān)注領(lǐng)域的最近科研動態(tài),或者各科研機構(gòu)的實力,然后通過購買專利、合資合作、聯(lián)盟等方式,將外部研發(fā)成果內(nèi)化成公司的可利用的研發(fā)資源,因此在該階段,醫(yī)藥研發(fā)企業(yè)的研發(fā)組織模式適合用開放式創(chuàng)新框架中的“外部內(nèi)化”組織模式。
在藥物開發(fā)階段,屬于潛在藥物發(fā)現(xiàn)階段研發(fā)成果的產(chǎn)品化、市場化的轉(zhuǎn)化研究。醫(yī)藥作為一種特殊的產(chǎn)品,一種新的產(chǎn)品成功上市,其安全性和療效是需要通過嚴密的臨床研究階段的證實。臨床研究以及新藥上市申請,周期長,需要消耗的人力和物力特別多,屬于驗證性和完善性的研發(fā)過程,過程中原創(chuàng)的知識性創(chuàng)新程度較低,因此,為了加快研發(fā)進程,充分利用外部專業(yè)機構(gòu),在這一階段通過“內(nèi)部外化”或者“耦合”的研發(fā)組織模式更為合適,目前大量醫(yī)藥研發(fā)企業(yè)通過外包,將臨床研究階段的部分乃至全部工作外包給外部專業(yè)的研究機構(gòu),如CRO等,是這一趨勢的很好驗證。
3 開放式創(chuàng)新框架下醫(yī)藥研發(fā)組織模式的創(chuàng)新與重塑
在傳統(tǒng)的醫(yī)藥研發(fā)組織模式下,醫(yī)藥公司采用的是“垂直一體化”的研發(fā)組織模式,即將兩個階段中的絕大多數(shù)研發(fā)活動都局限于公司內(nèi)部。“垂直一體化”的研發(fā)組織模式,在當今環(huán)境下,受到越來越多的挑戰(zhàn),即便是世界醫(yī)藥巨頭,也不得不同外部其他組織進行合作以便更有效地開發(fā)新的藥物。正如葛蘭素史克公司前首席執(zhí)行官Garnier所言,“這是一個確保你在10年內(nèi)輸?shù)镁獾纳虡I(yè)模式 (指傳統(tǒng)垂直一體化的研發(fā)組織模式)”。越來越多的大型醫(yī)藥研發(fā)企業(yè),認識到傳統(tǒng)研發(fā)模式的弊端,正在積極嘗試新的研發(fā)組織模式[11],如GSK,禮來、輝瑞等。但不同的醫(yī)藥研發(fā)企業(yè),由于自身核心研發(fā)能力、組織能力、自身綜合實力以及戰(zhàn)略導(dǎo)向等方面的差異,開放研發(fā)組織的模式也不盡相同,因此,對我國醫(yī)藥研發(fā)企業(yè)而言,需要根據(jù)自身特點和發(fā)展階段,選擇適合的開放模式,對傳統(tǒng)研發(fā)組織進行重塑。
3.1 “機會性合作創(chuàng)新”組織模式
在該種模式下,醫(yī)藥研發(fā)企業(yè)通過對自身研發(fā)能力進行解構(gòu)評估,將真正體現(xiàn)核心能力和優(yōu)勢的研發(fā)環(huán)節(jié)保留在公司內(nèi)部,充分利用內(nèi)部研發(fā)資源和技術(shù)訣竅,通過市場化手段尋找合作創(chuàng)新機會,對能夠從外部市場獲取的創(chuàng)意或者研發(fā)服務(wù),通過合作購買的方式予以解決。該模式下合作手段主要為聯(lián)盟、購買專利授權(quán)、研發(fā)服務(wù)購買、服務(wù)外包等。在靶點識別和確認階段,通常通過聯(lián)盟等手段與大學(xué),公共研究機構(gòu)合作,獲取藥物發(fā)現(xiàn)階段所需的基礎(chǔ)性資料和知識;在先導(dǎo)化合物識別和優(yōu)化階段,可通過與其他平臺公司進行合同性交易,購買平臺公司的科學(xué)研發(fā)服務(wù),尤其是代為進行先導(dǎo)物的識別和優(yōu)化工作;在臨床前研究階段,可通過專利許可方式從其他醫(yī)藥研發(fā)公司獲得新藥潛在候選物;在臨床實驗階段,可通過外包方式,與合同研發(fā)組織 (CRO)進行合作,共同開發(fā)新藥。當然在研發(fā)階段,也可以根據(jù)情況,為其他公司提供研發(fā)服務(wù)或者提供專利授權(quán),進行合作創(chuàng)新。
機會性合作創(chuàng)新的研發(fā)模式,已成為大多數(shù)研發(fā)公司采用的研發(fā)組織手段之一。外源性的研發(fā)項目已占到醫(yī)藥研發(fā)巨頭的50%以上[11]。該模式的優(yōu)點是通過市場化手段從其他專業(yè)性公司獲取專利或者研發(fā)服務(wù),有利于縮短企業(yè)研發(fā)周期,節(jié)約研發(fā)成本。但不足之處是機會性的合作,合作參與方主要基于短期利益,不利于長期穩(wěn)定的研發(fā)戰(zhàn)略關(guān)系的形成。
3.2 “虛擬研發(fā)”網(wǎng)絡(luò)組織模式
該模式下,主導(dǎo)醫(yī)藥研發(fā)企業(yè)在一個共同的支持平臺上,將各獨立的企業(yè)組織成一個網(wǎng)絡(luò)。主導(dǎo)企業(yè)主要作為一個管理中樞,提供基礎(chǔ)平臺和共同資源,使各研發(fā)參與方作為該網(wǎng)絡(luò)下的一個節(jié)點,按照既定的分工,為一個共同的目標而共同協(xié)作,完成研發(fā)任務(wù)。在該網(wǎng)絡(luò)中,學(xué)術(shù)性研究中心 (如大學(xué)、研究所等)提供基礎(chǔ)和科學(xué)轉(zhuǎn)化研究能力,使研發(fā)網(wǎng)絡(luò)獲得最新的前沿醫(yī)學(xué)支持,小型專業(yè)醫(yī)藥公司或是生物技術(shù)公司提供創(chuàng)新性的藥物發(fā)現(xiàn)和早期開發(fā)階段的能力;合同研究組織 (CRO)提供臨床研究運作和執(zhí)行能力。研發(fā)參與方相互依賴,主要參與方之間的關(guān)系往往是長期性的戰(zhàn)略合作伙伴關(guān)系,共同的目標將他們粘合在一起,他們按照事先網(wǎng)絡(luò)構(gòu)建的機制,承擔風險,分享成果。
英國制藥巨頭Shire公司是醫(yī)藥行業(yè)虛擬研發(fā)組織模式的典型,除了基因治療領(lǐng)域外的其他研發(fā)項目,從最初的藥物發(fā)現(xiàn)到醫(yī)學(xué)監(jiān)控、數(shù)據(jù)管理、統(tǒng)計分析等全研發(fā)流程的所有環(huán)節(jié),基本都是通過外包方式實現(xiàn)[10]。葛蘭素史克 (GSK)通過組建外部藥物發(fā)現(xiàn)卓越中心 (CEEDD),在醫(yī)藥研發(fā)的“藥物發(fā)現(xiàn)”階段,采用“虛擬研發(fā)”網(wǎng)絡(luò)組織模式,進行潛在創(chuàng)新藥候選物的研發(fā)篩選工作。
該研發(fā)組織模式可以降低醫(yī)藥研發(fā)企業(yè)初始性一次性資本投資,能夠相對高效地利用外部研發(fā)資源,并能夠保持足夠的靈活性,降低傳統(tǒng)研發(fā)組織模式不可避免的固定費用,使固定費用變成了變動費用。但要協(xié)調(diào)好各參與方,維持網(wǎng)絡(luò)結(jié)構(gòu)的穩(wěn)定,對網(wǎng)絡(luò)主導(dǎo)企業(yè)是一個巨大的挑戰(zhàn)。另外,研發(fā)環(huán)節(jié)中各主體對研發(fā)成果價值的分享,也在一定程度上稀釋公司獲取的價值。該研發(fā)組織模式,需要的是主導(dǎo)研發(fā)企業(yè)在研發(fā)方面的組織管理能力,因此比較適用于擬進入新的醫(yī)藥治療領(lǐng)域的研發(fā)項目的組織。
3.3 “風險投資”組織模式
與圍繞研發(fā)過程,獲取外源性輸入 (專利許可、研發(fā)服務(wù)等)或者提供研發(fā)服務(wù)、專利出售等不同,研發(fā)的“風險投資”模式主要通過設(shè)立研發(fā)風險基金,對醫(yī)藥研發(fā)企業(yè)進行組合性的風險投資,從而優(yōu)先獲得被投資企業(yè)的研發(fā)知識產(chǎn)權(quán)和成果或在共同孵化被投資企業(yè)研發(fā)成果后獲得被投資企業(yè)的增長紅利,也可以是兩個或多個研發(fā)企業(yè),基于一個特殊的研發(fā)項目,組建一個新的公司,利用各自的優(yōu)勢,共同研發(fā)。該模式主要適用于藥物發(fā)現(xiàn)階段的研發(fā)任務(wù)。
葛蘭素史克 (GSK)是較早采用“風險投資”模式進行研發(fā)的公司之一,它通過旗下的SR One(GSK的研發(fā)風險投資基金)對30多家生物技術(shù)公司的藥物研發(fā)提供了累計5億多美元的投資。諾華和輝瑞公司也設(shè)立了相應(yīng)的公司風險投資基金[12]。
該研發(fā)組織模式的優(yōu)點在于可以利用大型醫(yī)藥研發(fā)公司的資金和資源實力,支持資源不足的小型研發(fā)企業(yè)的發(fā)展,同時使這些小型研發(fā)企業(yè)免受大型醫(yī)藥公司官僚文化的侵蝕,保持其文化和機制的活力和創(chuàng)新性。但組織管理醫(yī)藥研發(fā)過程與管理風險投資基金存在很大的不同,需要的是不同的技能,因此,對采用該模式的企業(yè)的管理技能有較高的要求。此外,相較于公司內(nèi)部的研發(fā)項目,存在公司對外部的研發(fā)成果控制相對較弱的問題。各模式的適用范圍及優(yōu)缺點歸納見表1。
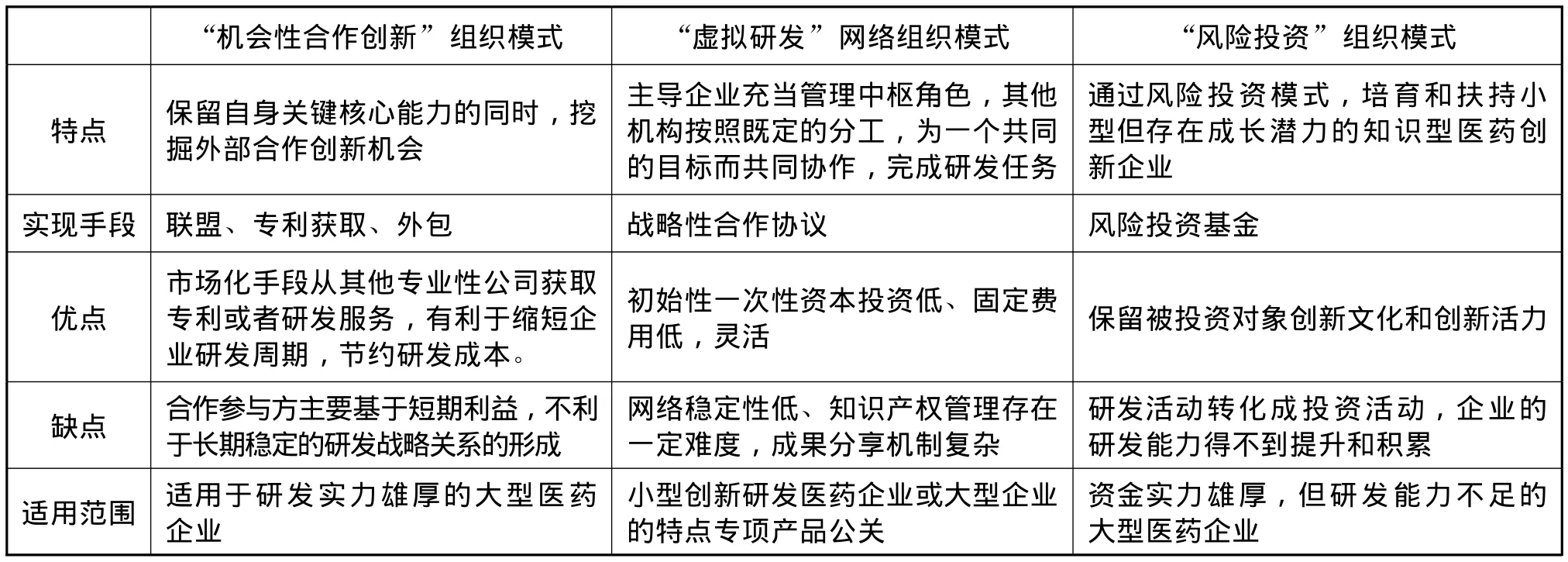
表1 醫(yī)藥研發(fā)組織模式
4 對政府研發(fā)政策的影響和啟示
(1)對政府研發(fā)投入的扶持對象選擇的啟示。由于企業(yè)研發(fā)活動的跨組織邊界,合作研發(fā)活動越來越成為當前醫(yī)藥企業(yè)研發(fā)活動的主導(dǎo)模式。因此,政府在醫(yī)藥重點研發(fā)項目的資助中,要逐步超越傳統(tǒng)側(cè)重以單個企業(yè)、單個組織為資助對象的模式,資助對象向產(chǎn)學(xué)研等承擔聯(lián)合研發(fā)任務(wù)的聯(lián)盟組織傾斜[13],鼓勵各種類型的組織機構(gòu),通過市場化手段,以項目為紐帶,組成研發(fā)共同體,發(fā)揮各自的優(yōu)勢,進而實現(xiàn)提高研發(fā)效率,縮短研發(fā)周期,降低研發(fā)成本的目的,并較好地實現(xiàn)風險的分擔和收益的共享。
(2)對政府知識產(chǎn)權(quán)管理的啟示。有效的知識產(chǎn)權(quán)保護環(huán)境,是激勵醫(yī)藥企業(yè)進行研發(fā)投入的前提。只有研發(fā)成果得到有效保護,從事研發(fā)工作的企業(yè)才能從研發(fā)創(chuàng)新中得到回報。相對傳統(tǒng)的垂直一體化創(chuàng)新而言,在開放創(chuàng)新環(huán)境下知識產(chǎn)權(quán)的管理工作更復(fù)雜,其有效程度直接決定了開放創(chuàng)新模式能否有效運作[14]。政府需要積極推動知識產(chǎn)權(quán)價值評估機構(gòu)對醫(yī)藥知識產(chǎn)權(quán)、專利許可等“智慧資產(chǎn)”的評估能力建設(shè)和體系搭建,同時需要構(gòu)建醫(yī)藥知識產(chǎn)權(quán)和專利的交易市場和平臺,以促進知識要素的流動和最優(yōu)配置。在此基礎(chǔ)上,加強知識產(chǎn)權(quán)法律法規(guī)體系建設(shè),加大對侵犯知識產(chǎn)權(quán)的處置力度,保護醫(yī)藥企業(yè)研發(fā)投入的積極性和研發(fā)成果,維護和創(chuàng)造良性的醫(yī)藥創(chuàng)新環(huán)境。
(3)對強化政府信息服務(wù)職能的啟示。醫(yī)藥產(chǎn)業(yè)創(chuàng)新能力的提升,在開放式創(chuàng)新范式下,政府需要強化研發(fā)信息服務(wù)職能,通過搭建國際化的醫(yī)藥信息平臺,降低企業(yè)研發(fā)信息和創(chuàng)新源的搜尋成本。通過信息服務(wù)平臺,各企業(yè)可以發(fā)布各類供求信息和合作項目的信息,降低交易成本。
[1] Oliver Scheel,Tim Wintermantel,Jim O'Keefe.Unleashing Pharma from the R&D value chain [EB/OL].http://www.a(chǎn)tkearney.com/innovation/ideas-insights/featured-article/-/asset_publisher/BqWAk3NLsZIU/content/unleashing-pharmafrom-the-r-d-value-chain/10192.1uly,2013.
[2]M.Lowman,P.Trott,A.Hoecht,et al.Innovation Risks of Outsourcing in Pharmaceutical New Product Development[J].Technovation,2012(32):99-109.
[3]Jack W.Scannell,Alex Blanckley,Helen Boldon,et al.Diagnosing the Decline in Pharmaceutical R&D Efficiency[J].Nature Reviews/Drug Discovery,2012(11):191-200.
[4]Ajay Dhankhar,Matthias Evers,Martin Moller.Escaping the Sword of Damocles:Toward a New Future for Pharmaceutical R&D[R].McKinsey perspectives on drug and device R&D 2012.
[5]Jingzong Qi,Qingli Wang,Zhenhang Yu,et al.Innovative Drug R&D in China[J].Nature Reviews/Drug Discovery.2011(10):333-334.
[6]Bernard Munos.Lesson form 60 Years of Pharmaceutical Innovation[J].Nature Reviews/Drug Discovery.2009(8):959-968.
[7]Henry Chesbrough.Pharmaceutical Innovation Hits the Wall:How Open Innovation Can Help[EB/OL],http://www.forbes.com/sites/henrychesbrough/2011/04/25/pharmaceutical-innovation-hits-the-wall-how-open-innovation-can-help/.
[8]Henry Chesbrough.Open Innovation:the New Imperative for Creating and Profiting from Technology[M].Boston:Harvard Business School Publishing Corporation.2003.
[9]葛秋萍,辜勝祖.開放式創(chuàng)新的國內(nèi)外研究現(xiàn)狀及展望[J].科研管理,2011,(5).
[10]Gassmann Oliver,Enkel Ellen,Towards a Theory of Open Innovation:Three Core Process Archetypes[C].Proceedings of the R&D Management Conference,2004.Lisbon,Portugall.
[11]Pricewaterhouse Coopers.Pharma 2020:challenging business models-which path will you take?.[EB/OL]www.pwc.com/pharma2020.April 2009.
[12]Eric David,Amit Mehta.New Frontiers in Pharma R&D Investment[R],McKinsey Quarterly,F(xiàn)ebruary 2010.
[13]張文強.中國產(chǎn)業(yè)技術(shù)創(chuàng)新與產(chǎn)學(xué)研結(jié)合的理論與實踐[M],北京:中國社會科學(xué)出版社,2013,09.
[14]楊武.基于開放式創(chuàng)新的知識產(chǎn)權(quán)管理理論研究[J].科學(xué)學(xué)研究,2006,(4).

