HO- 1減輕吸煙大鼠血清引起的HUVEC氧化損傷
楊根歡,吳 為,李硯川,倪 冷,王占啟,王超楠,劉昌偉*
(中國醫(yī)學科學院 北京協(xié)和醫(yī)學院 1.北京協(xié)和醫(yī)院 血管外科, 北京 100730;2.醫(yī)學分子生物學國家重點實驗室, 北京 100005)
研究論文
HO- 1減輕吸煙大鼠血清引起的HUVEC氧化損傷
楊根歡1,吳 為2,李硯川2,倪 冷1,王占啟1,王超楠1,劉昌偉1*
(中國醫(yī)學科學院 北京協(xié)和醫(yī)學院 1.北京協(xié)和醫(yī)院 血管外科, 北京 100730;2.醫(yī)學分子生物學國家重點實驗室, 北京 100005)
目的探討血紅素氧化酶- 1(HO- 1)是否能夠減輕吸煙大鼠血清引起的人臍靜脈內皮細胞(HUVEC)的氧化損傷。方法15只雄性SD大鼠隨機分為正常對照組、吸煙組、吸煙并注射鋅原卟啉(ZnPP)組。建立大鼠吸煙模型。Western blot檢測各組大鼠頸動脈中HO- 1的表達。體外培養(yǎng)HUVEC,分為加入正常大鼠血清、吸煙大鼠血清和吸煙并注射ZnPP大鼠血清。Western blot檢測各組HO- 1的表達。將吸煙大鼠血清加入HO- 1過表達及HO- 1低表達的HUVEC中,應用二氫溴化乙啶檢測各組活性氧的含量。結果吸煙可以明顯誘導大鼠頸動脈中HO- 1的表達(Plt;0.01)。吸煙大鼠血清及吸煙并注射ZnPP大鼠血清均可誘導HUVEC中HO- 1的表達,但后者作用更強(Plt;0.01)。吸煙大鼠血清能使HUVEC內活性氧含量增多(Plt;0.01),HO- 1能減輕此氧化損傷(Plt;0.01)。結論吸煙大鼠血清可以造成HUVEC的氧化損傷,H0- 1能夠減輕此氧化損傷作用。
吸煙; 血紅素氧化酶- 1;內皮細胞; 氧化損傷
吸煙是動脈粥樣硬化最主要的危險因素之一。它可以引起組織及細胞的氧化損傷,進而影響細胞的正常功能[1]。血紅素氧化酶- 1(HO- 1)是血紅素在體內代謝的限速酶,是體內重要的抗氧化物質。HO- 1是誘導型的血紅素氧化酶,細胞在缺氧、氧化應激、重金屬和內毒素等刺激下其表達會增高[2]。已有研究表明HO- 1對血管內皮細胞起重要的保護作用[3]。本研究闡明了吸煙血清對人臍靜脈內皮細胞的氧化損傷作用及HO- 1能夠減輕此氧化損傷作用。
1 材料與方法
1.1 材料
限制性核酸內切酶和T4 DNA連接酶(NEB公司),DNA聚合酶(Transgene生物技術有限公司),引物合成(Invitrogen公司),F(xiàn)uGENE HD轉染試劑(Roche公司),高糖-DMEM培養(yǎng)基(Hyclone公司),胎牛血清(Gibco公司), HUVEC及內皮細胞培養(yǎng)基(ScienCell 公司),HO- 1 siRNA(CST公司),鼠抗人Heme Oxygenase- 1抗體(BD公司),鋅原卟啉- 9(Sigma公司),細胞內氧化應激活性氧紅色熒光檢測試劑盒(上海杰美基因醫(yī)藥科技有限公司)。
1.2 慢病毒載體pLenti-HO- 1的構建和鑒定
針對HO- 1的CDS區(qū)設計引物,兩端加上酶切位點MluⅠ和BamHⅠ。PCR擴增HO- 1,產物經1.0%瓊脂糖凝膠電泳回收。引物序列:正向:5′-TAAG AATTCGCCACCATGGAGCGTCCGCAACC-3′,反向:5′-AATACGCGTCATGGCATAAAGCCCTACAGC-3′。分別對PCR產物和改造的病毒空載體Plentilox3.7行MluⅠ和BamHⅠ雙酶切。經純化、連接和轉化后,將感受態(tài)大腸埃希菌涂于LB平板并孵育。PCR鑒定陽性的克隆。用重組質粒轉染HEK293T,Western blot檢測HEK293T中HO- 1的表達。
將重組質粒與輔助質粒(plp1、plp2和VSVG)共同轉染HEK293T,12 h后換液。24和48 h后分別收集上清并過濾,4 ℃、18 000 r/min離心3 h。棄掉上清后,用冷PBS重懸病毒并分裝凍存于-80 ℃。同時用病毒懸液感染HEK293T及HUVEC,Western blot檢測HO- 1的表達。
1.3 動物實驗及吸煙大鼠血清的制備
15只SPF級雄性SD大鼠,平均體質量350 g[北京維通利華實驗動物技術有限公司,合格證號:SCXK(京)20120001 ]。將動物隨機分為吸煙組、吸煙并注射ZnPP(HO- 1抑制劑)組和正常對照組,每組5只。吸煙動物置于自制的大鼠吸煙裝置中吸煙[4]。每天上下午各1次,每次吸煙20支(焦油量:13 mg/支,煙堿量:1.2 mg/支,CO量:14 mg/支)。每次同時點燃4支香煙,燃燒完后休息5 min再繼續(xù)吸煙。隔天腹腔注射ZnPP1次,15 mg/kg。吸煙7 d后,取各組頸動脈標本置于液氮中保存,同時經腹主動脈盡量采取全部血液。所取血液于4 ℃過夜。將上層析出的血清再次離心后收集上清,并將其置于60 ℃中20 min滅活補體后置于-20 ℃保存。
1.4 Western blot檢測HO- 1的表達
將頸動脈標本從液氮中取出后置于研缽中,加入200 μL SDS組織裂解液后研磨成組織勻漿。測定蛋白濃度后,傳統(tǒng)方法行Western blot。用AlphaEaseFC軟件測量條帶的吸光度值,將各組的吸光度值行統(tǒng)計學分析。
1.5人臍靜脈內皮細胞的培養(yǎng)及吸煙血清對其氧化性的檢測
將HUVEC傳至6孔板中,細胞鋪展80%時換液。分別換為正常培養(yǎng)基、10%正常大鼠血清、5%吸煙大鼠血清、10%吸煙大鼠血清、5%吸煙并注射ZnPP組大鼠血清、10%吸煙并注射ZnPP組大鼠血清。孵育18 h后,行Western blot檢測HO- 1的表達。
將HUVEC傳至12孔板中。細胞達50%匯合時分別用攜帶HO- 1的慢病毒載體感染3個孔的細胞和HO- 1 siRNA轉染3個孔的細胞。48 h后取慢病毒和siRNA干預過的細胞及正常細胞行Western blot檢測HO- 1的表達。留取3個孔加入含40%正常大鼠血清的培養(yǎng)基做對照,其余孔加入含40%吸煙大鼠血清的培養(yǎng)基。3 h后按試劑盒說明書操作檢測各組中活性氧的含量并于熒光顯微鏡下觀察。熒光的強弱代表細胞內活性氧的含量即細胞被氧化的程度。用Image-ProPlus 6.0軟件測量各組的熒光強度并進行統(tǒng)計學分析。
1.6 統(tǒng)計學分析
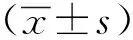
2 結果
2.1 慢病毒載體pLenti-HO- 1構建成功
擴增的目的基因片段大小與預期的相符。HEK293T能夠成功表達重組質粒。慢病毒感染的HEK293T及HUVEC有綠色熒光出現(xiàn)且慢病毒感染兩種細胞的效率均較高。兩種細胞均成功表達HO- 1,表明慢病毒載體pLenti-HO- 1構建成功且能有效感染HEK293T和HUVEC。
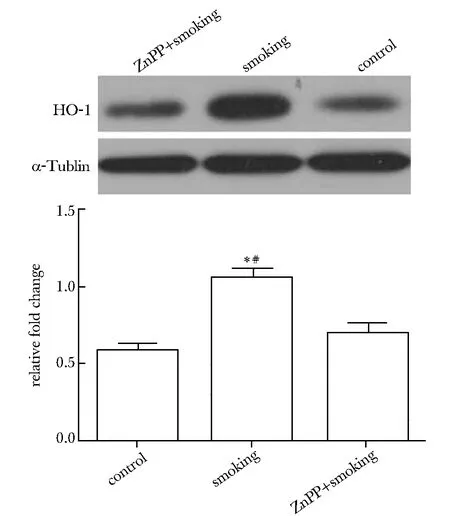
*Plt;0.01 compared with ZnPP+smoking; #Plt;0.01 compared with control圖1 不同處理組大鼠頸動脈HO- 1表達情況Fig 1 The expression of HO- 1 in carotid arteriestreated differently
2.2 不同處理組大鼠頸動脈HO- 1含量的檢測
吸煙組大鼠頸動脈中HO- 1含量明顯高于正常對照組大鼠(Plt;0.01)和吸煙并注射ZnPP組大鼠(Plt;0.01)(圖1)。
2.3不同處理組大鼠血清對HUVEC中HO-1表達的影響
正常大鼠血清對HUVEC中HO- 1的表達無明顯影響。吸煙大鼠血清能夠明顯誘導HO- 1的表達(Plt;0.01),且表達成劑量依賴性(10%組高于5%組)。吸煙并注射ZnPP組的大鼠血清也能夠明顯誘導HO- 1的表達(Plt;0.01),且表達成劑量依賴性(10%組高于5%組)。同時其誘導HO- 1的表達明顯高于各個濃度的吸煙大鼠血清(Plt;0.05)(圖2)。

*Plt;0.01 compared with control; #Plt;0.01 compared with 10% smoking圖2 不同處理組大鼠血清對HUVEC細胞中HO- 1表達的影響Fig 2 The expression of HO- 1 in HUVEC incubatedin serum of rats treated differently
2.4吸煙大鼠血清對HUVEC的氧化作用及HO-1的抗氧化作用
慢病毒載體和siRNA能夠成功使HO- 1基因過表達和抑制(Plt;0.01)(圖3)。加入吸煙大鼠血清的正常HUVEC組細胞內活性氧含量明顯多于加入正常大鼠血清組(Plt;0.01)及HO- 1過表達組(Plt;0.01),HO- 1抑制組高于加入吸煙大鼠血清的正常HUVEC組(Plt;0.05)(圖4)。
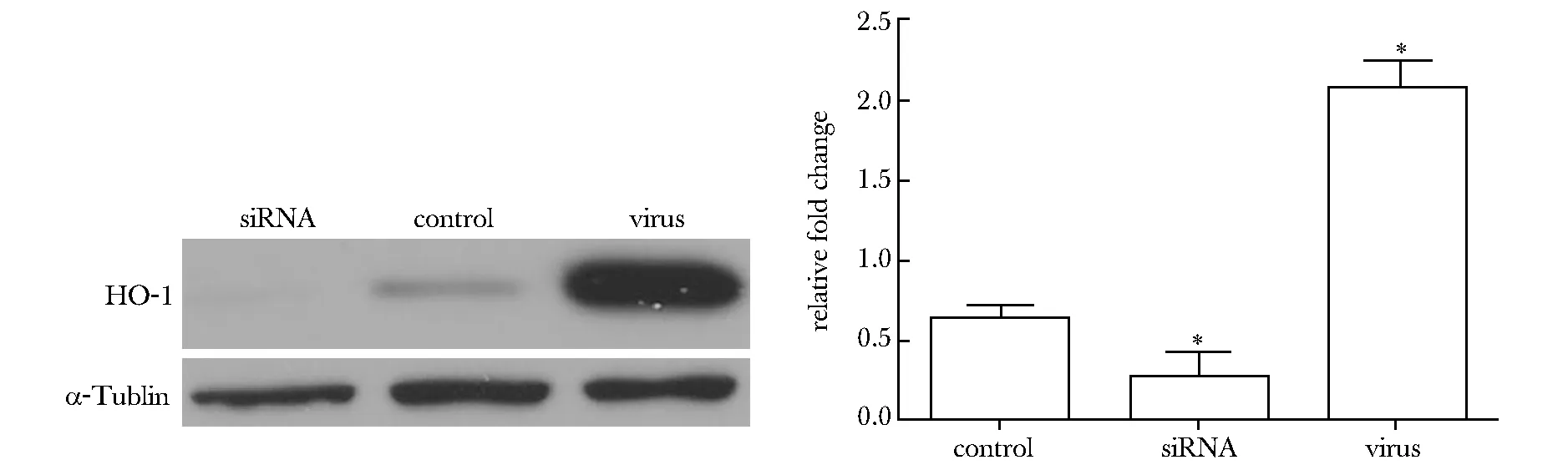
*Plt;0.01 compared with control圖3 病毒感染組和siRNA轉染組HUVECs中HO- 1表達情況Fig 3 The expression of HO- 1 in virus infecting and siRNA transfecting HUVECs
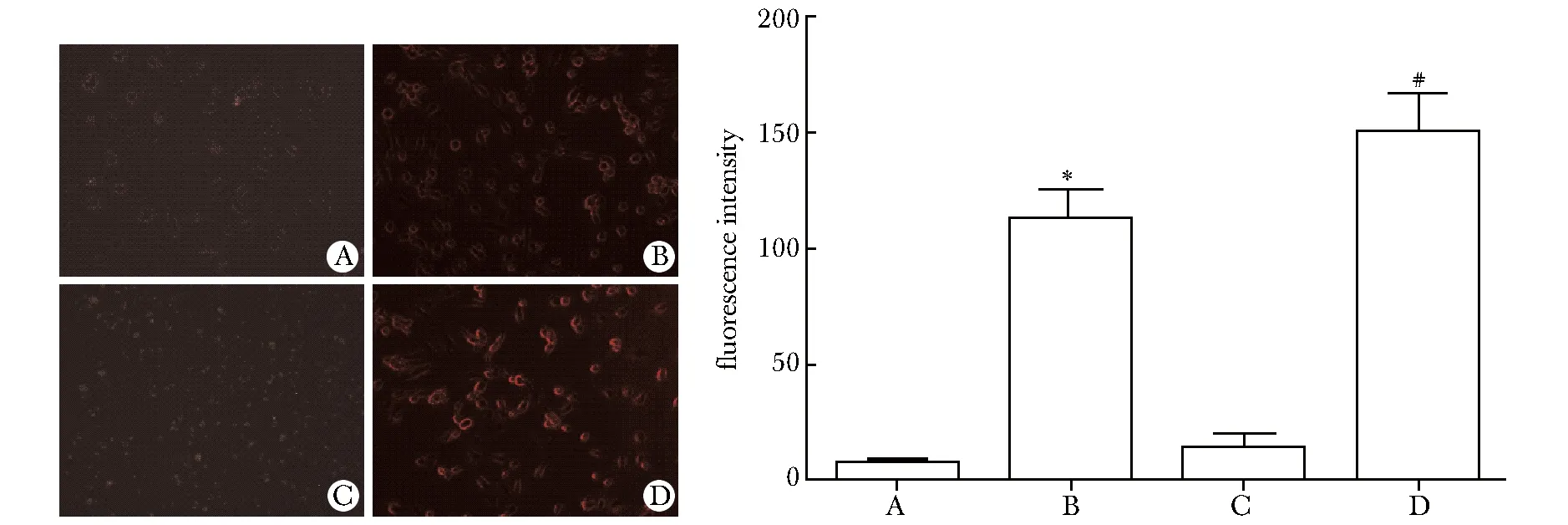
A.HUVECs incubated in the serum of normal rats; B. HUVECs incubated in the serum of smoking rats; C.HUVECs(infected by virus) incubated in the serum of smoking rats; D.HUVECs(transfected by siRNA) incubated in the serum of smoking rats;*Plt;0.01 compared with A or C;#Plt;0.05 compared with B
圖4吸煙大鼠血清對HUVECs細胞的氧化作用及HO-1的保護作用
Fig4TheoxidativeroleoftheserumofsmokingratsandtheantioxidanteffectofHO-1(×100)
3 討論
據(jù)統(tǒng)計香煙的煙霧中含有的毒害物質有4 000多種[5],包括高濃度的活性氧、NO、過(氧化)亞硝酸鹽及多種有機化合物[6- 7]。這些物質中很多是水溶性的,可以直接進入血液循環(huán),進而可以對組織細胞造成包括氧化損傷在內的多種損傷[8]。吸煙造成氧化損傷的機制主要包括,煙霧中的活性氧等成分可以直接對組織細胞造成氧化損傷,煙霧中某些成分可以激活細胞內氧化應激相關的酶進而引起氧化損傷,煙霧可以引起機體的炎性反應進而導致氧化損傷[9- 10]。因此氧化損傷是吸煙造成組織損傷的主要形式之一。減輕吸煙造成的氧化損傷對于保護吸煙狀態(tài)下的血管具有重要意義。
本研究中吸煙可以明顯誘導大鼠頸動脈中HO- 1的表達。這表明吸煙可以引起血管的氧化損傷,進而誘導抗氧化物質HO- 1的表達。吸煙大鼠血清能夠誘導HUVEC中HO- 1的表達,且表達成劑量依賴性。這間接表明吸煙大鼠血清能夠造成HUVEC的氧化損傷。吸煙并注射ZnPP組大鼠血清也能夠明顯誘導HUVEC中HO- 1的劑量依賴性的表達,且表達量明顯高于吸煙大鼠血清。這說明抑制了吸煙大鼠體內HO- 1的表達后,機體組織受到了更強的氧化損傷,其血清中能造成氧化損傷的物質更多,能夠對HUVEC造成更強的氧化損傷。同時間接表明HO- 1能夠減輕吸煙誘導的氧化損傷。用DHE直接檢測加入吸煙大鼠血清的HUVEC中活性氧的含量,結果顯示HO- 1低表達組最多,其次是正常HUVEC組,HO- 1過表達組最少。這直接說明吸煙大鼠血清對HUVEC具有明顯的氧化損傷作用,HO- 1能夠減輕這種氧化損傷作用。
[1] Davies KJ. Oxidative stress, antioxidant defenses, and damage removal, repair, and replacement systems[J]. IUBMB Life,2000,50:279- 289.
[2] Neubauer JA, Sunderram J. Heme oxygenase- 1 and chronic hypoxia[J]. Respir Physiol Neurobiol, 2012,184:178- 185.
[3] Wilson SJ, Keenan AK. Role of hemin in the modulation of H2O2-mediated endothelial cell injury[J]. Vascul Pharmacol, 2003,40:109- 118.
[4] Hautamaki RD, Kobayashi DK, Senior RM,etal. Requirement for macrophage elastase for cigarette smoke-induced emphysema in mice[J]. Science,1997,277:2002- 2004.
[5] Csiszar A, Podlutsky A, Wolin MS,etal. Oxidative stress and accelerated vascular aging: implications for cigarette smoking[J]. Front Biosci (Landmark Ed),2009,14:3128- 3144.
[6] Pryor WA, Stone K, Zang LY,etal. Fractionation of aqueous cigarette tar extracts: fractions that contain the tar radical cause DNA damage[J]. Chem Res Toxicol,1998,11:441- 448.
[7] Zang LY, Stone K, Pryor WA. Detection of free radicals in aqueous extracts of cigarette tar by electron spin resonance[J]. Free Radic Biol Med,1995,19:161- 167.
[8] Orosz Z, Csiszar A, Labinskyy N,etal. Cigarette smoke-induced proinflammatory alterations in the endothelial phenotype: role of NAD(P)H oxidase activation[J]. Am J Physiol Heart Circ Physiol, 2007,292:130- 139.
[9] Ambrose JA, Barua RS. The pathophysiology of cigarette smoking and cardiovascular disease: an update[J]. J Am Coll Cardiol,2004,43:1731- 1737.
[10] Burke A, Fitzgerald GA. Oxidative stress and smoking-induced vascular injury[J]. Prog Cardiovasc Dis,2003,46:79- 90.
Heme oxygenase- 1 alleviates the oxidative damagecaused by serum of smoking rats on human umbilical vein endothelial cells
YANG Gen-huan1,WU Wei2, LI Yan-chuan2, NI Leng1, WANG Zhan-qi1, WANG Chao-nan1, LIU Chang-wei1*
(1.Dept. of Vascular Surgery, PUMC Hospital, CAMS amp; PUMC, Beijing 100730;2.State Key Laboratory of Medical Molecular Biology, CAMS amp; PUMC,Beijing 100005,China)
ObjectiveTo study whether heme oxygenase- 1(HO- 1) may alleviate the oxidative damage caused by serum of smoking rats on human umbilical vein endothelial cell(HUVEC).MethodsFifteen male sprague-dawley rats were randomized into control group,smoking group and smoking with Zincprotoporphyrin(ZnPP) group.Western blot was used to detect the expression of HO- 1 in carotid arteries of the rats.Also the expression of HO- 1was detected in HUVEC cultured in the serum of normal rats,smoking rats and smoking with ZnPP rats.The reactive oxygen species were detected in HO- 1-overexpressing and HO- 1-lowexpressing HUVEC,cultured in the serum of smoking rats.ResultsThe expression of HO- 1 in carotid arteries of smoking rats was significantly higher than that of normal rats(Plt;0.01).Both the serum of smoking rats and HO- 1depressed smoking rats induced the expression of HO- 1 in HUVEC,and the role of the latter was more significant(Plt;0.01).The reactive oxygen species of HUVEC cultured in the serum of smoking rats were more than that cultured in the serum of nornal rats(Plt;0.01),also the HO- 1 may release the oxidative damage(Plt;0.01).ConclusionsSmoking can cause the oxidative damage to HUVEC,and HO- 1 alleviates the damage.
smoking; heme oxygenase- 1; endothelial cell; oxidative damage
2014- 04- 25
2014- 05- 27
北京市自然科學基金(7122145)
*通信作者(correspondingauthor):liucw@vip.sina.com
1001-6325(2014)10-1358-05
Q 554
A

