腦毒清顆粒對腦缺血再灌注損傷大鼠SOD、MDA及hs-CRP含量的影響*
王 巍 曲 穎 賈維剛△ 王加志
(1.黑龍江省中醫藥科學院,黑龍江 哈爾濱 150001;2.黑龍江省醫院,黑龍江 哈爾濱 150001;3.黑龍江中醫藥大學佳木斯學院,黑龍江 佳木斯 154000)
急性腦缺血屬中醫學“中風”范疇,源于《內經》對中風病因病機的認識。中醫藥在防治缺血性中風急性期方面具有一定優勢,一定程度上提高了急性缺血性中風的臨床療效。近年來研究表明,腦缺血-再灌注過程中產生大量氧自由基,致使神經細胞功能受到嚴重影響;同時,腦缺血再灌注時繼發的炎癥級聯反應促進繼發性腦損害,是導致腦組織損傷的重要途徑[1-2]。本研究通過建立大鼠腦缺血再灌注損傷動物模型,觀察腦毒清顆粒對大鼠神經功能損傷情況的影響,以及血清中超氧化物歧化酶(SOD)、丙二醛(MDA)和超敏C反應蛋白(hs-CRP)含量的變化,探討腦毒清顆粒治療腦缺血再灌注損傷的作用機制,為指導其在臨床的應用提供實驗依據。
1 材料與方法
1.1 動物 健康雄性SD大鼠80只(SPF級),體質量(300±20)g,由黑龍江省哈爾濱市實驗動物中心提供,合格證號2011007018。
1.2 試藥與儀器 腦毒清顆粒(由黑龍江省中醫研究院藥劑室提供);SOD、MDA檢測試劑盒 (南京建成生物工程研究所);大鼠hs-CRP ELISA試劑盒(上海江萊生物科技有限公司)。電子分析天平TG SA(上海微光儀器廠);臺式離心機TDL-60B(北京醫用離心機廠);紫外可見光光度計尤尼柯UV-2102PCS(上海第二分析儀器廠);數顯式電熱恒溫箱 (上海躍進儀器廠);MultiskanMK3型酶標儀(芬蘭Thermo Labsys-tems公司)。
1.3 分組與給藥 將大鼠隨機分為4組,即對照組10只,假手術組10只,模型組和腦毒清組各30只,模型組和腦毒清組按灌注時間分為12、24、48 h 3個亞組,每組10只。腦毒清組按60 mg/kg灌胃腦毒清顆粒,模型組和假手術組給予等量生理鹽水。連續給藥7 d,末次給藥30min后,對大鼠進行右側大腦中動脈阻塞模型手術。
1.4 模型制備 參照文獻[3]采用改良的線栓法復制大鼠大腦中動脈缺血再灌注損傷模型。
1.5 觀察指標 (1)神經功能缺損程度評分大鼠。在缺血2 h后立即進行再灌注,再灌注30min后即刻進行神經功能缺損程度評分。參照Longa 5分制評分標準[4]。評分為1~3分者納入實驗組,未達標準者排除。假手術組、模型組和腦毒清組,分別于12、24、48 h 3個時間點觀察實驗指標。(2)SOD、MDA和hs-CRP含量測定。假手術組于麻醉前及假手術后12 h眼窩取血。模型組及腦毒清組于MCAO前眼窩取血,術后各時間點斷頭取血。離心分離血清備用。采用比色法測定大鼠血清SOD、MDA含量,采用ELISA方法檢測大鼠血清hs-CRP含量,操作步驟嚴格按照說明書進行。
1.6 統計學處理 應用SPSS11.0統計軟件分析。計量資料以()表示,多組間數據比較采用方差分析,兩組間比較采用t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 腦毒清顆粒對大鼠神經功能缺損程度評分的影響 見表1。結果示缺血再灌注術后,模型組動物表現出明顯神經運動功能障礙,而腦毒清組大鼠神經功能缺損癥狀有不同程度改善(P<0.05或P<0.01)。
表1 各組缺血再灌注術后神經功能缺損程度評分(分,)

表1 各組缺血再灌注術后神經功能缺損程度評分(分,)
與模型組同時期比較,*P<0.05,**P<0.01。下同。
2.2 腦毒清顆粒對大鼠血清SOD含量的影響 見表2。模型組大鼠血清中SOD含量明顯低于假手術組;腦毒清組大鼠血清中SOD含量明顯高于模型組,均有明顯差異(P<0.01)。
表2 各組大鼠血清SOD含量比較(U/mL,)
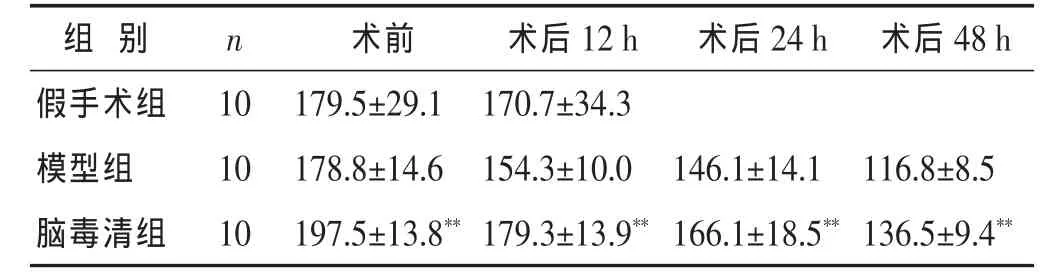
表2 各組大鼠血清SOD含量比較(U/mL,)
2.3 腦毒清顆粒對大鼠血清中MDA含量的影響 見表3。表3顯示模型組大鼠血清中MDA含量明顯高于假手術組;腦毒清組含量低于模型組,有顯著差異(P<0.01)。
表3 各組大鼠血清MDA含量比較(nmol/mL,)
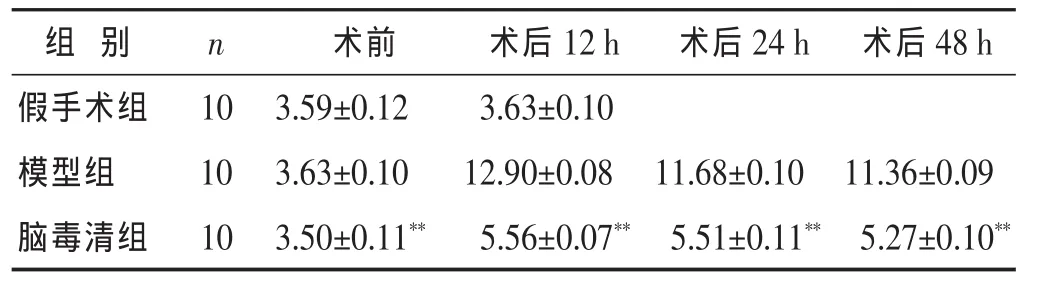
表3 各組大鼠血清MDA含量比較(nmol/mL,)
2.4 腦毒清顆粒對大鼠血清hs-CRP含量的影響 見表4。表4顯示,腦毒清組分別與模型組在術前及術后12、24、48 h 比較,均有顯著差異(P<0.01)。
表4 各組大鼠血清hs-CRP含量比較(mg/L,)
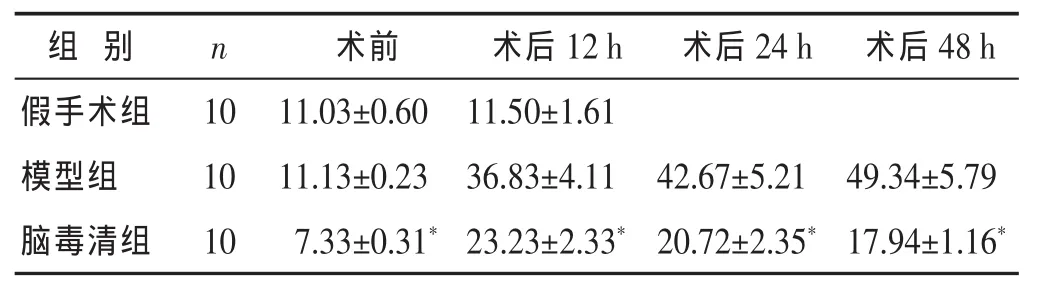
表4 各組大鼠血清hs-CRP含量比較(mg/L,)
3 討 論
腦缺血-再灌注過程中產生的大量氧自由基通過氧化反應造成細胞膜磷脂分子中的不飽和脂肪酸過氧化,最終產生多量的脂質過氧化物,脂質過氧化物經過氧化酶催化生成MDA,最終使磷脂結構發生變化,細胞膜受到嚴重損傷,致使神經細胞功能受到嚴重影響,加重腦水腫[1]。正常機體內存在抗氧化系統,如超氧化物歧化酶等抗氧化酶,該系統可相互協調清除自由基,減少脂質過氧化物的產生,使人體內自由基的生成和清除處于動態平衡狀態。但在缺血再灌注損傷條件下,機體會產生大量的自由基,使脂質過氧化物生成與清除平衡被打破,引起組織的損傷[5-6]。MDA是脂質代謝產物,MDA含量多少可以間接反映出腦組織中氧自由基含量的變化以及氧自由基引起脂質過氧化程度,從而判斷腦細胞損傷程度;SOD是機體清除氧自由基的主要酶類,其活性高低可以間接反映腦組織清除氧自由基的能力。
研究表明,hs-CRP不僅是炎癥的標記物,也是炎癥的重要參與者[7-8],其可與脂蛋白結合,由經典途徑激活補體系統,介導腦缺血/再灌注損傷的級聯反應的發生,造成血管內膜損傷。局部腦缺血后,升高的hs-CRP直接導致炎性介質白細胞介素(IL-1、IL-6)和自由基的大量釋放,引起血管痙攣,導致半暗帶區域組織缺血、缺氧。同時受損的內皮細胞功能紊亂,激活了一定的細胞因子(如 TNF-α、IL-1、IL-6 等),促使腦血管缺血程度增加。另外,hs-CRP可與粒細胞、單核細胞的CRP受體結合,使之浸潤、聚積,產生細胞因子,造成血管損傷。另一方面,hs-CRP升高促使血管內皮細胞間黏附分子-1、C-選擇素等黏附分子的表達,促進了巨噬細胞等炎癥性細胞進入血管內皮,造成炎癥損傷。此外,hs-CRP還有免疫調節活性:其分解產生的多肽具有較強的免疫調節活性,能夠促進局部免疫調節障礙,加重神經損傷的程度。因此,hs-CRP不但是預測中風病發病的獨立危險因素和評估病情及預后的最敏感指標[8],并且在導致缺血性腦損傷級聯反應的炎癥機制中起著關鍵的作用。
本研究發現,各時間點模型組大鼠在腦缺血再灌注損傷后,出現明顯的神經功能缺損癥狀,同時大鼠血清中SOD含量較正常組明顯降低,MDA含量較正常組明顯升高,hs-CRP含量較正常組明顯升高;經腦毒清顆粒治療后各時間點大鼠神經功能缺損程度評分下降,說明腦毒清顆粒能夠減輕腦缺血再灌注損傷,此時該組各時間點大鼠血清中SOD含量較模型組升高,MDA含量較模型組降低,hs-CRP含量較模型組降低。說明腦毒清顆粒能通過調節人體自由基的生成和清除的動態平衡狀態,降低炎癥標記物的含量,達到保護腦組織的目的。同時,筆者發現,與模型組相比,治療組血清hs-CRP在早期(12 h)升高之后則持續下降趨勢。腦毒清顆粒減輕再灌注損傷的作用是通過降低hs-CRP的炎癥水平、消減炎癥級聯反應的啟動因素來實現的。本研究結果表明,腦毒清顆粒在防治腦腦缺血再灌注損傷過程中有良好的保護作用,能夠通過降低hs-CRP的啟動、調節和清除自由基進而減少神經功能的缺損程度。
[1]Schmidley JW.Freeradicalsin central nervous system[J].Ischemia Stroke,1990,21(7):1086.
[2]羅梅,賀巖.復發性腦梗死患者高敏C-反應蛋白變化及相關因素分析[J].國際檢驗醫學雜志,2010,31(5):506.
[3]馬賢德,孫宏偉.線栓法制備大鼠腦缺血再灌注模型的方法研究[J].中華中醫藥學刊,2009,27(6):1200-1201.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84-91.
[5]印大中.衰老奧秘研究最新進展:自由基氧化-非酶糖基化衰老學說[J].現代中西醫結合雜志,2005,14(1):7.
[6]Takayasu Y,Nakaki J,Kawasaki T,et al.Edaravone,a radical scavenger,inhibits mitochondrial permeability transition pore in rat brain[J].Pharmacol Sci,2007,103:434-437.
[7]Di Napoli M,Di Gianfilippo G,Sollecito A,et al.C-reactive protein and outcome after first-ever ischemic stroke [J].Stroke,2000,31:238-239.
[8]Elkind MS,Tai W,Coates K,et al.High-sensitivity C-reactive protein, lipoprotein-associated phospholipids A2, and outcome after ischemic stroke[J].Arch Intern Med,2006,166(19):2073.

