近距離內照射125I植入治療非小細胞肺癌質量控制的探討及意義
蘇 倩,張遵城,楊景魁,鄭廣鈞,郭永濤,李小東
(天津醫科大學第二醫院,天津300211)
肺癌不但常見,而且在絕大部分地域是引起癌癥相關死亡的首要原因[1]。約占肺癌總數80%的非小細胞肺癌(NSCLC)目前多以手術、放療和化療等綜合治療為主[2]。但由于約80%患者確診時已屬晚期,或因體質等原因手術或外照射放療禁忌,近距離內照射125I植入治療得到越來越多的肯定與關注[3],但如何進行必要的質量控制(QC)來保證療效和低損則是必須面對的問題。本文針對該療法實施過程中的關鍵環節闡述了QC具體要求,旨在獲得較好的臨床治療增益比。
1 資料與方法
1.1 臨床資料 NSCLC患者共172例,男108例、女64例,年齡36~84歲、平均62.9歲。患者KPS評分>70分,預計生存時間>6個月。植入前經臨床、支氣管鏡、各種影像學及病理活檢證實為NSCLC,均為手術及外照射放療禁忌者。僅借助CT定位的無阻塞性肺不張NSCLC患者137例(CT組),TNM分期Ⅲb~Ⅳ期,腫瘤直徑2~8 cm;中央型和周圍型分別為42例和95例。需18F-FDG符合線路SPECT/CT協助生物靶區定位的阻塞性肺不張NSCLC患者35例(SPECT/CT組),均為中央型肺癌,常規CT檢查難以分辨腫瘤和肺不張邊界。
1.2 方法
1.2.1 放射性125I粒子植入方法 放射性125I粒子植入前一周內行薄層CT掃描,必要時應用符合線路SPECT/CT協助生物靶區的定位,依腫瘤邊界確定大體靶區(GTV),將GTV外擴5~10 mm作為計劃靶區。將圖像上傳至治療計劃系統(TPS)逐層勾畫靶區并設計治療方案。要求確定處方劑量(PD)80~90 Gy后,按照周緣密集、中心稀疏的原則確定植入方式,并限定危及器官(OAR)的受照劑量;TPS自動計算粒子在瘤區及周緣的劑量空間分布,繪制等劑量曲線、適形分布狀態、粒子分布圖和植入通道等,并計算出腫瘤匹配周緣劑量(MPD),確定植入導針數、粒子數、粒子活度及總活度;TPS模擬手術方式及植入情況,調整導針數目、位置、方向和粒子的數目。粒子植入前,在同一批次粒子中抽查至少15%的粒子再次對放射性粒子源的活度進行檢測,測量結果偏差均在±5%以內,符合國際原子能機構(IAEA)要求。粒子植入時根據腫瘤位置選擇適宜的治療體位,同時動態監測患者心電、血壓和氧飽合度等。常規消毒鋪巾和局麻后,影像引導植入時,行薄層CT掃描,確定進針位置、最佳皮膚進針點、角度及深度。植入時采用平行進針,施源針要避開鄰近血管和重要臟器,邊退針邊植粒,按PD分別將放射性125I粒子植入瘤灶不同部位。應嚴格掌控粒子植入范圍,125I粒子射線輻照有效范圍為1.7 cm,80%的劑量分布在1 cm內,距離皮膚、血管、氣管均應在1 cm左右[4]。植入時逐層進行CT掃描,依實際情況調整針尖位置、進針路徑和粒子數目,實現影像引導下實時位置校正,以期與治療前的TPS相符。
植入完成后進行CT掃描,通過TPS進行劑量學驗證,確定各層粒子分布和數量,通過等劑量曲線和劑量體積直方圖等顯示靶區和周圍OAR的實際受量,通過調整PD和MPD等保護正常組織及器官;按照治療計劃要求的PD分布符合雙90%定律、MPD等于PD、OAR不超過耐受劑量、最高劑量區域不超過2倍PD、適形度=l及植入粒子劑量的不均勻度小于PD 20%等原則,及時糾正熱區及冷區,確保粒子空間分布均勻、劑量分布高度適形及正常組織低劑量,劑量分布盡量與治療前計劃相符合,并注意并發癥的發生及做相應處理。
1.2.2 臨床療效評價 治療結束后隨訪24個月。術后6個月復查CT,將治療前后CT圖像上兩個相互垂直的腫瘤最大直徑的乘積進行比較,以評價瘤灶治療效果。肺內目標病灶按WHO實體腫瘤療效評價標準進行評判:①完全緩解(CR):腫瘤完全消失,影像學上不能顯示腫瘤或僅有條索狀影;②部分緩解(PR):腫瘤縮小,兩最大徑乘積較治療前減小≥50%;③無變化(NC):兩最大徑乘積較治療前減小<50%或增大<25%,無新病灶出現;④進展(PD):兩最大徑乘積較治療前增大≥25%或出現新的轉移病灶。1年和2年生存指標用總生存率表示。
1.2.3 統計學方法 數據以百分比表示,比較采用乘積極限法Kaplan-Meier。P≤0.05為有統計學差異。
2 結果
2.1 近距離內照射125I植入治療放射劑量學驗證結果及隨訪情況 CT組治療前后,實際植入治療粒子數及劑量學分布與TPS的符合率達94.16%(129/137);其中6例因肋骨阻擋及無法控制呼吸動度而未按計劃植入,2例進行了立即補種。靶區劑量統計符合臨床放射劑量學原則,適形系數(r)也在合適范圍內。局部控制的總有效率為91.97%(126/137),1年和2年生存率分別是 91.24%(125/137)和50.36%(69/137)。51例患者植入后出現一過性氣胸,但氣胸量較少,經對癥處理后均緩解;出現咳血和發熱各7例,2例穿刺點有少量出血,均經對癥治療后好轉。出現放射性肺炎3例,未發現放射性肺纖維化、放射性食管炎、放射性脊髓炎及心臟損害。SPECT/CT組中,21例復查符合線路SPECT/CT顯像,顯示靶區活性消失和明顯改善者分別為19例和2例。總有效率為91.43%(32/35),1 年生存率為 88.57%(31/35)。并發癥包括:少量咳血9例、發熱4例、氣胸3例,均經對癥治療后好轉。未見粒子移位和脫落,未發生嚴重并發癥。137例患者活度監測率>15%,總體平均的匹配MPD為87.6%,靶區90%體積受到照射量(D90)為91.5%,r為0.94~1.09。
2.2 與其他放射治療方法的歷史對照研究比較見表1。近距離內照射125I植入治療NSCLC具有治療增益比高和低損優勢(P均<0.05)。
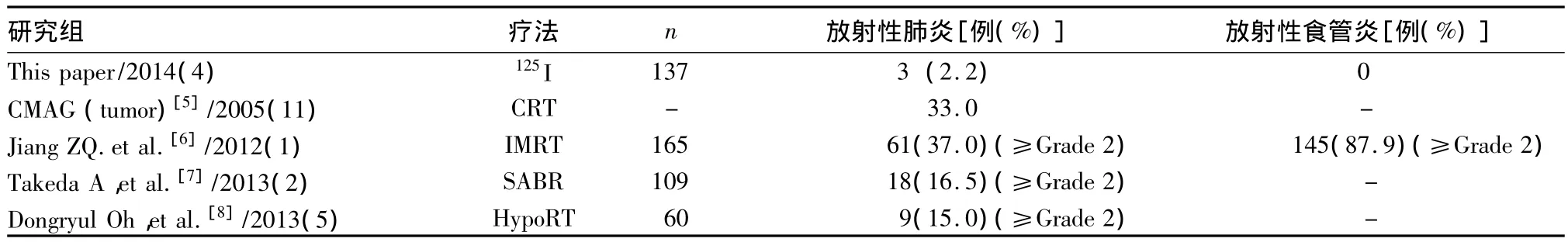
表1 近距離內照射125I植入治療與其他外照射治療的對比
3 討論
IAEA在TECDOC-1274中強調,放射治療中心應當制定全面的質量保證(QA)計劃以確保近距離放射治療的安全實施,而且應貫穿于從計劃到實施的各個階段[5~9]。全面的QA計劃不僅要求實行源校準,而且應確保用于患者治療的所有設備和技術(包括敷貼器、定位技術、TPS、劑量計算方法、電離室等)有嚴格的QC,對其中的關鍵環節實行QC意義重大。
放射性粒子活度是否符合要求,是保證近距離照射125I植入治療NSCLC療效的基礎。1999年,IAEA推薦使用放射性活度計之井型電離室測量粒子源活度,并出版近距離源刻度技術規范[10]供世界范圍內不同國家參照使用。目前,通過用國家一級標準125I密封粒子源在特定不變的幾何條件下確定放射性活度計的標定系數來測定125I粒子的放射性活度[10]。事實上,國內不是所有開展125I粒子植入治療惡性腫瘤的醫院都配備井型電離室,更多的是依據粒子源生產廠家給出的放射性活度值。按規定,新源出廠時應標明半衰期,廠商應保證向用戶提供精度在5%以內的定標證書;在訂購粒子源時,用戶應要求制造商提供源均勻性證書。然而由于廠家給出的源活度往往誤差較大[8]甚至未給出源活度,無法滿足治療需求,還可能因源校準不力致劑量過高或過低而發生醫療事故[9],因此粒子植入前再次測定放射性活度很有必要。
正確應用影像引導設備是保證近距離內照射125I植入治療質量的關鍵環節。粒子植入方法主要包括:經皮影像(B 超、CT、MRI、PET-CT等)引導下植入,經內鏡(腹腔鏡、胸腔鏡、自然管道內鏡等)植入及手術直視下放射性粒子植入。而CT引導下經皮穿刺放射性粒子植入因其定位精確、安全高效、微創且并發癥少在臨床廣泛應用,尤其在肺惡性腫瘤的近距離治療中極具優勢。相比于腔內照射,其由于在粒子插植過程中,因呼吸運動而造成的腫瘤移位不會影響劑量而被認為高度適形[11]。Wang等[12]報道了21例有手術禁忌證的NSCLC患者,均在CT引導下行125I植入治療,隨訪2~30個月。結果顯示,治療后患者疼痛緩解率83.3%,1年和2年生存率分別為42.4%和6.5%,腫瘤局部控制率85.7%。未發現重大并發癥,輕微的并發癥(19%)包括輕度氣胸、血痰、胸腔積液和局部皮膚紅斑各1例[12]。本研究結論與其相符。
TPS的正確應用是125I粒子植入治療增益比得以提高的保證。近距離放射治療中采用TPS能使醫生從經驗估計和手工計算中解放出來,不但提高了治療計劃的質量和劑量計算精度,而且能夠提供一個計劃評估手段,TPS協助實現了器官和腫瘤的三維劑量顯示、等劑量曲線曲面的可視化、適形輪廓位置計算和優化、粒子布置優化以及施源器的自動識別導引等。TPS的精確性對近距離放射治療的功效有重要影響[13]。因此對TPS的QC愈發重要,具體的措施包括:使用前初始檢測其所具有功能和精度;定期檢測計算機硬件設備,確保其順利運行;及時發現系統錯誤及軟件故障,采用初始檢查和系統檢查的方法更正;使用的計算機系統應有詳細操作說明;個體化設計治療方案。
靶區的準確定位也是保證療效必要的QC手段。對伴有肺不張的患者,因炎性反應可導致解剖概念上的靶區勾畫無法準確進行,有時即使進行CT強化和薄層掃描也難以區分病變邊界。符合線路SPECT/CT能夠提供腫瘤組織或細胞代謝與生化變化等生物學信息的生物靶區,腫瘤細胞具有較強的積聚18F-FDG能力,而肺不張組織則是輕度攝取。本研究的35例患者采用18F-FDG符合線路SPECT/CT協助定位診斷,勾畫靶區更加精確,周圍正常組織及器官損害更低,治療更加安全。
綜上所述,重視近距離內照射125I植入治療NSCLC的QC是保證療法精確度更高、不良反應更少的必要措施,也是保證療效的重要手段。
[1]Are C,Rajaram S,Are M,et al.A review of global cancer burden:trends,challenges,strategies,and a role for surgeons[J].J Surg Oncol,2013,107(2):221-226.
[2]Goldstraw P,Ball D,Jett JR,et al.Non-small-cell lung cancer[J].Lancet,2011,378(9804):1727-1740.
[3]Powell JW,Dexter E,Scalzetti EM,et al.Treatment advances for medically inoperable non-small-cell lung cancer:emphasis on prospective trials[J].Lancet Oncol,2009,10(9):885-894.
[4]李小東,李亞明.重視放射性粒子植入治療的規范化[J].中華核醫學與分子影像雜志,2013,33(4):241-242.
[5]中華醫學會.臨床診療指南―腫瘤分冊[M].北京:人民衛生出版社,2005:117-118.
[6]Jiang ZQ,Yang K,Komaki R,et al.Long-term clinical outcome of intensity-modulated radiotherapy for inoperable non-small cell lung cancer:the MD Anderson experience[J].Int J Radiat Oncol Biol Phys,2012,83(1):332-339.
[7]Takeda A,sanuki N,eriguchi T,et al.stereotactic ablative body radiation therapy for octogenarians with Non-Small Cell Lung Cancer[J].Int J Radiation Oncol Biol Phys,2013,86(2):257-263.
[8]Oh D,Ahn YC,Kim B,et al.Hypofractionated three-dimensional conformal radiation therapy alone for centrally located cT1-3N0 non-small-cell lung cancer[J].J Thorac Oncol,2013,8(5):624-629.
[9]Pacilio M,Aragno D,Rauco R,et al.Monte Carlo dose calculations using MCNP4C and EGSnrc/BEAMnrc codes to study the energy dependence of the radiochromic film response to beta-emitting sources[J].Phys Med Biol,2007,52(13):3931-3948.
[10]馬力文.125I放射性密封源結構簡介和質量控制[M]//王俊杰,修典榮,冉維強.放射性粒子組織間近距離治療腫瘤.第2版.北京:北京大學醫學出版社,2004:317.
[11] Sharma DN,Rath GK.Brachytherapy for medically inoperable lung cancer[J].Lancet Oncol,2009,10(12):1141-1142.
[12]Wang ZM,Lu J,Liu T,et al.CT-guided interstitial brachytherapy of inoperable non-small cell lung cancer[J].Lung Cancer,2011,74(2):253-257.
[13]Mosleh Shirazi MA,Faghihi R,Siavashpour Z,et al.Independent evaluation of an in-house brachytherapy treatment planning system using simulation,measurement and calculation methods[J].J Appl Clin Med Phys,2012,13(2):3687.

