胃癌組織中趨化因子受體CXCR7的表達變化及意義
辛 琪,張 娜,張傳山,楊 艷,劉 煒
(1天津市第三中心醫院天津市人工細胞重點實驗室,天津300170;2天津市大港醫院)
胃癌是人類常見的消化道腫瘤之一,胃癌患者的預后與腫瘤的侵襲、轉移密切相關。遠處轉移已成為提高患者生存率的主要障礙,因此研究胃癌轉移的分子機制,探尋能夠治療胃癌的潛在靶點具有重要的現實意義。近來研究表明,基質細胞衍生因子1(SDF-1)及其受體在腫瘤的生長、侵襲、轉移過程中發揮重要的調控作用,而SDF-1被認為是通過其惟一受體CXCR4起作用。近來研究卻發現,SDF-1還存在另一趨化因子受體CXCR7,并認為其對腫瘤進程也有潛在作用[1,2],但目前對于 CXCR7在胃癌中的作用國內未見報道。本研究利用免疫組化及免疫熒光染色法檢測胃癌組織中CXCR7的陽性表達率及部位,并探討其意義。
1 資料與方法
1.1 臨床資料 選取2009~2011年在天津市腫瘤醫院行胃癌根治手術的160例患者的石蠟標本作為觀察組,均經HE切片復讀確認,患者術前未經任何針對腫瘤的治療。按照Lauren's分型法分為腸型胃癌120例(包括高中分化管狀腺癌78例,低分化管狀腺癌42例),彌漫型胃癌40例(均為印戒細胞癌)。同時選取天津市大港醫院因胃良性病變行胃次全切除術的30例患者的石蠟標本作為對照組,兩組性別、年齡均具有可比性(P均>0.05)。
1.2 方法
1.2.1 組織CXCR7表達水平及部位檢測 所有標本均經10%中性甲醛固定,常規石蠟包膜,4 μm連續切片。CXCR7稀釋濃度為1∶100,采用免疫組化法檢測組織CXCR7表達,嚴格按照說明書操作。CXCR7陽性著色主要定位于細胞質,陽性信號呈淡黃色或棕黃色顆粒。隨機選取5個高倍視野(×400),根據陽性細胞百分比計分:無陽性細胞為0分,1%~29%為1分,30%~59%為2分,≥60%為3分;染色強度:陰性為0分,輕度淡黃色為1分,中度棕黃色為2分,深棕黃色為3分;按陽性細胞百分比計分×染色強度計分,<2計為陰性,≥2為陽性。
采用免疫熒光雙染法檢測組織CXCR7表達部位,紅色代表CXCR7陽性部位,綠色代表CD31血管內皮陽性部位,黃色代表CXCR7與CD31共同陽性表達部位。
1.2.2 資料收集方法 記錄觀察組的臨床病理資料,包括性別、年齡、腫瘤大小、腫瘤分化程度、腫瘤浸潤深度及有無淋巴結轉移和腫瘤臨床分期等。
1.2.3 統計學方法 采用SPSS16.0統計軟件。率的比較采用 χ2檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 兩組CXCR7陽性表達率及表達部位比較 觀察組CXCR7陽性表達率為78.75%(126/160),對照組為6.67%(2/30),P <0.01。觀察組 CXCR7 在間質纖維母細胞和血管內皮的陽性表達率分別為81.88%(131/160)、88.75%(142/160),對照組分別為 23.33%(7/30)、33.33%(10/30),P 均 <0.01。
2.2 觀察組CXCR7表達與臨床病理參數的關系見表1。
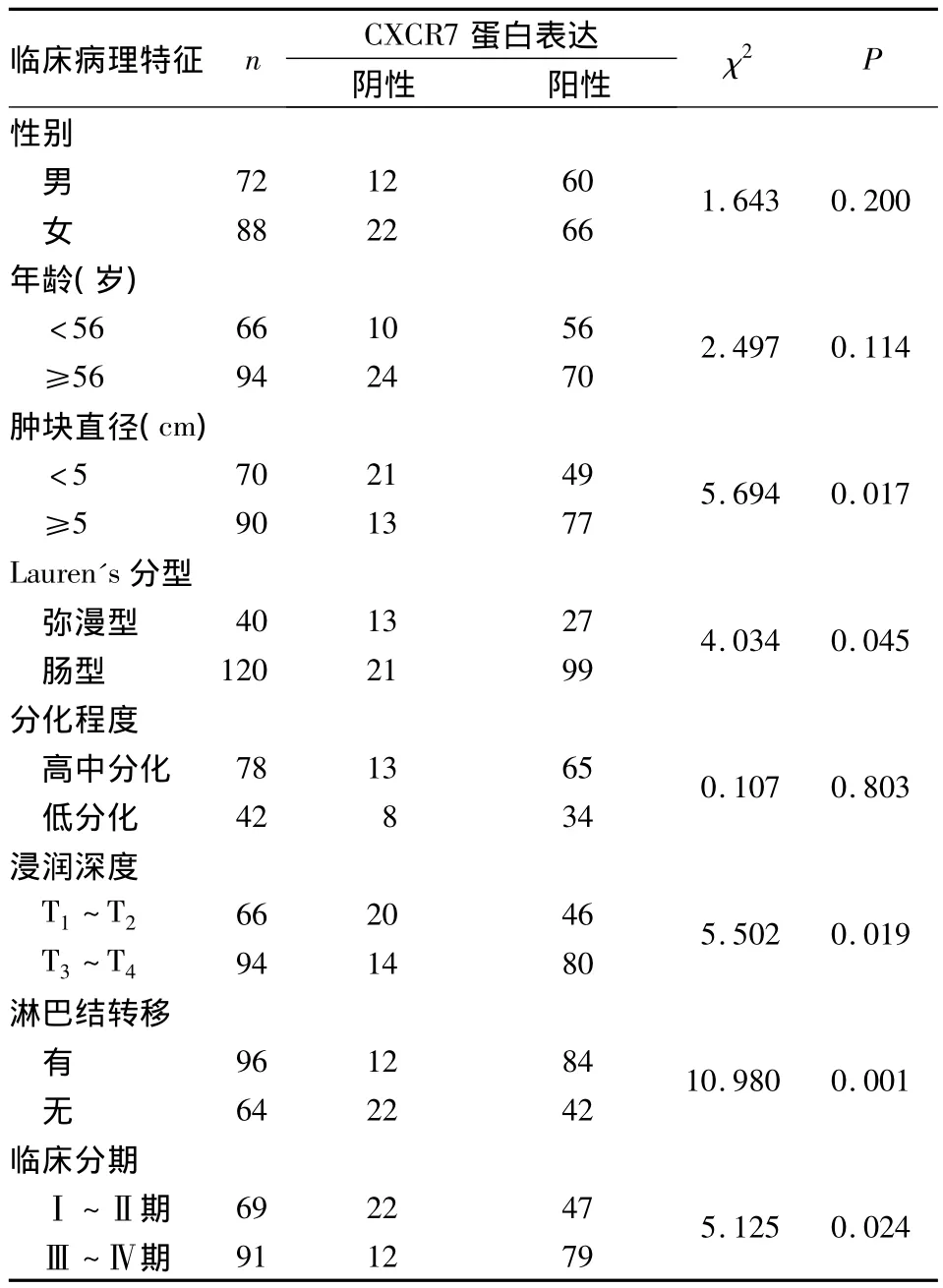
表1 觀察組CXCR7表達與臨床病理特征的關系(例)
3 討論
近年來,趨化因子及其受體在腫瘤的發生、發展及轉移過程中發揮著極其重要的作用,其中以CXCL12/CXCR4反應軸研究較為突出。CXCL12與CXCR4結合能促進癌細胞遷移、侵襲、黏附、增殖以及腫瘤新生血管生成,介導乳腺癌、前列腺癌等惡性腫瘤靶向轉移。近來發現,新受體CXCR7可與趨化因子 CXCL12、CXCL11高親和力結合,從而使得CXCL12只能與CXCR4這個惟一受體結合而發揮生物學效應的觀點發生改變。已有研究表明,本研究中,觀察組CXCR7陽性表達率明顯高于對照組(P<0.05),提示CXCR7在胃癌發生發展過程中起著重要作用。
CXCR7 在多種腫瘤細胞[3~9]中參與了腫瘤的黏附、侵襲及轉移等重要過程,然而對于不同類型的腫瘤,研究結果存在差異[10~12]。在乳腺癌的研究中發現,CXCR7和CXCR4都能夠促進乳腺癌的遠處轉移,但是CXCR4在乳腺的浸潤和轉移中起主要作用;CXCR7主要刺激VEGF的表達及微血管生長,進而促進原始腫瘤的生長[13]。本研究觀察組中,腫塊直徑≥5 cm、腸型胃癌、浸潤深度達T3~T4層、臨床分期Ⅲ~Ⅳ期者CXCR7陽性表達率明顯升高(P均<0.05)。提示在胃癌中,CXCR7的高表達可能促進原始腫瘤的生長及遠處轉移。以往認為,彌漫型胃癌更容易發生轉移,其侵襲性更強。但本研究中腸型患者CXCR7表達卻明顯高于彌漫型,這一結論是否準確以及其相關機制,仍有待進一步證實。
惡性腫瘤細胞在腫瘤宿主微環境的誘導下迅速生長,通過產生和分泌細胞因子而刺激血管和間質增生,逐步導致腫瘤細胞增殖和侵襲。Orimo等[14]研究表明,從人乳腺癌中分離的腫瘤相關性成纖維細胞較從同一患者正常乳腺部位分離的成纖維細胞能顯著地促進乳腺腫瘤細胞的生長,原因是其分泌CXCL12與受體結合而刺激腫瘤細胞生長。本研究中,觀察組CXCR7在間質纖維母細胞的陽性表達率明顯高于對照組,說明在胃癌組織中的成纖維細胞分泌SDF-1與受體CXCR7結合刺激腫瘤細胞的生長,而不是與CXCR4結合發揮作用。同時本研究發現,觀察組血管內皮的陽性表達率明顯升高,提示CXCR7在胃腺癌中具有促進新生瘤性血管發生的作用。Miao等[3]通過免疫組化法檢測發現,97%的人類乳腺癌血管內皮細胞中CXCR7表達為強陽性,而在正常乳腺組織血管內皮細胞中幾乎檢測不到,與本研究結果一致。
因此,胃癌組織中CXCR7表達升高,并促進腫瘤微環境中間質纖維母細胞和血管內皮的生成,營造腫瘤生長和轉移的微環境;同時,檢測胃癌組織中CXCR7的表達有助于判斷病情與預后。然而,關于CXCR7在胃癌中轉移的作用機制及其信號通路,則有待進一步研究。
[1]Salmaggi A,Maderna E,Calatozzolo C,et al.CXCL12,CXCR4 and CXCR7 Expression in brain metastases[J].Cancer Biol Ther,2009,8(17):1608-1614.
[2]Yao X,Zhou L,Han S,et al.High expression of CXCR4 and CXCR7 predicts poor survival in gallbladder cancer[J].J Int Med Res,2011,39(4):1253-1264.
[3]Miao Z,Luker KE,Summers BC,et al.CXCR7(RDC1)promotes breast and lung tumor growth in vivo and is expressed on tumor-associated vasculature[J].Proc Natl Acad Sci U S A,2007,104(40):15735-15740.
[4]Iwakiri S,Mino N,Takahashi T,et al.Higher expression of chemokine receptor CXCR7 is linked to early and metastatic recurrence in pathological stage I nonsmall cell lung cancer[J].Cancer,2009,115(11):2580-2593.
[5]Wang J,Shiozawa Y,Wang J,et al.The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer[J].J Biol Chem,2008,283(7):4283-4294.
[6]Hattermann K,Held-Feindt J,Lucius R,et al.The chemokine receptor CXCR7 is highly expressed in human glioma cells and mediates antiapoptotic effects[J]. Cancer Res,2010,70(8):3299-3308.
[7]Burns JM,Summers BC,Wang Y,et al.A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival,cell adhesion,and tumor development[J].J Exp Med,2006,203(9):2201-2213.
[8]Balabanian K,Lagane B,Infantino S,et al.The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J].J Biol Chem,2005,280(42):357-360.
[9]Meijer J,Ogink J,Roos E.Effect of the chemokine receptor CXCR7 on proliferation of carcinoma cells in vitro and in vivo[J].Br J Cancer,2008,99(9):1493-1501.
[10]Zheng K,Li HY,Su XL,et al.Chemokine receptor CXCR7 regulates the invasion,angiogenesis and tumor growth of human hepatocellular carcinoma cells[J].J Exp Clin Cancer Res,2010,29(1):31.
[11]Ma M,Ye JY,Deng R,et al.Mesenchymal stromal cells may enhance metastasis of neuroblastoma via SDF-1/CXCR4 and SDF-1/CXCR7 signaling[J].Cancer Letters,2011,312(1):1-10.
[12]Liang JJ,Zhu S,Bruggeman R,et al.High levels of expression of human stromal cell-derived factor-1 are associated with worse prognosis in patients with stageⅡpancreatic ductal adenocarcinoma[J].Cancer Epidemiol Biomarkers Prev,2010,19(10):2598-2604.
[13]Hernandez L,Magalhaes MA,Coniglio SJ,et al.Opposing roles of CXCR4 and CXCR7 in breast cancer metastasis[J].Breast Cancer Res,2011,13(6):3151-3161.
[14]Orimo A,Gupta PB,Sgroi DC,et al.Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion[J].Cell,2005,121(3):335-348.

