PPARγ受體在大鼠缺氧性腎小管上皮細胞損傷中的表達及意義
蔣 玲,李正一,周志強,陳秀萍,雷鳳英,覃遠漢
(廣西醫科大學第一附屬醫院,南寧 530021)
過氧化物酶體增殖物激活受體(PPARs)屬于配體激活的核細胞受體超家族,為Ⅱ型核激素受體超家族成員,有 α、β、γ 三種亞型[1]。在腎臟內,PPARγ參與正常腎臟的發育、脂質代謝,具有調節水鹽重吸收、調控腎血流量并激活腎素—血管緊張素系統等生理功能[2,3]。目前,在單側輸尿管梗阻(UUO)大鼠模型中發現,PPARγ具有抗腎間質纖維化(RIF)作用[4]。然而PPARγ在體外培養的缺氧性腎小管上皮細胞(RTEC)中的表達及作用尚不清楚。2012年12月~2013年6月,為探討PPARγ在缺氧性RTEC損傷中的作用,我們進行了相關研究。現報告如下。
1 材料與方法
1.1 材料 大鼠缺氧性RTEC細胞株(NRK-52E)購自上海細胞庫;DMEM高糖培養基、超濾胎牛血清購自美國HyClone有限公司;羅格列酮(RGZ)、GW9662購自美國Sigma公司;二甲基亞砜購自索萊寶生物科技有限公司;其他均為常規儀器和試劑。
1.2 方法
1.2.1 模型制作及分組 將NRK-52E于37℃、5%CO2條件下置入含5%胎牛血清的DMEM高糖培養基中,待細胞生長至約80%融合時傳代。待傳代的細胞生長至對數期時,將細胞隨機分為4組:正常對照組、缺氧模型組、RGZ組及GW9662組。正常對照組常規培養,不予缺氧性損傷處理。缺氧模型組、RGZ組及GW9662組行缺氧性損傷處理[5],同時RGZ組給予15 μmol/L RGZ、GW9662組給予25 μmol/L GW9662處理。36 h后收集細胞行相關指標檢測。
1.2.2 PPARγ、TGF-β1mRNA 表達檢測 采用 RTPCR法。按照RNA提取試劑盒說明提取細胞總RNA,選取完整的mRNA,按反轉錄試劑盒要求進行反轉錄,β-actin為內參。PPARγ上游引物:5'-GATGACCACTCCCATTCCTTT-3',下 游 引 物:5'-CGCACTTTGGTATTCTTGGAG-3',片 段 長 度 156 bp。TGF-β1上 游 引 物:5'-CGCAATCTATGACAAAACCAAA-3',下 游 引 物:5'-TTCTACGTGTTGCTCCACAGTT-3',片段長度 154 bp。β-actin 上游引物:5'-CACCCGCGAGTACAACCTTC-3',下 游 引 物:5'-CCCATACCCACCATCACACC-3',片段長度 207 bp。反應體系為20 μL:2.5 ×Real MasterMix/SYBR solution 9.0 μL,PCR Forward Primer(10 μmol/L)0.4 μL,PCR Reverse Primer(10 μmol/L)0.4 μL,cDNA 1 μL,超純水9.2 μL。PCR 反應條件:PPARγ:95 ℃預變性 10 min,68 ℃變性15 s,62 ℃退火30 s,68 ℃延伸30 s,共進行40個循環;TGF-β1:95℃預變性10 min,68 ℃變性15 s,58 ℃退火30 s,68 ℃延伸30 s,共進行40個循環。每樣本重復3次。以正常對照組的基因表達量為 1,采用相對定量 2-ΔΔCT法[6]計算其余各組mRNA的相對表達量。變化倍數(Fold change)為缺氧模型組、RGZ組和GW9662組較正常對照組基因的相對表達倍數。
1.2.3 PPARγ、TGF-β1蛋白表達檢測 采用Western blot法。按常規方法提取NRK-52E的總蛋白,二喹啉甲酸蛋白定量試劑盒測定蛋白濃度。4℃、12 000 r/min離心后加入上樣緩沖液,煮沸變性后行Western blot檢測。以β-actin為內參,行10%十二烷基硫酸鈉—聚丙烯酰胺凝膠電泳、轉膜至聚偏二氟乙烯膜(PVDF)、封閉液室溫封閉1 h、一抗4℃孵育過夜、二抗常溫避光孵育1.5 h,最后掃描PVDF分析蛋白表達量。
1.2.4 統計學方法 采用 SPSS13.0統計軟件,數據以±s表示,比較采用單因素方差分析q檢驗(SNK法)。相關性分析采用直線相關分析。P≤0.05為差異有統計學意義。
2 結果
2.1 RTEC形態觀察 正常對照組RTEC形狀渾圓,細胞間隙清晰。缺氧模型組RTEC形狀變尖銳,出現萎縮,細胞間隙變寬加深,且寬度不一,細胞壁出現塌陷。與缺氧模型組比較,RGZ組RTEC萎縮減輕,細胞間隙變窄,細胞壁塌陷程度較輕;GW9662組RTEC萎縮加重,細胞間隙變寬。
2.2 各組 RTEC PPARγ、TGF-β1mRNA 表達比較見表1。
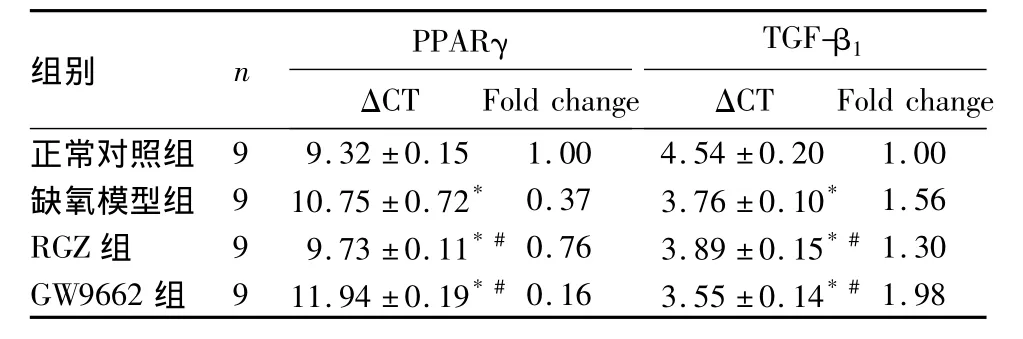
表1 各組RTEC PPARγ、TGF-β1mRNA表達比較
2.3 各組 RTEC PPARγ、TGF-β1蛋白表達比較見表2。
表2 各組 RTEC PPARγ、TGF-β1蛋白表達比較( ±s)
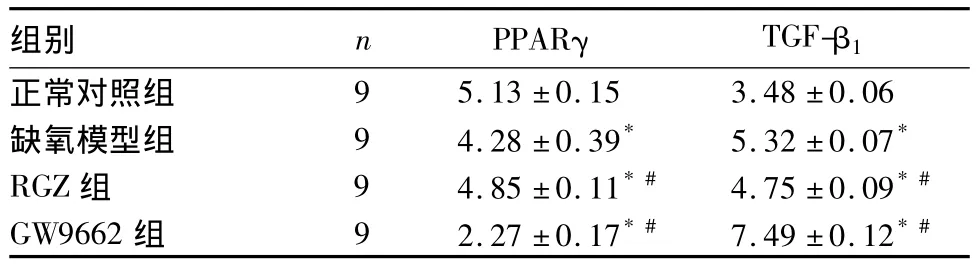
表2 各組 RTEC PPARγ、TGF-β1蛋白表達比較( ±s)
注:與正常對照組比較,*P <0.05;與缺氧模型組比較,#P <0.05
組別 n PPARγ TGF-β1正常對照組9 5.13 ±0.15 3.48 ±0.06缺氧模型組 9 4.28 ±0.39* 5.32 ±0.07*RGZ 組 9 4.85 ±0.11*# 4.75 ±0.09*#GW9662 組 9 2.27 ±0.17*# 7.49 ±0.12*#
2.4 缺氧性 RTEC 損傷中 PPARγ、TGF-β1蛋白表達的關系 缺氧性RTEC中PPARγ的蛋白表達與TGF-β1的蛋白表達呈負相關(r=-0.91,P<0.05)。
3 討論
RTEC損傷是指腎小管受到缺氧、炎性因子、蛋白尿等因素作用后,RTEC活化、增殖,炎性因子分泌增加,并導致上皮細胞轉分化(EMT)。而EMT是RIF的早期可逆性階段,也是終末期腎病的主要病理改變[7]。目前認為,EMT導致的腎間質細胞成纖維化和細胞外基質沉積是RIF發生的中心環節和關鍵因素。因此認為,RTEC損傷與RIF的發生、發展密切相關[8]。
TGF-β1是目前發現的作用最強的致腎纖維化的細胞因子,具有刺激細胞外基質積聚、誘導產生下游致纖維化因子的作用,最終加劇RIF[9]。缺氧可導致上皮細胞中 TGF-β1和 α-平滑肌動蛋白(α-SMA)表達上調,出現Ⅳ型膠原纖維和纖維連接蛋白沉積。Matsuoka等[10]對胃癌細胞缺氧處理24 h后發現,胃癌細胞中 TGF-β1表達明顯升高。Copple[11]對肝上皮細胞缺氧處理后發現,EMT相關基因(如成纖維細胞特異蛋白、α-SMA)表達升高。因此,TGF-β1可作為細胞缺氧性損傷的檢測指標。本課題組前期研究發現,在UUO大鼠模型中,腎臟組織TGF-β1表達明顯升高,梗阻時間越長,TGF-β1表達越高,腎臟損傷越嚴重[12]。本研究結果顯示,缺氧模型組、RGZ組和GW9662組RTEC出現細胞萎縮,細胞壁塌陷,細胞間隙變寬,細胞損傷程度較正常對照組重;TGF-β1的蛋白表達量明顯高于正常對照組,提示本研究模型制備成功。
PPARγ在脂肪組織、肝臟、腎臟、血管上皮等組織廣泛分布并參與細胞的增殖、分化和凋亡。研究發現,PPARγ激動劑有保護腎臟及其細胞損傷的作用。如Lin等[13]報道,激動PPARγ可抑制高糖誘導的大麻素1受體高表達,減輕腎小球系膜炎癥反應和纖維化;Wei等[14]研究發現,在 TGF-β1誘導的大鼠RTEC 轉分化模型中,RGZ 可抑制 TGF-β1、α-SMA的表達,抑制轉分化。這些均提示PPARγ信號通路參與抑制纖維化的過程。本研究結果顯示,在缺氧性RTEC損傷中,PPARγ蛋白表達明顯降低,TGF-β1蛋白表達明顯升高,PPARγ的蛋白表達與TGF-β1的蛋白表達呈負相關,提示PPARγ蛋白的低表達可能參與了缺氧性RTEC損傷;在受體激動劑RGZ干預之后,RGZ組RTEC損傷較缺氧模型組明顯減輕,PPARγ蛋白的表達水平較缺氧模型組明顯增高,TGF-β1蛋白表達水平明顯降低,提示RGZ可能通過上調PPARγ蛋白的表達起到減輕RTEC損傷的作用;GW9662是高選擇性的PPARγ抑制劑,本研究GW9662組RTEC損傷較缺氧模型組明顯加重,PPARγ蛋白的表達水平較缺氧模型組明顯降低,TGF-β1蛋白的表達水平明顯增高,提示GW9662可能通過下調PPARγ蛋白的表達而加重RTEC損傷。
綜上所述,在缺氧性RTEC損傷中,PPARγ蛋白的低表達可能參與了RTEC損傷;RGZ可能通過上調PPARγ蛋白的表達而減輕RTEC損傷。
[1]Ciudin A,Hernandez C,Simo R.Update on cardiovascular safety of PPARgamma agonists and relevance to medicinal chemistry and clinical pharmacology[J].Curr Top Med Chem,2012,12(6):585-604.
[2]Kiss-Toth E,Roszer T.PPARgamma in kidney physiology and pathophysiology[J].PPAR Res,2008,2008:183108.
[3]Todorov VT.PPARgamma-dependent control of renin expression:molecular mechanisms and pathophysiological relevance[J].PPAR Res,2013,2013:451016.
[4]何泳,寧勇,曾銳,等.羅格列酮延緩慢性腎病進展的機制研究[J].醫藥導報,2012,31(10):1257-1261.
[5]關欣,李應東.細胞缺氧復氧模型建立方法的研究進展[J].醫學綜述,2008,14(18):2737-2739.
[6]Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nat Protoc,2008,3(6):1101-1108.
[7]Farris AB,Colvin RB.Renal interstitial fibrosis:mechanisms and evaluation[J].Curr Opin Nephrol Hypertens,2012,21(3):289-300.
[8]Liu Y.Cellular and molecular mechanisms of renal fibrosis[J].Nat Rev Nephrol,2011,7(12):684-696.
[9]Kartha G,Calle JC,Marchini GS,et al.Impact of stone disease:chronic kidney disease and quality of life[J].Urol Clin North Am,2013,40(1):135-147.
[10]Matsuoka J,Yashiro M,Doi Y,et al.Hypoxia stimulates the EMT of gastric cancer cells through autocrine TGF beta signaling[J].Plos One,2013,8(5):e62310.
[11]Copple BL.Hypoxia stimulates hepatocyte epithelial to mesenchymal transition by hypoxia-inducible factor and transforming growth factorbeta-dependent mechanisms[J].Liver Int,2010,30(5):669-682.
[12]Long YB,Qin YH,Zhou TB,et al.Association of retinoic acid receptors with extracellular matrix accumulation in rats with renal interstitial fibrosis disease[J].Int J Mol Sci,2012,13(11):14073-14085.
[13]Lin CL,Hsu YC,Lee PH,et al.Cannabinoid receptor 1 disturbance of PPARgamma2 augments hyperglycemia induction of mesangial inflammation and fibrosis in renal glomeruli[J].J Mol Med(Berl),2014,92(7):779-792.
[14]Wei J,Li Z,Yuan F.Evodiamine might inhibit TGF-beta1-induced epithelial-mesenchymal transition in NRK52E cells via Smad and PPAR-gamma pathway[J].Cell Biol Int,2014,38(7):875-880.

