原發性肝細胞癌血管生成擬態觀察中PAS染色法的應用*
劉 彪,林麗琳,翁劍武,吳志峰,王 鳳,謝 群
莆田學院基礎醫學院人體解剖與組織胚胎學教研室 莆田351100
自從Maniotis 等[1]在對人眼葡萄膜黑色素瘤微循環的研究中發現并提出了血管生成擬態(vasculogenic mimicry,VM)之后,高侵襲性惡性腫瘤VM 成為研究熱點。VM 指瘤細胞圍繞形成的管狀結構,且管狀結構的內部伴有血漿和紅細胞,其對評價腫瘤療效和患者預后有重要價值[2]。VM 主要通過過碘酸-希夫(periodic acid-schiff staining,PAS)染色并結合CD34 等血管內皮特異性標記分子來確定。然而,PAS 染色過程中存在染色淺、層次不分明、假陽性等問題,給VM 的觀察與鑒別造成了困擾。作者在原發性肝細胞癌(hepatocellular carcinoma,HCC)VM 的研究中發現,組織切片厚度、孵育溫度、染色及閱片等環節對實驗結果的影響至關重要。為此,作者總結了相應的應對措施,為正確使用PAS 染色提供借鑒。
1 材料與方法
1.1 主要材料與試劑 采用莆田學院附屬醫院病理科保存完整的HCC 石蠟標本制作病理切片。PAS 試劑盒購自羅基(北京)生物技術有限公司;CD34 抗體、SP 染色試劑盒及DAB 試劑盒為福州邁新生物技術開發有限公司產品。
1.2 切片制備與CD34-PAS 雙染 標本在切片前置于-20℃冰箱中冷凍15~20 min,制備厚度分別為2 和3 μm 的切片。切片自然干燥后于65℃烤箱中烘烤120 min,常規脫蠟水化,抗原修復,用過氧化物酶阻斷山羊血清封閉后滴加CD34 抗體工作液,置濕盒于4℃孵育過夜,滴加二抗孵育20 min,DAB顯影,觀察到內皮細胞著色后終止顯色反應。將切片置于10 g/L 高碘酸(A 液)中氧化5 min,蒸餾水沖洗3次后加入Schiff 溶液(B 液)避光孵育15 min,流水沖洗10 min 后加入Little-Mayer 蘇木素(C液)染色4 min,蒸餾水浸洗后加入體積分數1%鹽酸乙醇(D 液),待組織顏色變紅立即終止分化,流水沖洗15 min 后用蒸餾水浸洗3次,逆濃度梯度乙醇脫水、二甲苯透明后用中性樹膠封片。
1.3 結果判定 鏡下CD34 染色陽性表現為血管內皮細胞呈棕褐色著色,PAS 染色陽性表現為管腔基底膜呈紫紅色著色。若觀察到由肝癌細胞呈梁狀排列構成的網狀血管通道,腔內可見紅細胞,血細胞與肝癌細胞之間有呈櫻桃紅色的PAS 陽性的基底膜樣結構,且CD34 陰性,即判定為VM;若管壁有CD34 陽性的內皮細胞和PAS 陽性結構,無論腔內有無紅細胞均判定為內皮細胞依賴性血管。
2 結果
2.1 內皮細胞依賴性血管的形態特點 HCC組織中肝血竇出現毛細血管化,內皮細胞CD34 陽性,內皮細胞下方也出現PAS 陽性的基底膜,說明HCC組織中存在CD34-PAS 雙陽性血管,判定為內皮細胞依賴性血管(圖1)。
2.2 VM 的形態特點 采用3 μm 厚的切片及上述優化的染色步驟進行CD34-PAS 雙染,VM 結構的PAS 染色顯色深淺合適,對比度強,鏡下辨析度高。HCC組織中VM 主要呈現兩種形態:由CD34 陰性的肝癌細胞構成擬態管腔,一層薄厚不均的PAS 陽性基底膜將腫瘤細胞和管腔內的紅細胞分開,這種稱為腫瘤細胞型VM(圖1C);若管腔主體結構是PAS 陽性的基底膜而不是腫瘤細胞,則稱之為細胞外基質型VM(圖1D)。但是如果采用2 μm 厚的切片,則PAS 胞漿染色結果呈淺粉偏白,細胞邊緣櫻桃紅色略明顯(圖1E),不利于鏡下觀察。
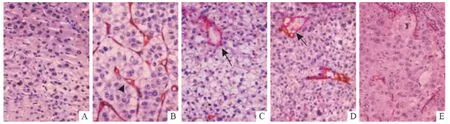
圖1 HCC組織中內皮細胞依賴性血管和VM 的形態(CD34-PAS 雙染法,×400)
2.3 容易與VM 混淆的病變結構的形態特點HCC組織中肝細胞常伴有透明細胞型及假腺樣結構等多種病變,易與VM 混淆。透明細胞型的肝癌細胞體積大,胞質可呈淡染細絲狀或透明空泡樣,PAS 染色亦呈陽性(圖2A);假腺樣結構可見癌細胞呈單層立方上皮樣圍成類似甲狀腺濾泡樣的結構(圖2B)。
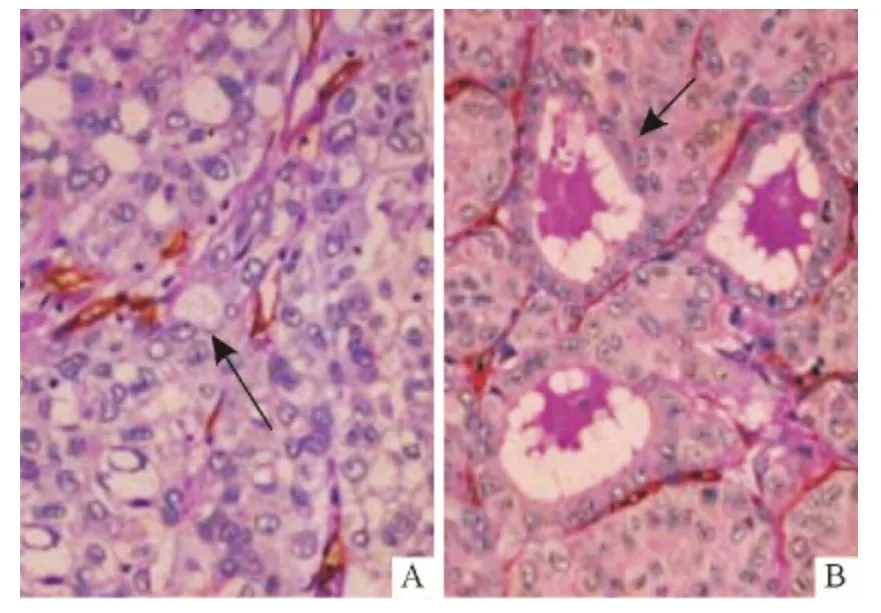
圖2 HCC 中其他病變結構的形態(CD34-PAS 雙染法,×400)
3 討論
近年來,腫瘤微循環研究中常應用CD34-PAS雙染法來判定內皮細胞依賴性血管和VM 等結構。作者應用此方法對HCC組織進行染色觀察,對應用過程中的注意事項進行了總結。
3.1 試劑的保存和使用 實驗中作者發現,Schiff試劑現配使用效果較佳,但配制步驟繁復,保存時間較短,一般采用PAS 試劑盒。即使將Schiff 試劑4℃避光保存仍易失效,故作者采用-20℃避光分裝保存,使用前恢復至室溫,避免反復凍融和開啟影響染色效果。正常的Schiff 試劑打開時有明顯氣味,反之則失效[3]。若失效,每10 mL 溶液中加入0.108 g偏重亞硫酸鈉仍可使用[4]。
3.2 切片制備 通常一個肝癌細胞的直徑約為6 μm,SP 法染色中一般采用2 μm 厚切片,以防止細胞重疊不利于鏡下觀察。但作者發現,2 μm 厚的切片PAS 胞質染色淺粉偏白,細胞邊緣櫻桃紅略明顯,不利于鏡下觀察,故在預實驗時采用同一組織塊的連續切片,對比了染色效果,最終發現3 μm 厚的切片染色效果較佳。
3.3 染色過程中的注意事項 作者發現,實驗室室溫直接影響PAS 染色效果。Schiff 試劑的最佳反應溫度在26℃以上,將冷凍的試劑取出后須避光恢復至室溫后方可使用。冬季則可將濕盒放置于調好溫度的恒溫箱里,既能保溫,又能避光。PAS 試劑盒中的A、B 液滴加到組織塊時會局限于組織塊邊緣,無法擴開,易造成邊緣淡染。雖然作為去垢劑的Tween-20 具有表面擴張力的作用,加入洗液中可擴開液面,但是作者發現Tween-20 會淡化陽性的櫻桃紅染色,故不建議使用。適當增加試劑用量,可使擴大的液滴緩慢覆蓋住組織邊緣,從而改善最終染色結果。
3.4 重視假陽性染色 PAS 染色過程易出現假陽性而造成誤判。過碘酸是一種強氧化劑,它能氧化糖類及有關物質中的1,2-乙二醇基或者多糖分子的去氫葡萄糖殘基,使之變為二醛,醛再與Schiff 試劑結合,形成一種紫紅色的品紅化合物。同時過碘酸還可將細胞內某些物質氧化,從而出現干擾性的假陽性染色。因此,使用過程中應注意選擇好過碘酸的濃度及氧化時間。作者發現,采用10 g/L 過碘酸進行染色并將時間控制在5 min,假陽性染色控制較好,超過10 min 則容易出現假陽性[5]。實驗中還應設置空白對照,即省去滴加Schiff 試劑這一步驟,可以驗證組織中是否有可見糖原,從而排除假陽性。
3.5 VM 結構的辨析 閱片并對VM 結構進行辨析是實驗的關鍵環節。判定腫瘤細胞型VM 的要點是管壁結構為肝癌細胞而非內皮細胞[6],一般HE染色病理學觀察即能確定,也可以進一步行Hepatocyte 染色確定是否為肝癌細胞。PAS 陽性的基底膜是重要的判定依據之一,但有時PAS 陽性物質可能會不連續[7]。透明細胞型病變結構易與VM 相混淆,但該結構的外周不會出現肝癌細胞環繞排列,且透明區域不會出現紅細胞;假腺樣結構在鏡下除類似甲狀腺濾泡樣的結構外,腔內常出現PAS 陽性的膽汁;上述特點可用于VM 與其他病變結構的區別。
[1]Maniotis AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739
[2]王玨,王莉,張健.不同組織中PAS 染色的特點[J].鄖陽醫學院學報,2009,28(5):505
[3]王媛,鄧鋒,肖詠麗,等.肝臟組織PAS 染色方法的探討[J].疾病預防控制通報,2012,27(1):5
[4]魏麗.介紹一種PAS 染色中Schiff 液失效后的重新利用方法[J].濟寧醫學院學報,2010,33(3):204
[5]李劍穎.高碘酸-希夫染色的應用體會[J].檢驗醫學與臨床,2009,6(6):456
[6]陳銀生,李聰,梅鑫,等.人腦膠質母細胞瘤微循環模式觀察[J].中國神經腫瘤雜志,2012,10(2):76
[7]趙秀蘭,杜靜,張詩武,等.肝細胞肝癌中血管生成擬態的研究[J].中華肝臟病雜志,2006,14(1):41

