從啤酒廢酵母中提取甘露聚糖的工藝條件優化
孔凌云 史詠華 吳 煒 邵 偉
(1.三峽大學生物與制藥學院,湖北 宜昌 443001;2.河南南街村集團技術中心,河南 臨穎 462600)
中國是釀酒大國,其發酵液及其酵母壁原料多,一般用作飼料或廢棄[1]。啤酒廢酵母是提取多種生化物質及生化藥物的寶貴資源[2]。酵母細胞壁主要由β-葡聚糖和甘露聚糖組成,甘露聚糖占酵母細胞壁干重的40%左右[3]。甘露聚糖具有增加動物體液免疫和細胞免疫能力,能調節腸道菌群平衡,選擇性吸附霉菌毒素,具有抗輻射、抗氧化、抗腫瘤,改善血清脂質,降低膽固醇含量,防止便秘,改善多種消化系統疾病等功能,是一種極具市場潛力的食品添加劑[4,5]。甘露聚糖目前在食品工業中作為膠凝劑、增稠劑和保水劑而被廣泛應用[6]。采用全細胞制備酵母多糖的傳統方法具有酸堿用量大、回收成本高,容易破壞多糖結構等缺點[7-10],不利于工業化大規模生產。目前,以啤酒廢酵母為原料提取甘露聚糖的工藝存在用堿量過多、收率低、成本高等方面的不足。因此,優化與改進現有工藝條件就顯得尤為重要。為此,本研究擬采用正交試驗方法,以甘露聚糖得率為評價指標,以自溶后的酵母細胞壁為原料,優化建立甘露聚糖提取工藝,以期提高提取率、減輕后期的純化壓力,而且降低堿的用量,減少對多糖的降解,使其保持較高生理活性,以期為啤酒廢酵母甘露聚糖的規模化生產提供參考。
1 材料與方法
1.1 原料與試劑
新鮮啤酒酵母:由河南南街村集團南德啤酒廠提供;甘露糖標準品:純度≥99%,上海源葉生物科技有限公司;
其余試劑均為分析純。
1.2 儀器
電子天平:ALC-210.4型,北京賽多利斯儀器系統公司;
pH計:pHS-3C型,上海雷磁儀器廠;
高壓均質機:SRH60-70型,上海申鹿均質機有限公司;
立式壓力蒸汽滅菌器:YXQ-LS-30SII型,上海博迅實業實限有限公司;
離心機:TGL-20LM型,湖南星科科學儀器有限公司;
紫外-可見分光光度計:Varian Cary50型,美國瓦里安技術公司。
1.3 甘露聚糖提取方法
1.3.1 甘露聚糖提取工藝
啤酒廢酵母→預處理→自溶→均質→NaOH提取→脫蛋白→乙醇醇析→乙醚、丙酮洗滌→干燥→成品
1.3.2 操作要點
(1)啤酒廢酵母的預處理:按1∶1(V∶V)的比例將純凈水加入啤酒廢酵母泥中進行洗滌,并經100目篩子過篩,然后以3 000r/min離心10min,如此3次,以除去其中的酒花等雜質[11,12],收集洗凈的酵母泥。
(2)自溶:稱取一定量的酵母泥,按料水比1∶4(m∶m)的比例加入純凈水,制成酵母懸液,添加適量2%NaCl、p H 4.5的醋酸—醋酸鈉緩沖液,于45~50℃保溫攪拌自溶1 8h。
(3)均質:將自溶液以3 000r/min離心10min,得沉淀物,按料水比1∶3(m∶m)的比例加入純凈水,制成酵母細胞壁懸液,在40MPa條件下進行均質處理(均質進料溫度70℃),再以3 000r/min離心10min,得酵母細胞壁沉淀物。
(4)提取:稱取酵母細胞壁,添加不同質量濃度的NaOH配成不同的料液比,并在不同的溫度及時間下浸提,3 000r/min離心10min取上清液,用20%的醋酸溶液中和至pH 7.0,攪拌10min,離心取上清液。
(5)脫蛋白:將提取后獲得的含甘露聚糖的上清液中加入10%濃度的三氯乙酸溶液,調pH為3,4℃冰箱冷藏靜置過夜,離心脫蛋白。
(6)精制干燥:向脫蛋白后的溶液中加入2倍體積無水乙醇過夜,離心取沉淀物,分別用乙醚、丙酮洗滌,60℃干燥得甘露聚糖成品。
1.4 試驗方法
(1)料液比的影響:取2.5g酵母細胞壁各5份,添加3%的 NaOH分別制成料液比為1∶10,1∶12.5,1∶15,1∶17.5,1∶20(m∶V)的懸浮液于90℃浸提2h,測甘露聚糖含量。
(2)NaOH濃度的影響:取2.5g酵母細胞壁各5份,分別添加濃度為1%,2%,3%,4%,5%的NaOH配成料液比1∶15(m∶V)的懸浮液,90℃浸提2h,測甘露聚糖含量。
(3)浸提時間的影響:取2.5g酵母細胞壁各5份,添加濃度為3%的NaOH制成料液比為1∶15(m∶V)的懸浮液,于90℃分別浸提1.0,1.5,2.0,2.5,3.0h,測甘露聚糖含量。
(4)浸提溫度的影響:取2.5g酵母細胞壁各5份,添加濃度為3%的NaOH配成料液比為1∶15(m∶V)的懸浮液,分別于60,70,80,90,100℃下浸提2h,測甘露聚糖含量。
1.5 測定方法
(1)甘露聚糖含量的測定:參照文獻[13],以紫外分光光度法進行測定。
(2)樣品處理:稱取20mg左右的酵母甘露聚糖,碾磨溶解于2.5mL 72%H2SO4中,室溫放置3h,加蒸餾水使硫酸的最終濃度為4mol/L左右,然后100℃酸水解4h,取出冷卻至室溫,用 NaOH調pH至中性,再用0.2mol/L p H 7.0磷酸緩沖液定容至100mL。
(3)標準曲線的制作:參照文獻[13]的方法繪制標準曲線。
(4)樣品甘露聚糖濃度的測定:吸取0.2mL樣液,參照文獻[13]的方法于280nm測吸光值,求得△OD,以標準曲線計算甘露糖濃度,從而得出甘露聚糖濃度。
(5)甘露聚糖提取率的計算:

2 結果與討論
2.1 標準曲線的繪制
以甘露糖為標準樣品,紫外分光光度法測定其吸光度,繪制的甘露糖標準曲線見圖1。

圖1 甘露糖標準曲線Figure 1 Standard curve of mannose
標準曲線方程為y=0.001 5x-0.027 07(y為△OD,x為甘露糖質量濃度μg/mL),相關系數R2=0.996 3。
2.2 料液比對甘露聚糖提取率的影響
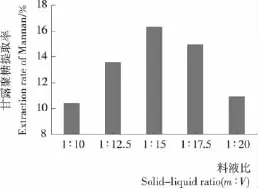
圖2 料液比對甘露聚糖提取率的影響Figure 2 Effects of different solid-liquid ratio on the extraction rate of mannan
由圖2可知,當料液比小于1∶15(m∶V)時,甘露聚糖提取率隨料液比的增加而增加;當料液比為1∶15(m∶V)時,甘露聚糖提取率最大,說明在料液比較低時,提取液尚未充分發揮作用,堿提不徹底;料液比高于1∶15(m∶V)時,提取液不足,影響提取效果。因此,以1∶15(m∶V)為提取甘露聚糖的較佳料液比。
2.3 NaOH濃度對甘露聚糖提取率的影響
由圖3可知,當NaOH添加量小于2%時,由于堿的水解,使可溶性的甘露聚糖溶出,低濃度堿對甘露聚糖的提取具有促進作用;當NaOH添加量大于2%時,提取出的甘露聚糖被高濃度的堿降解,而且堿濃度越大對甘露聚糖的破壞越厲害,損失也越大。故選擇質量濃度2%的NaOH作為提取啤酒廢酵母甘露聚糖的添加量。

圖3 NaOH濃度對甘露聚糖提取率的影響Figure 3 Effects of different concentration of NaOH on the extraction rate of mannan
2.4 浸提時間對甘露聚糖提取率的影響
由圖4可知,浸提時間小于1.5h時,NaOH發揮水解作用,使細胞壁上的甘露聚糖溶出,但由于時間較短,提取尚未結束,所以呈現上升趨勢;當浸提時間大于1.5h時,隨著堿提時間的延長,甘露聚糖降解,提取率降低。因此,選擇1.5h作為提取甘露聚糖的浸提時間。
2.5 浸提溫度對甘露聚糖提取率的影響
由圖5可知,浸提溫度不同,甘露聚糖提取率也不同。當溫度低于90℃時,甘露聚糖提取率隨溫度的升高呈上升趨勢,說明在溫度比較低的時候反應不徹底,堿提不充分;溫度高于9 0℃時,隨著溫度的繼續升高,堿提過程中溶出的甘露聚糖又會被降解,破壞多糖結構,使提取率呈現下降趨勢。因此,選擇9 0℃為提取甘露聚糖的浸提溫度。

圖4 浸提時間對甘露聚糖提取率的影響Figure 4 Effects of different time on the extraction rate of mannan

圖5 浸提溫度對甘露聚糖提取率的影響Figure 5 Effects of different rate of mannan
2.6 甘露聚糖提取工藝條件的優化
根據單因素試驗結果,選擇料液比、NaOH濃度、浸提時間、浸提溫度等因素進行考察,并以甘露聚糖提取率為考察指標,建立正交試驗因素水平表見表1,正交試驗結果與分析見表2。

表1 正交試驗因素水平表Table 1 The design of the head of table L9(34)

表2 L9(34)正交試驗結果與分析Table 2 L9(34)orthogonal array design arrangement and experimental results
由表2可知,影響甘露聚糖提取效果因素的主次順序為:D>A>C>B,通過極差分析可以確定甘露聚糖提取工藝的最佳條件為 A3B2C1D3,即料液比為1∶17.5(m∶V),NaOH濃度為2%,浸提時間為1.0h,浸提溫度為9 0℃。
對試驗結果進行方差分析,結果見表3。
表3 正交試驗方差分析結果Table 3 Analysis of variances for extraction yield of polysaccharides with various extraction conditions

表3 正交試驗方差分析結果Table 3 Analysis of variances for extraction yield of polysaccharides with various extraction conditions
* 差異顯著(P<0.05)。
來源 偏差平方和 自由度 F比 顯著性(α=0.05)A 24.084 2 0.973* 99.02 8 B 10.071 2 0.407 C 22.260 2 0.899 *D 42.605 2 1.721 *誤差
由表3可知,因素A、C和D在P<0.05的水平上有顯著性差異,因素B不顯著。
2.7 最佳提取條件的驗證
根據確定的甘露聚糖提取最佳工藝條件,對啤酒廢酵母進行甘露聚糖提取,做3次平行提取實驗,并對所提取的甘露聚糖進行含量測定,其甘露聚糖平均提取率可達到1 8.15%,低于表2中試驗8的18.88%的提取率,說明試驗中存在一定的試驗誤差、各因素間存在交互作用。
3 結論
本研究以啤酒廢酵母為原料,通過單因素試驗,考察了不同料液比、NaOH濃度、浸提時間、浸提溫度對酵母甘露聚糖提取效果的影響,并在此基礎上進行了L9(34)正交試驗,確定的最優工藝參數為料液比1∶17.5(m∶V),NaOH濃度2%,浸提時間1.0h,浸提溫度90℃。在此條件下制備甘露聚糖,所得甘露聚糖平均提取率為18.15%。由此可見,以自溶后的酵母細胞壁為試材提取甘露聚糖,不僅操作簡單、經濟廉價,而且減少了堿的用量,提高了提取率,這與梁新樂等[5]使用濃度6%的NaOH,甘露聚糖提取率6.63%相比,堿用量降低了4%,而提取率提高了3倍左右;與朱紅蕾等[8]使用濃度5%的NaOH,甘露聚糖提取率4.4%相比,堿用量降低了3%,提取率提高了4倍左右。該方法在操作上減少了堿的用量,提高了啤酒廢酵母甘露聚糖的提取率,可做為工業化生產酵母甘露聚糖的技術參考。
1 艾自明,任慧霞.釀酒酵母胞壁多糖研究概述[J].中南藥學,2009,7(10):762~765.
2 常雅寧,俞建瑛,袁勤生.啤酒廢酵母的綜合利用[J].微生物學雜志,2001(2):30~32.
3 杜丹.啤酒酵母泥中提取食用蛋白質及甘露聚糖條件的研究[D].沈陽:沈陽農業大學,2007.
4 劉媛媛.酵母細胞壁多糖制備及流變學性質研究[D].北京:中國農業科學院,2010.
5 梁新樂,王俊虎.紅法夫酵母甘露聚糖的提取[J].食品研究與開發,2012,33(7):60~64.
6 周韻,趙丹,辰巳英三,等.魔芋葡甘露聚糖在食品產業中的研究進展[J].食品與機械,2013,29(4):258~262.
7 汪文俊,劉玉蘭,肖靚,等.紅法夫酵母甘露聚糖的提取與鑒定[J].湖北農業科學,2008,47(5):584~586.
8 朱紅蕾,楊海龍.從廢棄畢赤酵母提取甘露聚糖的研究[J].溫州大學學報,2012,33(1):17~21.
9 周鮮嬌.海洋紅酵母中甘露聚糖的提取[J].中國釀造,2011,30(7):117~120.
10 吳小剛,吳周和,吳傳茂.啤酒酵母多糖提取工藝條件的研究[J].飼料工業,2006,27(9):27~29.
11 邵偉,樂超銀.利用啤酒廢酵母酶法制備蛋白肽工藝研究[J].中國釀造,2009,28(2):164~166.
12 蔣雪薇,羅曉明,劉永樂.啤酒廢酵母復合促溶劑促溶效果的研究[J].食品與機械,2003,19(2):15~17.
13 張運濤,谷文英.紫外分光光度法測定啤酒酵母中甘露糖[J].食品與發酵工業,1999,25(5):32~36.

