人巨細胞病毒核酸定量檢測試劑盒臨床應用及初步評價*
武警北京市總隊第三醫院檢驗科(北京100141)
王述蓮 鄧中平△ 呼建民 戴立忠△ 黃基容 王 軍△ 艾穎娟△
人類巨細胞病毒(Human cytomegalovirus,HCMV)亦稱細胞包涵體病毒,為皰疹病毒科β屬的雙螺旋DNA病毒,由于感染的細胞腫大,并具有巨大的核內包涵體,所以稱為巨細胞病毒。HCMV的感染途徑主要為接觸、輸血、宮內和產道等,感染較常見于胎兒、新生兒、孕婦等,孕婦感染可致新生兒先天畸形[1]。當機體免疫缺陷或免疫系統處于抑制狀態下,極易受HCMV感染,如器官移植后接受免疫抑制治療、惡性腫瘤化療后、艾滋病患者等,這些患者一旦感染,常致較高的病死率和嚴重的疾病[2]。
目前國內外已有基于實時熒光定量PCR技術定量檢測HCMV-DNA的試劑盒應用于臨床檢測中,但這些試劑盒多半以煮沸法提取核酸,且其檢測靈敏度不高,約在10000copies/ml左右;另外,這些試劑盒大多缺乏完善的質控體系,還需要進一步完善和提高技術水平,使此類產品更加滿足臨床準確診斷的需要。
最近,新出現了一種人巨細胞病毒核酸定量檢測試劑盒(PCR-熒光探針法),它完全免去了核酸提取中煮沸過程。根據其說明,HCMV核酸濃縮后經核酸釋放劑裂解,全部釋放參與到PCR反應中,整個過程無污染、操作極其簡單、迅速。本研究擬通過檢測臨床樣本,將其與市場上的煮沸試劑進行比對,來評估這一新方法準確性及特異性。
材料與方法
1 研究對象 本次研究共檢測血清樣本192例,其中男性97例(50.5%),女性95(49.5%),年齡0d至37歲,-20℃冰箱保存。
2 主要試劑和儀器 試劑購自湖南圣湘生物科技有限公司,采用濃縮一步法技術處理樣本(以下簡稱“新型試劑”或“濃縮一步法試劑”),具有內標監控假陰性,最低檢測限為400copies/ml;同時,選擇一種臨床使用較多的國產HCMV核酸檢測試劑,采用煮沸法提取樣本核酸,沒有內標監控,作為對照試劑,最低檢測限為1000copies/ml。核酸擴增儀采用美國Applied Biosystems公司的ABI7500實時熒光定量PCR儀。
3 方 法 采用兩種熒光定量PCR檢測試劑對192例臨床樣本(每例樣本一分為三,保留一份樣本作為復檢)進行檢測,方法如下:
煮沸法:取50μl臨床樣本,加入50μl DNA提取液充分混勻,100℃恒溫處理10min,12 000rpm 離心5min備用;取5μl作為PCR反應的模板,加入分裝有PCR反應液的反應管中上機檢測。
濃縮一步法:取100μl血清樣本,加入等體積的濃縮液,12 000rpm離心5min,棄上清,加入50μl核酸釋放劑,用槍頭挑起沉淀,吸打幾次,將沉淀打散混勻靜置10min作為待測樣本備用。在PCR反應管中加入10μl待檢樣本,吸打混勻,加入40μl PCR反應液,吸打混勻上機檢測即可。
4 統計學方法 數據進行一致性分析,靈敏度、特異度分析和Kappa檢驗一致性分析。
結 果
1 擴增曲線對比:兩種試劑對比檢測結果表明:濃縮一步法試劑檢測樣本擴增效率高,擴增曲線挺拔美觀,呈典型的“S”型;體系中含有內標,內標曲線整齊集中,可以很好的判斷檢測樣本中是否具有PCR抑制物,避免假陰性。
2 根據煮沸法試劑檢測結果將臨床樣本分為陽性組和陰性組,統計結果見表1。
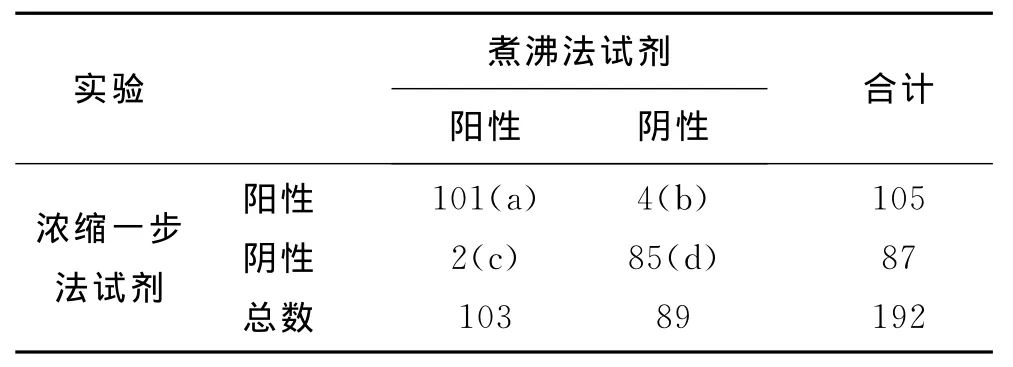
表1 煮沸法試劑與濃縮一步法試劑檢測結果統計表
3 濃縮一步法試劑與煮沸法試劑檢測結果的一致性分析:總一致性百分比符合率=(a+d)/(a+b+c+d)=(101+85)/192×100%=96.88%,用SPSS統計學軟件進行一致性檢驗,Kappa值等于0.973,說明兩方法高度一致。
4 濃縮一步法試劑與HCMV-pp65抗原結果的對比統計分析,見表2。
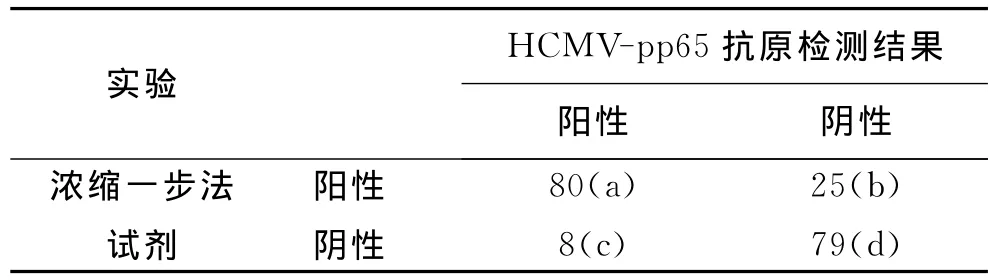
表2 濃縮一步法試劑的準確性評價
靈敏度Se=a/(a+c)×100%=80/(80+8)×100%=90.91%;特異度Sp=d/(b+d)×100%=79/(25+79)×100%=75.96%;靈敏度Se+特異度Sp=90.91%+75.96%=166.87%>100%。
5 煮沸法試劑與HCMV-pp65抗原結果的對比統計分析,見表3。
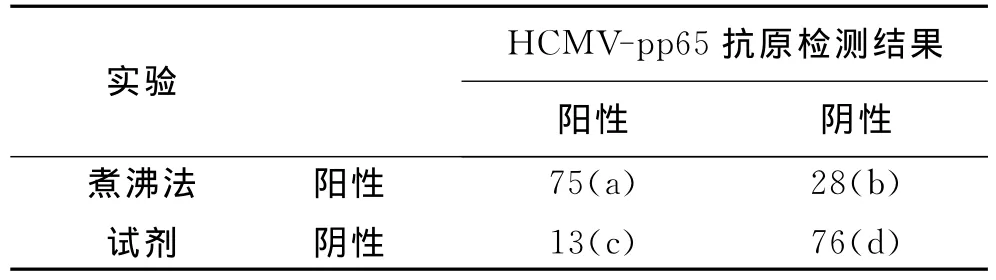
表3 煮沸法試劑的準確性評價
6 不符樣本的復核結果及其分析:根據結果,有6例樣本(樣本信息見表4)濃縮一步法試劑與煮沸法試劑檢測結果不符,其中4例(編號分別為:230814、231061、231128以及231952)煮沸法試劑檢測為陰性(檢測濃度處于400~1000copies/ml且樣本性狀相對復雜),而濃縮一步法試劑檢測為陽性(檢測濃度高于400copies/ml);另2例(編號為230949、231812)煮沸法試劑檢測為陽性,而濃縮一步法試劑檢測為陰性。在兩個試劑盒的靶基因擴增區域外圍序列,設計引物對,對這6例樣本進行PCR擴增,克隆測序復核,結果4例濃縮一步法試劑檢測為陽性的樣本測序結果均包含HCMV-DNA序列,可能其靈敏度較之煮沸法試劑更高或抗干擾能力更強;而煮沸法試劑檢測陽性的2例樣本無PCR擴增片段,懷疑為交叉污染所致。
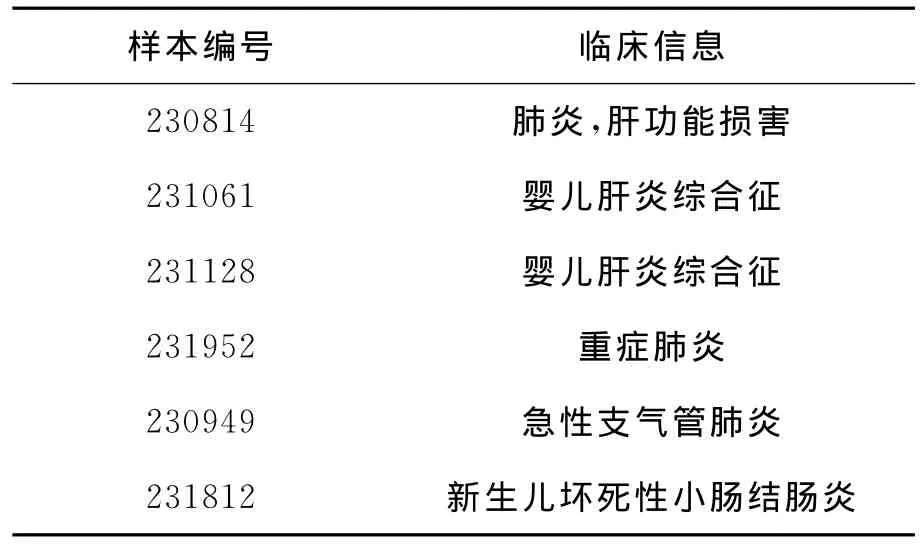
表4 6例不符樣本臨床信息表
應用Kappa評價方法對濃縮一步法試劑和煮沸法試劑檢測結果進行診斷一致性分析,檢驗水準為α=0.05。對Kappa值的參考評價原則如下:0.75<κ≤1時,診斷一致性好;0.4<κ≤0.75時,診斷一致性一般;0≤κ≤0.4時,診斷一致性差。經SPSS15.0軟件Kappa檢驗的輸出結果顯示,Kappa值=0.973,P=1.000。α=0.05檢驗水準下,濃縮一步法試劑與煮沸法試劑檢測結果的一致性有統計學意義,診斷一致性好。
討 論
HCMV感染常用的實驗室診斷方法有血清學檢查、抗原血癥檢測及基于PCR技術的檢測方法等。血清學方法很多,酶聯免疫吸附試驗是最常用的方法,有靈敏度高、特異性好和重復性好等長處,方法簡單,不需要特殊儀器,但該方法靈敏度明顯不如抗原血癥檢測,且不利于早期診斷。最常用于抗原血癥檢測的抗原為pp65,它是HCMV活動性感染的早期標志性產物,是目前監測HCMV活動性感染和指導抗病毒治療的重要方法,但是pp65抗原血癥檢測僅適合于血標本,且標本要求及時處理。PCR技術由于高靈敏度、高特異性、快速、簡便等優點,使其為人巨細胞病毒的檢測提供了又一新的途徑。定量PCR的出現,打破PCR只能定性的局面,其中熒光定量PCR以其高靈敏度、高特異性、低污染率、實時監測等特點,可為臨床提供更加準確、客觀的檢測結果,并及時地了解病情及預后[4]。目前國內臨床上主要采用煮沸法對人巨細胞病毒的核酸進行提取,具體是先將樣本高速離心,再加裂解液,煮沸,高速離心,取上清為模板。該方法核酸提取過程較復雜,樣本處理耗時長,且在處理樣本時,經過煮沸裂解、高速離心富集DNA等多個步驟,樣本中的DNA存在損耗,同時由于采用了水浴或金屬浴的高溫加熱步驟,容易造成氣溶膠污。
本研究對人巨細胞病毒熒光定量PCR檢測方法與常規的煮沸法進行對比研究。整個臨床試驗過程均在嚴格控制下進行,由經專門培訓的測試人員進行檢測分析。用濃縮一步法檢測,處理簡單,無需加熱,可大大減少污染的發生,擴增和熒光檢測均由儀器自動進行,通過查看樣本的Ct值判斷陰陽性。
本次研究共檢測樣本192例,根據煮沸法試劑檢測結果分為兩組:其中陽性組103例,陰性組89例。新型人巨細胞病毒核酸檢測試劑與煮沸法試劑的陽性一致性百分比98.06%,陰性一致性百分比95.51%,總一致性百分比96.88%;對6例不符樣本的復核結果表明:6例樣本的測序結果均與新型試劑相符。對復核后的結果進行Kappa檢驗一致性分析:結果Kappa值=0.973,表明新型試劑與煮沸法試劑及復核檢測的結果具有很好的一致性。在與HCMV-pp65抗原檢測結果的對比中,兩種試劑均表現出較好的準確性。
整個品評過程發現,濃縮一步法的樣本處理和檢驗過程在一個離心管和一個PCR反應管中即可完成,樣本中的核酸在濃縮液和核酸釋放劑的作用下釋放并參與到PCR反應過程中,只需一次離心,無需加熱,抗污染能力強,操作過程簡單,實驗結果的重復性大大提高,對操作人員的技術要求較低。濃縮一步法還可以節省檢驗時間,可以讓臨床醫生及患者及早得到診斷結果,避免等待試驗結果的焦慮。從兩種試劑的擴增曲線來看濃縮一步法試劑檢測樣本擴增效率高,擴增曲線平滑、挺拔美觀,呈典型的“S”型;體系中含有內標,內標曲線整齊集中,曲線優美。
通過本次對比品評可以看出,濃縮一步法擴增檢測方法操作極其簡單,減少污染環節,有內標監控假陰性,結果準確,比已上市的煮沸法試劑具更好的靈敏度和準確性,具有較高的臨床應用價值。
[1] Syggelou A,Iacovidou N,Kloudas S,etal.Congenital cytomegalovirus infection[J].Ann N Y Acad Sci,2010,1205(2):144-147.
[2] Tania Crough,Rajiv Khanna.Immunobiology of human cytomegalovirus:From bench to bedside[J].Clinical Microbiology Reviews,2009,22(1):76–98.
[3] 舒焰紅,趙 楊.活動性人巨細胞病毒感染的病毒基因表達特點[J].實用醫學雜志,2009,25(24):4113-4115
[4] Revello MG,Gorini G,Gerna G.Clinical evaluation of a chemiluminescence immunoassay for determination of immunoglobulin g avidity to human cytomegalovirus[J].Clin Diagn Lab Immunol,2004,11(4):801-805.

