紅色諾卡氏菌細胞壁骨架多糖成分的分離純化
林清強,石穎嵐,李 瓊,蔡 釩,王正朝
(福建師范大學 生命科學學院,福建 福州 350108)
紅色諾卡氏菌 (Nocardiarubra)是一種放線菌,是目前所發現具有最強細胞毒活性和免疫促進作用的一種微生物.因為一方面紅色諾卡氏菌具有最強細胞毒活性,說明這種微生物對腫瘤細胞有最強的毒性,可以直接殺滅腫瘤細胞;另一方面具有免疫促進作用,說明這種微生物可以調節并增強機體的免疫力.研究表明[1]:紅色諾卡氏菌細胞壁骨架(以下簡稱N—CWS),在增強體內巨噬細胞、T細胞和自然殺傷細胞的活性的同時,還能誘導機體產生LAK細胞等,產生抗癌作用,有效地抑制腫瘤生長.所以N-CWS已經成為治療腫瘤的有效制劑.它具有提高機體內T輔助性細胞和殺傷細胞的功能,增強巨噬細胞和自然殺傷細胞的免疫活性,抑制腫瘤和增強免疫能力的功效.其主要有效成分為[2]霉菌酸,阿拉伯半乳糖,粘肽.由于N-CWS的組成復雜,使用過程仍然存在一定的副作用,其起主要作用的物質不明確,影響了后續對其作用機制和藥用開發.而有關N-CWS的多糖成分分離純化的報道較少,本文研究了N-CWS的多糖成分的提取及分離純化,為進一步分析該產品中多糖的成分和結構提供參考,為新藥的開發與制備提供基礎數據.
1 材料與方法
1.1 實驗材料及儀器
1.1.1 主要材料和試劑:
紅色諾卡氏菌 (由本實驗自行培養傳代提供);SephadexG-100(為Pharmacia公司產品);葡萄糖(廣東汕頭西隴化工廠產品,AR);苯酚(廣東汕頭西隴化工廠產品,AR);硫酸(廣東汕頭西隴化工廠產品,AR);阿拉伯糖(廣東汕頭西隴化工廠產品,AR);其他生化試劑均為分析純.
1.1.2 主要儀器
可見分光光度計(V-1100型,上海美譜達儀器有限公司);電子天平(AL104,梅特勒-托利多儀器有限公司);電熱恒溫振蕩水槽;微量離心機(TG16-W型);電熱鼓風干燥箱(101-2型,上海陽光實驗儀器有限公司);BT1-100恒流泵(上海琪特分析器有限公司);BSZ-100A自動部分收集器(上海琪特分析器有限公司);凝膠層析柱(1.7㎝×20.5㎝為Pharmacia公司產品);TGL-16M高速臺式冷凍離心機.
1.2 實驗方法
1.2.1 紅色諾卡氏菌細胞壁骨架的制備
紅色諾卡氏菌經菌體培養,菌體破碎,蛋白酶處理,脫色及有機溶媒處理后即可獲得白色的紅色諾卡氏菌細胞壁骨架制劑[3].
1.2.2 多糖PS的提取
800 ugN-CWS樣品加入0.1mol/LHCl溶液酸解[4],放于60℃的電熱箱內孵育12h.16000r/min離心15min 后收集上清液并濃縮,加3倍體積的無水乙醇,混勻后靜置過夜使多糖充分沉淀,離心收集PS沉淀.
1.2.3 標準曲線的制備[5]
準確稱取標準阿拉伯糖50mg于500mL容量瓶中,加蒸餾水至刻度.分別吸取0、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0mL阿拉伯糖溶液,各以水補至2.0mL,然后加入6%的苯酚溶液1.0mL,再加入濃硫酸5.0mL,迅速震蕩搖勻,置于25℃水浴30min,取出于490nm測光密度值,以2.0mL蒸餾水為空白對照,以阿拉伯糖微克數為橫座標,光密度值為縱坐標,繪制標準曲線.
1.2.4 樣品溶液的制備和含糖量的測定
將樣品加水至1.0mL,用移液器吸取樣品液100μL并補水至2.0mL,然后加入6%的苯酚溶液1.0mL,再加入濃硫酸5.0mL,迅速震蕩搖勻,置于25℃水浴30min,取出用V-1100型分光光度計于490nm測光密度值,以標準曲線計算其多糖含量.多糖得率計算:多糖得率=(多糖質量/樣品質量)X100%.
1.2.5 Sephadex G-100凝膠柱層析
裝柱:稱取5克Sephadex G-100,加入50ml去離子水,浸泡溶脹過夜.[6]將懸浮細顆粒,隨上層液體傾去之后,加入等體積的1.0mol/LNaOH浸泡并間歇攪拌2h傾去,用蒸餾水洗滌至中性,用1.0mol/L HCl溶液浸泡1h,用蒸餾水洗至中性,再用1.0mol/L NaOH溶液浸泡2h.最后用蒸餾水洗至pH中性,備用.采用上述處理過的Sephadex G-100凝膠裝柱.裝柱過程需將凝膠緩慢加入,不能出現斷層,紋路和氣泡,必須均勻,否則要重新裝柱.柱裝好后用3-5倍體積的緩沖液平衡層析柱,保持流速1.0ml/min,直至流出液與上柱緩沖液完全相同.
上樣:用移液器取樣品280μL,用玻棒引流沿管壁緩緩加入到凝膠床面上.樣品全部加入后,加入0.05mol/L pH=7.0 Tris-HCl洗脫液,小心清洗凝膠床界面表面,使黏附著的樣品全部洗入凝膠床,直到液面高出凝膠床面2-3cm.
洗脫:用0.05 mol/L pH=7.0 Tris-HCl緩沖液洗脫,調節好恒流泵的流速1.0ml/min,開始收集.每1min管收集1管,收集120管.用苯酚-硫酸法進行跟蹤測定多糖,以洗脫管數為橫坐標,吸光值為縱坐標繪制洗脫曲線作圖.
2 結果與分析
2.1 樣品PS含量測定
2.1.1 標準曲線的制備
以苯酚-硫酸[7]為顯色劑,用比色法測定多糖含量.多糖類成分在濃硫酸作用下,先水解成單糖,單糖迅速脫水生成糠醛衍生物,糠醛與苯酚直接結合生成橙紅色衍生物,該衍生物在490nm處出現最大吸收值,記錄數據如表1,其吸收值與糖質量濃度呈線性關系.繪制標準曲線如圖1,樣品測定以標準曲線,計算多糖含量.
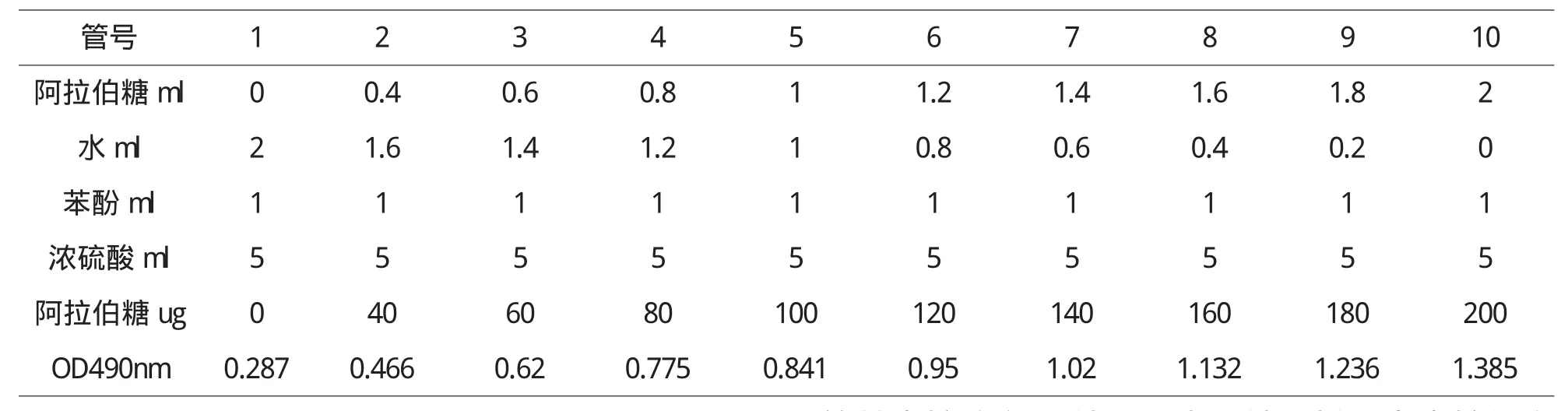
表1 阿拉伯糖標準曲線的制備
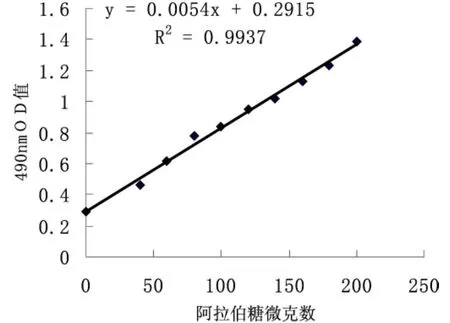
圖1 阿拉伯糖標準曲線
2.1.2 樣品的測定
取多糖樣品800ug,精密稱定,置1mL離心管中,加水稀釋至刻度,搖勻.提取前和提取后各精密量取樣品溶液100μL,照標準曲線制備項下的方法,制備樣品供試液.以阿拉伯糖為標準,用苯酚-硫酸法,在490nm波長處測定OD值,以標準曲線計算其多糖總含量.結果見表2,結果樣品中多糖得率以阿拉伯糖含量計算.根據標準曲線如圖1,計算樣品多糖含量.為了消除單糖對測定的影響,本法在測定之前先用無水乙醇進行沉淀處理,實驗表明,根據標準曲線,求出總糖量為16.15%.用鹽酸解離后經沉淀處理后,提取的多糖含量5.12%.結果如表2,表明還有大部分多糖還未被鹽酸解離,提取出來的多糖占總糖的31.7%.
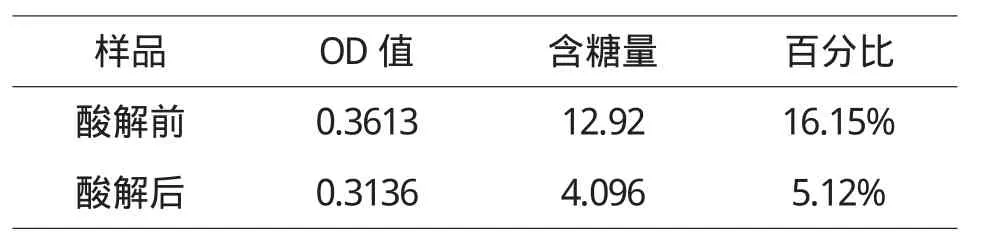
表2 多糖含量測定
2.2 Sephadex G-100凝膠柱層析分離
將提取的粗多糖溶液Sephadex G-100凝膠柱層析,上樣體積為280μL,洗脫曲線如圖2所示.從圖2可以看出.粗多糖經凝膠柱層析洗脫可以得到8個峰.結果發現經Sephadex G一100的洗脫曲線峰太多,而且峰較密集,說明樣品中粗多糖成分復雜.因此洗脫柱填充材料和洗脫條件有待進一步研究.
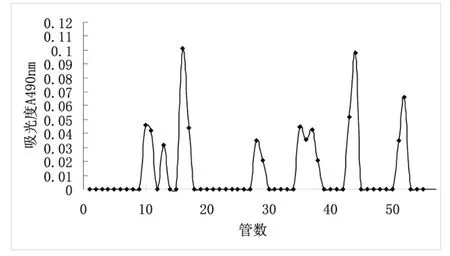
圖2 Sephadex G一100凝膠過濾柱層析洗脫曲線
從洗脫曲線上看,從10管到18管中出現的三個洗脫峰都比較密集說明有可能是分子量相近的多糖,35到38管出現兩個相連的洗脫峰分離效果較差表明這也是相似的多糖成分.從圖2來看,提取出來多糖的成分較為復雜,除了主要的阿拉伯糖和半乳糖之外還有其他的多糖.影響洗脫效果的因素主要有:凝膠孔徑,洗脫速度,洗脫濃度,柱長等.由于乙醇沉淀下來的多糖樣品一般含有少量的肽聚糖,類脂,蛋白質等雜質.總之用Sephdex G-100純化的效果不是十分明顯,為了能夠對其生物學活性和作用機制進行后續研究,對該樣品進行純度鑒定,分子量測定和組分分析等實驗.
3 討論
3.1 苯酚硫酸法測定
關于苯酚-硫酸法測定多糖含量原理是多糖在濃硫酸的作用下,先水解為單糖,迅速脫水形成糠醛衍生物,然后與苯酚縮合為有色化合物,在490nm處有特征吸收值.
根據已有文獻的報道[8-10],該實驗方法有所差異,主要區別在于是否加熱,關鍵操作為硫酸的添加方式,應將濃硫酸垂直加入試管中,而不應沿管壁加入,否則將會造成一定的誤差.因為反應所需的溫度可以通過快速加入濃硫酸產生熱量達到,從而使多糖顯色充分.采用苯酚-硫酸法測定多糖含量時,不同單糖顯色產物之間的最大吸收波長與吸收值有所不同.因此,選擇合適物質配制標準曲線也是實驗的關鍵.在現有的文獻報道中,該多糖的測定均以葡萄糖為標準.而結構分析表明N-CWS多糖的主要組成單糖是阿拉伯糖和半乳糖[5].阿拉伯糖和葡萄糖與N-CWS多糖的苯酚-硫酸法顯色產物的吸收光譜特征相比較,表明N-CWS多糖的吸收光譜與阿拉伯糖基本一致,而與葡萄糖有所差異.因此,實驗采用阿拉伯糖配制標準溶液測定N-CWS多糖,測定結果能比葡萄糖更準確地反映其含量.
3.2 N-CWS中PS的提取方法
根據已有的文獻關于N-CWS中PS提取的報道較少,除了用鹽酸浸提多糖,酸解樣品使多糖和類脂,肽聚糖,脂肪酸,蛋白質等物質的化學鍵斷裂,還可以使用甲酰胺和容菌酶將細胞壁中的多糖解離出來,但是后兩者反應激烈會將多糖水解成單糖,影響多糖生物學活性的后續研究.經過本實驗,表明用鹽酸浸提的方法簡單方便,對多糖的化學鍵沒有造成斷裂,保持其生物學性質以便進一步研究分析作用機制.
〔1〕王燕.諾卡菌細胞壁骨架N—CWS在治療癌性胸水中的應用[J].中國醫學理論與實踐,2003(6):749-751.
〔2〕阮繼生,劉志恒,梁麗糯,等.放線菌研究及應用[M].北京:科學出版社,1990.19—20.
〔3〕張祝蘭,林善,唐文力,等.胞必佳制造工藝的改進[J].海峽藥學,2001,13(2):90-92.
〔4〕蔡晶晶,張少華,吳梧桐,等.N-CWS多糖的促進小鼠脾淋巴細胞增殖作用[J].中國天然藥物,2007,5(6):435-437.
〔5〕寧惠青.苯酚硫酸法測定靈芝多糖的研究[J].太原師范學院學報,2006,5(1):105-107.
〔6〕羅顯仲,陶美華,廖毅俊,等.仙人掌莖多糖的分離純化[J].湛江師范學院學報,2004,25(6):32-36.
〔7〕劉瑩,戴玉杰,張黎明,等.穿山龍多糖分離純化工藝的研究 [J].天津科技大學學報,2007,22(4):27-30.
〔8〕王寶珍,張天斌,馬冰如.黑蔓粗多糖的總糖含量測定研究 [J].白求恩醫科大學學報,1995,21(3):275-276.
〔9〕劉友平,李祖倫,陳紅,等.分光光度法測定川牛膝中多糖含量 [J]成都中醫藥大學學報,1997,20(4):49-50.
〔10〕鄧俊林,許平,王志勇.茶葉多糖的分離純化及分析[J].重慶師范學院學報,1998,15(2):35.
〔11〕葉龍祥,劉清斌.真菌多糖的研究進展[J].農產品加工學刊,2007(5):26-28.
〔12〕夏瑋,呂慶,張文清,等.桑葉多糖 SDS-1和SDT-1的系統分離純化 [J].華東理工大學學報,2007(5):680-682.

