響應面法優化蕨麻多糖的提取工藝
高丹丹,楊璐璐,祁高展
西北民族大學生命科學與工程學院,蘭州 730030
蕨麻是鵝絨委陵菜(Potentilla anserina L)的原變種,屬于薔薇科(Rosacrae)委陵菜屬(Potentilla)。我國主要分布東北、華北、西北及西南等地。甘肅主產于甘南藏族自治區,其中以夏河、卓尼、臨潭三縣所產的蕨麻享譽最高。蕨麻無論是葉片還是地下部分的塊根都含有多種生物活性物質,都可以被廣泛的應用于醫藥、食品、飼料、皮革等行業[1]。白術杰、吳莉莉[2]等人的研究表明蕨麻多糖具有抗氧化作用、抗缺氧作用、補血作用、抗疲勞作用、降低血脂、抗乙型肝炎病毒活性、增強免疫等作用,在食品保健和臨床上具有極大的發展前景[3]。隨著社會的進步,人們已經開始致力于對蕨麻保健功能的研究,蕨麻多糖的提取已經引起了人們的注意。目前為止,對于多糖的提取其方法有:熱水提取法、酸提法、堿提法、酶提法、微波[4]和超聲波[5]輔助提取法等。
近幾年來對于蕨麻多糖提取方法的工藝優化都是在單因素或正交試驗條件下獲得的。響應面法,是利用響應面法擬合的回歸方程模型和繪制的響應面及等高線,從而得出最優工藝參數[6]。確定響應面實驗設計因素和水平的方法有很多種,本研究是在單因素試驗的基礎上,采用Box-Behnken 中心組合試驗設計原理來分析不同提取條件對蕨麻多糖提取率的影響,優化多糖提取過程中的關鍵參數,為以后對蕨麻多糖更深一步的研究提供理論參考。
1 材料與方法
1.1 材料與試劑
蕨麻,產于甘肅甘南地區,購于蘭州市國芳綜超;95%乙醇,濟南市歷城區遠拓化工;苯酚,天津市福晨化學藥劑廠;濃硫酸,武漢市新興永發化工有限公司;乙醚,廣東省廣州市嘉俊;丙酮,南昌市西湖區龍玉化工;葡萄糖,濟南嘉裕化工有限公司
1.2 儀器與設備
FZ102 微型植物試樣粉碎機(北京科偉永興儀器有限公司);JA2003N 電子天平;HHS1-NI 電熱恒溫水浴鍋(北京長安科學-儀器廠);TG16-WS 臺式高速離心機(湘儀離心機儀器有限公司);722E 可見分光光度計(上海光譜儀器有限公司)
2 實驗方法
2.1 蕨麻粗多糖的提取
將蕨麻用微型植物粉碎機粉碎,過50 目篩,篩下物放-20 ℃保存備用。稱取2 g 蕨麻粉加入一定體積的水放入恒溫水浴鍋中水浴浸提一定時間后取出,冷卻至室溫,裝入離心管中,于5000 rpm 離心20 min 后取上清液測定多糖含量,棄去沉淀物。在上清液中加入3 倍體積的95%的乙醇沉淀[7],于4 ℃冰箱中醇沉12 h 后離心[8],沉淀用丙酮、乙醚進行多次沖洗,冷凍干燥,得蕨麻粗多糖。
2.2 蕨麻多糖含量的測定(苯酚—濃硫酸法[9])
2.2.1 葡萄糖標準曲線的繪制
精確稱取105 ℃下干燥至恒重的葡萄糖約100.0 mg,定容至100 mL 的容量瓶中,搖勻,再吸取10 mL 上述溶液,加水定容至100 mL 容量瓶中,既得100 μg/mL 的葡萄糖標準溶液。精確吸取葡萄糖標準溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL,分別置于比色管中,各加蒸餾水補至2.0 mL,然后分別加入6%苯酚1 mL,搖勻,迅速加入濃硫酸5 mL,搖勻,室溫靜置20 min。于490 nm 處測定其吸光度(A),對測得的數據進行線性回歸分析。
2.2.2 樣品液的制備
取水浴浸提液離心后的上清液10 mL 定容于100 mL 容量瓶中,吸取溶液20 mL,再次定容至100 mL,既得所需樣品液。
2.2.3 含量與提取率的測定
精確吸取1 mL 樣品液,按照葡萄糖標準曲線繪制的方法步驟進行測定其吸光度,查回歸曲線得出溶液的濃度,然后計算出多糖的含量。蕨麻多糖提取率的計算公式:

式中:C 為多糖濃度(μg/mL);A 為浸提溶液的總體積(mL);M 為蕨麻質量(g)。
2.3 單因素實驗
在固定溫度80 ℃,提取時間3 h 的條件下,比較液料比10∶1、15∶1、20∶1、25∶1 和30∶1 mL/g 對蕨麻多糖提取率的影響;液料比固定為20∶1 mL/g,分別在50、60、70、80 和90 ℃的恒溫水浴鍋中浸提3 h,以考察提取溫度對蕨麻多糖提取率的影響;在溫度80 ℃,液料比為20∶1 mL/g 的條件下,比較浸提時間1、2、3、4、5 h 對蕨麻多糖提取率的影響;在溫度80 ℃,液料比為20∶1 mL/g 下,對物料分別進行提取,每次提取1 h,考察提取次數對蕨麻多糖提取率的影響。
2.4 響應面實驗設計
根據Box-Behnken 中心組合實驗設計原理,綜合單因素實驗的結果,選取對蕨麻多糖提取率有較明顯影響的3 個因素(液料比、提取時間和溫度)進行對比試驗。在單因素實驗的基礎上,在單因素試驗的基礎上采用三因素三水平的響應面分析方法,試驗因素與水平設計見表1。
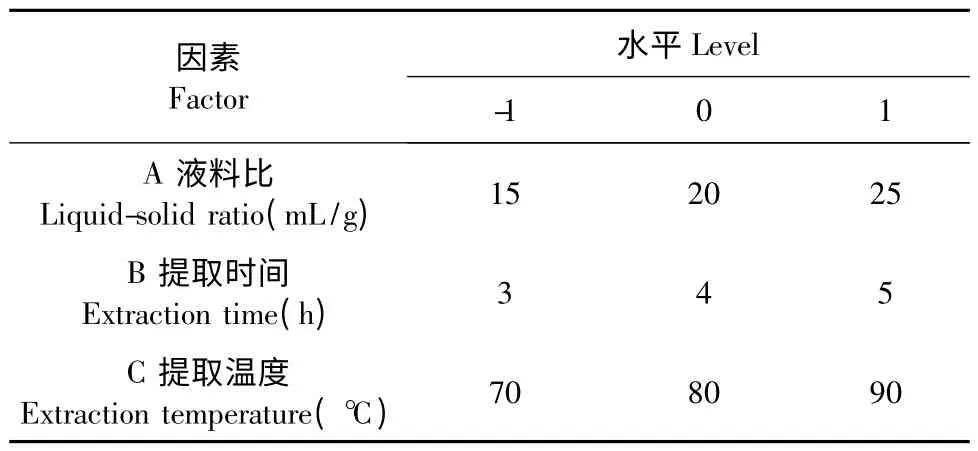
表1 響應面分析因素與水平編碼表Table 1 Experimental design and variables levels for response surface analysis
3 結果與分析
3.1 標準曲線的繪制
以葡萄糖濃度(μg/mL)為橫坐標,吸光度為縱坐標,得到多糖濃度C 和吸光度OD 值的線性回歸曲線,其回歸方程為:Y=0.0107X +0.0250。相關系數R2=0.9932,R2接近1 說明趨勢線的估計值與對應的實際數據之間的擬合程度高。
3.2 單因素實驗結果
3.2.1 液料比對蕨麻多糖提取率的影響
結果見圖1(A),蕨麻多糖的提取率開始時隨著液料比的增加而增加,可是在20∶1 mL/g 時達到最高點,隨后隨著液料比的繼續增加,蕨麻多糖的提取率有所下降。一般來說,液料比越大,即溶劑用量越大提取物質的得率越大,但當溶劑用量達到一定值后,已基本將多糖提取完全,此時繼續增加溶劑量,不僅會造成單位提取液中多糖濃度的降低,而且浪費能源,也給后續的濃縮工作帶來困難,故20∶1mL/g 為最佳液料比。
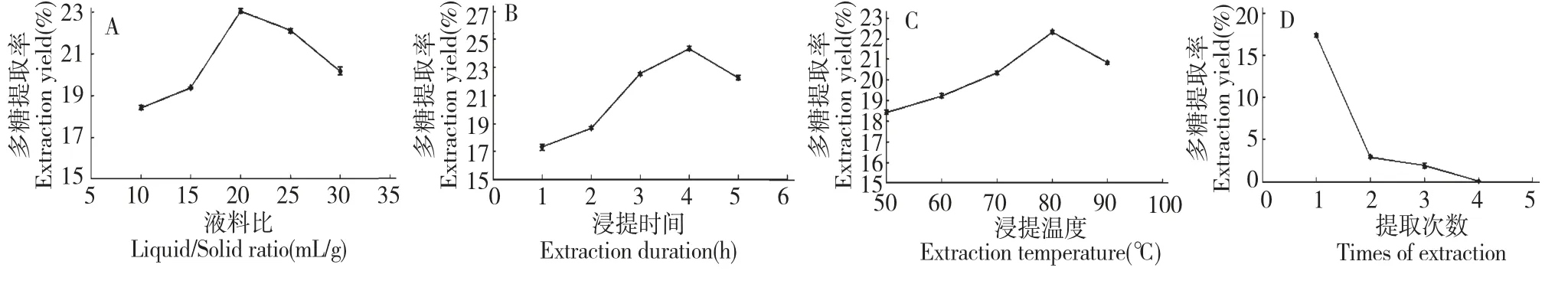
圖1 料液比(A)、浸提時間(B)、浸提溫度(C)及提取次數(D)對蕨麻多糖提取率的影響Fig.1 Effects of liquid-solid ratio (A),extraction duration (B),extraction temperature (C)and times of extraction (D)on the extraction yield of P.anserine polysaccharide
3.2.2 浸提時間對蕨麻多糖提取率的影響
結果見圖1(B),蕨麻多糖的提取率隨著浸提時間的延長而增加,當時間到達4 h 后,隨著提取時間的延長蕨麻多糖的提取率有所下降。這可能是在經過長時間的水浴浸提后,水溶性多糖的結構遭到了某些破壞[10],由此可以確定浸提時間在4 h 左右為宜。
3.2.3 浸提溫度對蕨麻多糖提取率的影響
結果見圖1(C),隨著浸提溫度的增加蕨麻多糖的提取率隨之增加,浸提溫度到達80 ℃是提取率最高,隨后提取率隨著溫度的增加而有顯著的降低,造成這一現象的原因可能是過高的溫度使得蕨麻多糖的結構性能有所影響[11],同時過高的溫度會使蕨麻多糖降解。因此浸提溫度為80 ℃為宜。
3.2.4 提取次數對蕨麻多糖提取率的影響
結果見圖1(D),蕨麻多糖的提取率隨提取次數的增加而逐漸降低,提取次數為4 時蕨麻多糖的提取率幾乎為零。所以從節省資源、降低能耗、成本等角度來考慮提取次數在2 次為宜[12]。
3.3 響應面法優化實驗
3.3.1 響應面試驗結果
根據Box-Behnken 設計進行了17 組實驗,其中5 組中心點重復,結果見表2。利用Design Expert 8.0 軟件對表2 實驗數據進行多元回歸擬合,所得的回歸方程為:


表2 實驗設計及其實驗結果Table 2 Box-Behnken design matrix and the experimental result

對回歸模型進行方差分析,結果見表3。從表3可以知道,模型F=21.50,P=0.0003(P<0.01),本次實驗模型是極顯著的,這說明該實驗模型是可用預測蕨麻多糖的提取工藝[13];失擬項為P=0.1008(P >0.05),因此失擬項不顯著。決定系數R2=96.51%,模型校正系數=92.02%,表明響應值與預測值之間的擬合程度良好,實驗所存在的誤差較小,這進一步表明了該模型可以較好的反應各變量與響應值之間的關系,因此該模型可以用來預測蕨麻多糖提取率[14,15]。

表3 回歸模型方差分析Table 3 Variance analysis of regression model
回歸方程中各變量對指標(響應值)影響的顯著性,由F 檢驗來判斷,概率P 的值越小,相應的變量顯著程度就越高。從表4 可知,用上述回歸方程描述各因素中一次項C 是極顯著的,其次是二次項AB、B2是顯著,A2、C2是極顯著,各因素對蕨麻多糖提取率影響是C >B >A(A、B、C 分別為液料比、浸提時間以及浸提溫度),既提取溫度對蕨麻多糖提取率影響最大,其次是提取時間,最后是液料比。交互項AB 極顯著,表明提取時間和液料比之間存在極顯著的交互作用,因此每個實驗因素對響應值的影響呈現的不是線性關系[16]。

表4 回歸方程系數顯著性分析Table 4 Analysis of the significant coefficients of regression equation
3.3.2 響應面及等高線的分析
圖2 是回歸模型的響應面圖,從圖上我們可以直觀的看出各因素交互效應的顯著程度,越趨向于圓形表明兩個因素之間的交互效應不顯著,反之,越趨向橢圓表明交互效應顯著。從圖2 可以看出:影響因素C(浸提溫度)對蕨麻多糖提取率的影響最為顯著,因為其3D 曲線是三因素中最為陡峭的,其次是因素B(浸提時間),最后是因素C(液料比)[17-19]。
圖2(A)是液料比A 與浸提時間B 及其交互效應對蕨麻多糖提取率影響的響應面圖。從圖可以看出,其等高線呈現橢圓狀,表明因素A 與因素B 的交互效應是較為顯著的。隨著料液比和浸提時間的增加多糖提取率也逐步增加,但是當液料比與浸提時間達到一定值時,多糖提取率會隨著料液比與浸提時間的繼續增加而有所下降。

圖2 兩因素交互作用對提取率的響應面圖Fig.2 Response surface plots showing the effect of different extraction conditions on the extraction yield of polysaccharide
圖2(B)是液料比A 與浸提溫度C 之間交互作用對蕨麻多糖提取率影響的響應面圖。其等高線趨向于圓形,這表明液料比與浸提溫度之間的交互作用對蕨麻多糖提取率的影響不明顯。浸提溫度對蕨麻多糖提取率的影響要遠大于液料比對蕨麻多糖提取率的影響,過高的浸提溫度同樣會使蕨麻多糖提取率下降。
圖2(C)是浸提時間B 和浸提溫度C 之間的交互效應對蕨麻多糖提取率影響的響應面圖。從圖中可以看出當浸提時間一定時,隨著溫度的升高,提取率是先增加后減少的,其變化的趨勢較為陡峭;當浸提溫度一定時,雖然多糖提取率也是隨著浸提時間的延長而先增加后減少的但是其變化的趨勢較為平緩。這說明在一定的液料比時,浸提溫度對蕨麻多糖提取率的影響比浸提時間的影響明顯,而這兩個因素的交互作用不明顯[20]。
3.3.3 驗證試驗
結合實際操作得最佳提取工藝條件是:液料比20.3∶1 mL/g,浸提時間4.4 h,浸提溫度82 ℃。在上述工藝條件下進行實驗驗證,重復三次得到的蕨麻多糖提取率分別為:24.35%、24.38%、24.87%,平均提取率為24.53% ±0.24%。蕨麻多糖提取率實驗值(24.53% ± 0.24%)與模型的預測值(24.40%)比較相差不大,這一結果說明該模型可以較好地預測蕨麻多糖的提取率。
4 結論
本研究在單因素實驗的的基礎上通過三因素上水平響應面法實驗,建立了蕨麻多糖的提取率既響應值與各個因素之間的數學模型。利用Design-Expert 軟件進行回歸擬合后,所得的回歸方程為:Y=24.22 +0.43A+0.45B+0.90C-0.82AB +0.35AC +0.75BC-1.87A2-0.74B2-3.17C2。
方差分析表明,該模型能較好的反映對各因素(液料比、浸提時間、浸提溫度)和蕨麻多糖的提取率之間的關系。液料比和浸提時間對蕨麻多糖的提取率影響是不顯著的(P >0.05),浸提溫度以及液料比、浸提溫度、浸提時間這三個因素的二次方對響應值的影響是顯著的,液料比和浸提時間之間的交互效應顯著(P<0.05)。
在分析各因素的顯著性及其相互間的交互效應的基礎上,得到了蕨麻多糖的最佳提取條件為:液料比20.3∶1 mL/g,浸提時間4.4 h,浸提溫度82 ℃,在此工藝條件下,蕨麻多糖的提取率能達到24.40%,而經過實際試驗得到的多糖提取率為24.53 ±0.24%,預測值與實際值兩者間相差較小。因此可以證明,采用響應面分析法可以有效的對蕨麻多糖的提取工藝進行優化,具有較好的實用價值。
1 Li DY (李棟元),Mao DF (毛東風),Yang JT (楊具田),et al.Determination and analysis of nutritional components of Potentilla anserine.J Tradit Chin Veterin Med (中獸醫醫學雜志),2007,3:43-44.
2 Bai SJ (白術杰),Wu LL (吳莉莉),Zhao CX (趙春霞),et al.The research progress of the medicine value of Potentilla anserina L.China Healtheare Innov (中國醫療前沿),2007,2 (14):34-36.
3 Shuai XH,Hu TJ,Zhang X,et al.Inhibitory action of Potentilla anserine polysaccharide fraction on H2O2-induced apoptosis of murine splenic lymphocytes.Acta Pharm Sin,2010,44:987-993.
4 Wang JL,Zhang J,Wang XF,et al.A comparison study on microwave-assisted extraction of Potentilla anserina L.polysaccharides with conventional method:Molecule weight and antioxidant activities evaluation.Carbohydr Poly,2009,80:84-93.
5 Yang B,Zhao J,Wang X,et al.Optimization of tyrosinase inhibition activity of ultrasonic-extracted polysaccharides from longan fruit per carp.Food Chem,2008,110:294-300.
6 Zhang ZZ (張澤志),Han CL (韓春亮),Li CM (李成未).Application of response surface method in experimental design and optimization.J Henan Insti Edu,Nat Sci(河南教育學院學報,自科報),2011,20(4):34-37.
7 Hao BH (郝慧博).The extraction and purification of polysaccharides from Potentilla anserina L.and the monosaccharide constitute of polysaccharides.Harbin:Harbin Institute of Technology (哈爾濱工業大學),MSc.2010.
8 Wu YQ (吳依茜).Studies on the extraction technology,anti-radiation and anti-oxidation activity of Potentilla anserina polysaccharide.Lanzhou:Northwest Normal University (西北師范大學),MSc.2008.
9 Li YP,Duan Q,Liang YS.Study of determination methods of polysaccharide content in Poria cocos.Med Plant,2014,4(4):39-41.
10 Wu H(吳暉),Lai FR (賴富饒),Hu XB (胡筱波).Optimization of the extraction technology of water-soluble polysaccharides form rape pollen by responsive surfaces analysis.Food Machine (食品與機械),2007,23(5):66-73.
11 Ying Z (應芝),Li JR (勵建榮),Han XX (韓曉祥).Opti-mization of the extraction technique of Morus polysaccharide via response surface analysis.J Chin Insti Food Sci Technol(中國食品學報),2008,8(4):39-45.
12 Wang YY (王艷艷),Wang TJ (王團結),Ding LL (丁琳琳).Optimization of polysaccharide extraction from Angelica sinensis using response surface methodology.Food Sci (食品科學),2012,33:146-149.
13 Wei ZY (魏楨元),Zhong YG (鐘耀廣),Liu CZ (劉長江).Optimization of extraction of lentinan by response surface methodology.Liaoning Agric Sci (遼寧農業科學),2010,3(2):11-14.
14 Fang J (房健),Xing XP (邢曉平),Chen HX (陳洪興),et al.Optimization of hot water extraction of polysaccharide from Rhizoma Phragmitis by response surface analysis.J Anhui Agric Sci (安徽農業科學),2010,38:15552-15554.
15 Liu HJ (劉軍海),Huang BX (黃寶旭),Jiang DC (蔣德超).Optimization of extraction technique of polysaccharides from Argy Wormwood leaves via response surface methodology (RSM).Food Sci(食品科學),2009,30:114-118.
16 Zhong K (鐘葵),Wang Q (王強).Optimization of hot-water extraction of polysaccharides from dried longan pulp using response surface methodology.Chem Ind Eng Prog (化工進展),2010,29:739-744.
17 Luo L (羅玲),Zhou BX (周斌星),Guo W (郭威),et al.Research on the extraction technology of Pu-erh tea polysaccharide by response surface analysis.Chin Agric Sci Bull (中國農學通報),2012,28:263-266.
18 Zhao P (趙鵬),Li WH (李穩宏),Li ZH (李驟海),et al.Optimization of ultrasonic extraction for polysaccharides from Lonicera japonica.Food Sci (食品科學),2009,30:151-154.
19 Yang WG (楊文鴿),Xie GH (謝果凰),Yan WH (顏偉華),et al.Optimization of wet-salting technology for Muraenesox Cinereus using response surface analysis.J Chin Insti Food Sci Technol (中國食品學報),2010,10:133-139.
20 He YF (何燕斐),Han XX (韓曉祥),Zhou LX (周凌霄),et al.Optimization of process variables in the synthesis of octyl acetate by response surface methodology.Hans J Chem Eng Technol (化學工程與技術),2012,2:29-36.

