17α-甲睪酮對黃姑魚幼魚生長及性分化的影響
林家豪,陳睿毅,樓 寶,徐冬冬,詹 煒,毛國民,等
(1.浙江海洋學院水產學院,浙江舟山 316022;2.浙江省海洋水產研究所,浙江舟山 316021;3.浙江省海水增養殖重點實驗室,浙江舟山 316021;4.浙江省樂清市海洋與漁業局,浙江樂清 325600)
17α-甲睪酮對黃姑魚幼魚生長及性分化的影響
林家豪1,陳睿毅2,3,樓 寶2,3,徐冬冬2,3,詹 煒2,3,毛國民2,3,等
(1.浙江海洋學院水產學院,浙江舟山 316022;2.浙江省海洋水產研究所,浙江舟山 316021;3.浙江省海水增養殖重點實驗室,浙江舟山 316021;4.浙江省樂清市海洋與漁業局,浙江樂清 325600)
利用不同濃度的17α-甲睪酮(MT)(0.5、1、5、10 μg/L)對25日齡的雌核發育黃姑魚進行浸浴處理,每日2 h,連續處理75 d,用以研究MT對其生長、死亡率和性分化的影響。實驗結果表明,在雌核發育黃姑魚孵化后25日齡至100日齡用17α-甲基酮進行浸浴處理均可使其轉化成偽雄魚。外源性MT對黃姑魚的生長有抑制作用,與對照組差異顯著(P≤0.05),但對其生存率并無顯著影響(P≥0.05);各MT實驗濃度對雌核發育黃姑魚幼魚都有性逆轉作用,性逆轉時間5 μg/L最早,比正常黃姑魚提前了4 d。
17α-甲睪酮;黃姑魚;性分化
黃姑魚Nibea albifloraRichardson俗稱黃婆雞、黃姑子,隸屬鱸形目Perciformes、石首魚科Sciaenidae、黃姑魚屬Nibea。黃姑魚為暖水性中下層魚類,在我國沿海均有分布,其肉質鮮美,營養豐富,歷來是漁民的主要捕撈對象。但近年來,由于海洋環境遭到破壞和漁民的濫捕濫撈,其漁業資源急劇衰減,野生黃姑魚的產量已遠遠不能滿足市場的需求,因此人們開始進行人工養殖。在人工養殖過程中發現,雌性黃姑魚要比雄性黃姑魚生長速度快20%[1],那么實現黃姑魚的全雌化養殖對于黃姑魚的養殖業就顯得尤為重要。徐冬冬等[2]利用雌核發育的方法誘導了全雌的黃姑魚苗種,但誘導率極低,不適用于大規模苗種繁育。而在此基礎上,以雌核發育黃姑魚為材料,利用17α-甲睪酮(MT)對其進行誘導,獲得生理雄性、遺傳雌性的偽雄魚,性成熟后再與雌魚交配即可規模化得到全雌苗種。
利用雄性激素對魚類進行性別控制的研究早有報道[3-4]。GRANT等[5]分別利用17α-甲睪酮(MT)和11β-烯二酮(OHA)對虹鱒Oncorhynchus mykiss進行了偽雄魚的誘導研究,結果表明MT浸泡比OHA(400 μg/L)浸泡可以獲得更高的雄性率。KERSTIN等[6]對1齡烏鰭石斑魚Epinephelus marginatus進行MT(11 mg/kg)植入,12周后觀察到其發生性轉變。MERCEDES等[7]用MT含量為10 mg/kg的飼料飼喂歐洲鱸魚Dicentrarchus labrax,發現從126日齡開始飼喂。連續飼喂100可以獲得93%~100%的雄性率,而晚于該階段雄性率則不會出現顯著變化。FEIST等[8]對虹鱒進行MT浸泡與MT浸泡與投喂相結合實驗,結果通過浸泡與投喂相結合性轉化成的偽雄魚通常沒有輸精管,而單獨浸泡MT產生的偽雄魚通常具有輸精管。雌性激素也常用來誘導魚類雌性化的產生[9]。YAMAMOTO[10]利用17β-雌二醇采用浸泡法對雌核發育牙鲆Paralichthys olivaceus進行了雌性誘導的研究,獲得了100%的雌性率。由此可見,無論是浸泡法,還是飼喂法,利用外源激素均能達到性別控制的目的,但是浸泡法更有利于輸精管的形成。
目前,尚未有關于雄性激素對黃姑魚性別分化與生長影響的相關報道。本研究擬通過MT浸泡雌核發育黃姑魚稚魚,觀察實驗魚性分化與生長等性狀,檢驗甲睪酮是否會對幼魚產生影響,以期為今后黃姑魚偽雄魚制備提供技術參考。
1 材料與方法
1.1 實驗材料
2014年6月份于浙江省海洋水產研究所西閃試驗場,參考徐冬冬等[2]的方法制備雌核發育黃姑魚。用500 L的玻璃鋼水槽進行孵化、養殖,水溫21±0.5℃,鹽度20~21,水深30 cm。試驗前期投喂輪蟲、豐年蟲和橈足類,25日齡(4.363 3±0.004 6 g,0.688 9±0.004 8 cm)時開始投喂配合飼料,早中晚3次,定時投喂,飽食。
1.2 實驗方法本實驗采用雄性激素浸泡法,設置4個實驗組,每組3個平行,每個平行150尾魚苗,激素濃度分別為0.5、1、5和10 μg/L,1個陰性對照組,用同濃度的乙醇處理;1個空白對照組,不做任何處理。MT(1 g,純度:≥95%,Matrix)購自上海研生實業有限公司,先用分析純無水乙醇溶解,配置成1×105μg/L的母液。每天下午2點開始浸泡,持續2 h,按不同激素濃度添加不同體積的激素母液,浸泡結束后,充分換水,保證激素無殘留。從25日齡開始取樣,每5天取樣1次,至100日齡結束。測量其體重和全長后,置于玻恩氏液中固定,經梯度乙醇脫水,二甲苯透明和石蠟包埋后,作連續切片,切片厚度為5~8 μm,HE染色,光學顯微鏡(LEICA DM4000B顯微鏡,Shineso MIC型顯微圖像分析系統)觀察拍照鑒定其性別。
1.3 分析方法
利用SPSS19.0統計軟件的One-Way ANOVA的分析方法對數據進行統計分析。
2 結果與分析
2.1 17α-甲睪酮對黃姑魚生長的影響
從圖1可以看出,在外源MT的影響下,4個實驗組黃姑魚的體重均受到不同程度的抑制,其中尤以10 μg/L激素濃度下抑制最為明顯,70日齡后體重增長趨勢明顯減緩;其平均特定增長率僅為3.51 g,遠小于對照組4.14 g(表1)。黃姑魚在30日齡時,體重與全長均未存在顯著差異;70日齡時,空白組和對照組無顯著差異,4個實驗組的體重均與空白組和對照組存在顯著差異(P≤0.05),且0.5、1和5 μg/L 3組與10 μg/L組也存在顯著差異;100日齡時,10 μg/L處理組的體重遠小于其它組,且差異性顯著(P≤0.05)(表1)。
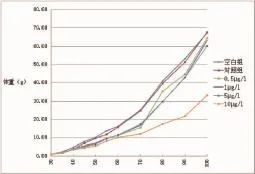
圖1 17α-甲睪酮對黃姑魚生長的影響Fig.1 The effect of 17α-Methyltestosterone onN.albifloragrowth

表1 17α-甲睪酮對黃姑魚生長影響的顯著性檢驗Tab.1 Results of chi-squared analyses for growth after 17α-Methyltestosterone treatment
2.2 17α-甲睪酮對黃姑魚死亡率的影響
在實驗過程中發現黃姑魚出現死亡,累計死亡率見表2,對照組和實驗組的累計死亡率均低于9%。方差分析結果顯示,各組之間的死亡數并無顯著差異,表明MT的處理并未對黃姑魚的死亡產生顯著影響(P≥0.05)。

表2 17α-甲睪酮處理后黃姑魚的累計死亡率Tab.2 The cumulative mortalities ofN.albifloraup to 100 days after 17α-Methyltestosterone treatment
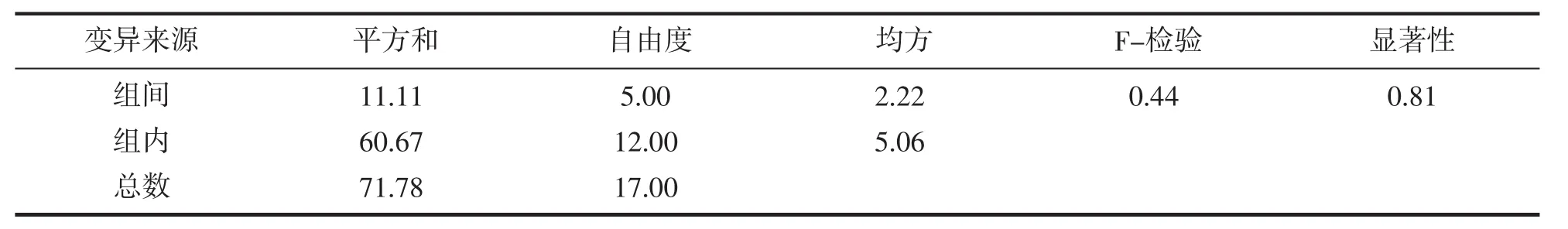
表3 17α-甲睪酮處理后黃姑魚累計死亡數的方差分析Tab.3 Results of one-way ANOVA forN.albifloracumulative mortalities after 17α-Methyltestosterone tretment
2.3 17α-甲睪酮對黃姑魚性分化的影響
黃姑魚25日齡與30日齡的性腺橫切片中,各實驗組無區別,都觀察到黃姑魚原始性腺出現,位于魚鰾下方與腸管之間,左右各有一個原始性腺(圖2:a)。40日齡時,對照組和空白組的性腺橫切片觀察到黃姑魚生殖細胞和體細胞通過有絲分裂大量增殖,向性腺腹腔聚攏,形成卵巢腔的雛形(圖2:c),從細胞學上證明這種性腺已決定并向卵巢方向分化。
在45日齡的黃姑魚性腺橫切片中,5 μg/L激素處理組觀察到壺腹狀的輸精管原基、精原細胞,精母細胞和血管(圖2:f)。
在55日齡的黃姑魚性腺橫切片中,0.5 μg/L激素處理組和1 μg/L激素處理組黃姑魚首次觀察到呈壺腹狀的輸精管原基,前者具有較多精原細胞,還觀察到血管和很少一部分周邊核仁期的卵母細胞(圖2:d);后者體積明顯較大,具有一定數量的精原細胞和精母細胞,若干個周邊核仁期的卵母細胞(圖2:e)。
在80日齡的黃姑魚性腺橫切片中,10 μg/L激素處理組黃姑魚中同時具有輸精管、精小葉、精原細胞、精母細胞和較多數量的周邊核仁期的卵母細胞(圖2:h)。
100日齡時,空白組與對照組的性腺橫切片示卵巢(圖2:i-j);各激素濃度組(0.5、1、5和10 μg/L)的性腺橫切片皆示精巢(圖2:k-n)。
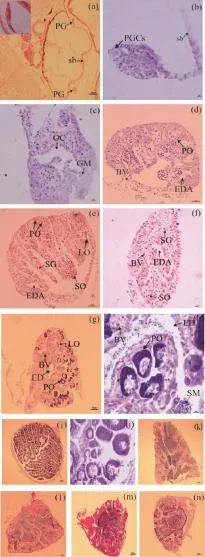
圖2 黃姑魚性分化過程Fig.2 Sex differentiation process ofN.albiflora
3 討論
3.1 對生長的影響
性類固醇激素具有調節腦垂體刺激生長激素分泌的作用[6],而魚類生長激素是在魚類機體生長發育起關鍵作用的調節因子,可以刺激組織發育,影響魚類生長[11]。研究表明[12],對60 pdf的黑鱸Dicentrarchus labrax進行投喂MT(10 mg/kg),200 d后其平均體重比對照組低55%,差異顯著(P≤0.05)。無獨有偶,JORDI等[13]發現每天投喂OHA含量為10 mg/kg的飼料,塞內加爾鰨Solea senegalensis的生長受到明顯的抑制。本實驗中,空白組和對照組的黃姑魚生長并無顯著差異,因此可以排除其受到乙醇影響的可能。在30日齡時,黃姑魚體重與全長無顯著差異,而在養至70和100日齡時,4個實驗組的體重與全長均小于對照組,且差異顯著(P≤0.05),表明養殖水體中添加MT會抑制黃姑魚早期的生長。3個實驗組(0.5、1和5 μg/L)的生長雖低于空白組和對照組,但3組之間并無顯著差異(P≥0.05),表明在一定濃度范圍內,隨著MT濃度的升高,黃姑魚的生長不會受到影響。而高濃度(10 μg/L)處理組的特定生長率最小,尤其在70日齡后,體重增長極為緩慢,推測原因可能是高濃度的外源激素影響黃魚類的攝食和代謝能力,從而抑制魚體生長[14]。
3.2 對死亡率的影響
有研究表明,當激素濃度在某一范圍內時對魚類成活率無顯著影響,但在超過某個閾值后,魚類的成活率將會顯著降低[12]。KNORR等[15]對日本青鳉Oryzias latipes進行辛基酚處理發現,當處理濃度≥2 μg/L時死亡率升高20%~30%。同樣,在誘導香魚性轉換的研究中發現,隨著苯甲酸強力春情素濃度的增加,其死亡率也逐步升高[16-17]。本研究中,各組死亡率雖高于5%,但并未出現顯著差異(P≥0.05),可見MT激素濃度在黃姑魚耐受范圍內,對其成活率不會造成影響。
3.2 對性分化的影響
研究表明,魚類性腺受內源性激素的影響[18]。而外源激素MT則會影響卵巢的進一步發育,這一結論已在斑馬魚中得到證實[18-19]。利用MT與11β-羥雄烯二酮(OHA)均能誘導雌性虹鱒魚性逆轉為雄性虹鱒魚[6,20]。本實驗對4個不同激素濃度組處理雌核發育黃姑魚的性腺分化情況進行組織學觀察,結果表明100日齡時,4個激素處理組的性腺至均發育為精巢,雄性率為100%;而對照組和空白組則發育為卵巢,雄性率為0。但各組性腺分化時間并不同步,且在一定時間段內出現了雌雄間體的現象(圖2:(d)(e)(g)(h))。本實驗中,0.5 μg/L激素濃度下,黃姑魚55日齡的性腺可同時觀察到卵母細胞和輸精管原基,表明外源MT對卵母細胞有抑制作用,且促進雄性生殖細胞的發育,這與卓孝磊等[20]的研究結果相似。張曉彥等[21]報道,17β-雌二醇處理后半滑舌鰨卵巢分化提前了7 d。而在本實驗中,5 μg/L激素濃度下,黃姑魚45日齡性腺開始向精巢轉化,較對照組的黃姑魚雄性性腺分化時間提前了4 d。
上述研究結果表明,在雌核發育黃姑魚孵化后25日齡至100日齡用17α-甲基酮進行浸浴處理均可使其轉化成偽雄魚。同時外源MT對黃姑魚的生長有抑制作用,但對其生存率無影響,而對其性腺分化有影響。
[1]徐冬冬,詹 煒,樓 寶,等.網箱養殖黃姑魚生長特性初步研究[J].漁業現代化,2010,37(5):34-37.
[2]徐冬冬,樓 寶,薛寶貴,等.黃姑魚(Nibea albiflora)雌核發育的人工誘導及鑒定[J].海洋與湖沼,2013,44(2):310-317.
[3]BYE V J,LINCOLN R F.Commercial methods for the control of sexual maturation in rainbow trout(Salmo gairdneriR.)[J]. Aquaculture,1986,57:299-309.
[4]HUNTER G A,DONALDSON E M,STOSS J,et al.Production of monosex female groups of Chinook salmon(Oncorhynchus tshawytscha)by the fertilization of normal ova with sperm from sex-reversed females[J].Aquaculture,1983,33:355-364.
[5]GRANT F,CHOO-GUAN Y,MARTIN S.F,et al.The production of functional sex-reversed male rainbow trout with 17αmethyltestosterone and11β-Hydroxyandrostenedione[J].Aquaculture,1995,131(4):145-152.
[6]KERSTIN S,MARIA P,SILVIA Z,et al.Permanent sex inversion in 1-year-old juveniles of the protogynous dusky grouper (Epinephelus marginatus)using controlled-release 17α-methyltestosterone implants[J].Aquaculture,2006,256:443-456.
[7]MERCEDES B,FRANCESC P,SILVIA Z,et al.Donaldson.Development of sex control techniques for European sea bass(Dicentrarchus labraxL.)aquaculture:effects of dietary 17 α-methyltestosterone prior to sex differentiation[J].Aquaculture,1995, 135(4):329-342.
[8]FEIST G,YEOH C-G,FITZPATRICK M S,et al.The production of functional sex-reversed male rainbow trout with 17αmethyltestosterone and 11 β-hydroxyandrostenedione[J].Aquaculture,1995:145-152.
[9]李文笙,林浩然.17β-雌二醇對不同性腺發育時期鯉魚生長激素分泌的影響[J].中國實驗動物學報,2003,11(2):96-102.
[10]YAMAMOTO E.Application of gynogenesis and triploidy in hirame(Paralichthys olivaceus)breeding[J].Fish Genetic Breeding Science,1992,18:3-23.
[11]KOPCHICK J J,ANDRY J M.Growth hormone(GH),GH receptor,and signao transduction[J].Molecular Genetics and Metabolism,2000(71):293-314.
[12]BLAZQUEZ M,ZANUY S,CARRILLO M,et al.Structural and functional effects of early exposure to estradiol-17βand 17αethynylestradiol on the gonads of the gonochoristic teleostDicentrarchus labrax[J].Fish Physiology and Biochemistry,1998,18: 37-47.
[13]JORDI V,ESTHER A,JOS P C,et al.Gonadal sex differentiation in the Senegalese sole(Solea senegalensis)and first data on the experimental manipulation of its sex ratios[J].Aquaculture,2013(74-81):384-387.
[14]莊 平,田美平,張 濤,等.投喂雌二醇對西伯利亞鱘幼魚生長及血液生化指標的影響[J].海洋漁業,2010,32(2):148-153.
[15]KNORR S,BRAUNBEEK T.Deceline in reproductive success,sex reversal and development alterations in Japanese medaka (Oryzias latipes)after continuous exposure to octylphenol[J].Ecotoxicology and Environment Safety,2002,51:187-196.
[16]阮洪超,黃瑞冬.己烯雌酚誘導黑鯛幼魚性轉換[J].海洋科學,1997(6):6-7.
[17]CARLOS A,STR SSMANN M N.Morphology,endocrinology,and environmental modulation of gonadal sex differentiation in teleost fishes[J].Fish Physiology and Biochemistry,2002,26:13-19.
[18]趙春剛,范 鵬,劉 奕,等.甲基睪酮對雌性斑馬魚性腺發育的抑制作用[J].東北農業大學學報,2010,41(12):70-74. http://www.sciencedirect.com/science/article/pii/004484869400336M-COR1
[19]PIFERRER F.Endocrine sex control strategies for the feminization of teleost fish[J].Aquaculture,2001,197:229-281.
[20]卓孝磊,鄒記興,崔 科,等.外源性甲基睪丸酮對雌性和間性黃鱔性腺發育的影響[J].水生生物學報,2008,32(6):861-867.
[21]張曉彥,劉海金.17β-雌二醇對半滑舌鰨性分化和生長的影響[J].東北農業大學學報,2009,40(6):67-72.
Effects of 17α-Methyltestosterone on Growth and Sex Differentiation in Nibea albiflora
LIN Jia-hao1,CHEN Rui-yi2,3,LOU Bao2,3,et al
(1.Fishery School of Zhejiang Ocean University,Zhoushan 316022;2.Zhejiang Marine Fisheries Research Institute,Zhoushan 316021;3.Zhejiang Key Lab of Mariculture&Enhancement,Zhoushan 316021,China)
In order to study on the effects of 17α-methyltestosterone on growth,mortality and sex differentiation inNibea albiflora,the Gynogenetic larval(N.albiflora)on 25 days post hatching were treated in 17α-Methyltestosterone(0.5,1,5,10 μg/L)for 2 hours each day and lasted for 75 days.The results showed that GynogeneticN.albifloracould convert into pseudo-male after 75 days treatment with MT.Meanwhile,exogenous MT had an inhibiting effect on the growth ofN.albiflora,weight gain of which was significantly lower than that in the control group(P≤0.05),however,survival was not affected by exogenous MT(P≥0.05).The MT concentration for each experiment can reversal Gynogenetic croaker juveniles is sex,the treatment group 5 μg/L reversal sex earliest and 4 days earlier than the normalNibea.
17α-Methyltestosterone;Nibea albiflora;sex differentiation
S917.4
A
1008-830X(2015)01-0020-06
2014-10-10
浙江省科技計劃項目(2012C12907-8;2013F20001);“十二五”農村領域國家科技計劃課題(2012AA10A413)
林家豪(1993-),女,浙江溫嶺人,碩士研究生,研究方向:安全養殖工藝與技術.
樓寶,研究員.E-mail:loubao6577@163.com

