表皮生長因子測定在判斷帕金森病認知障礙中的價值
李普蕾 惲文偉 梅雨晴 岑 嶺 馮益萍 楊靜婷(通訊作者)南京醫科大學附屬常州市第二人民醫院神經內科 常州 213003
表皮生長因子測定在判斷帕金森病認知障礙中的價值
李普蕾 惲文偉 梅雨晴 岑 嶺 馮益萍 楊靜婷(通訊作者)
南京醫科大學附屬常州市第二人民醫院神經內科 常州 213003
目的 探討帕金森病患者血漿EGF水平及事件相關電位P300電位測定波幅和潛伏期改變與PD認知障礙間的關系,為臨床醫生診斷病情,判斷預后提供更準確有效的參考依據。方法 選擇我院2010—2012年門診及住院的原發性PD患者50例和健康體檢者50例為研究對象,應用蒙特利爾認知評價量表(MoCA)進行認知功能評估,分為PD組認知損害28例,PD組認知正常22例及對照組認知正常24例,認知損害26例,應用蒙特利爾認知評價量表(MoCA)對4組患者進行評分,采用雙抗體夾心ABC-ELISA法測量血漿EGF濃度,采用短音刺激測定P300電位的潛伏期及波幅,分析并比較三者間的相互關系。結果 在MoCA各項評分方面,除定向不存在差異(P>0.05),PD組定向障礙與PD組正常間其余各項均存在差異(P<0.05);對照組定向障礙與正常組正常之間存在差異(P<0.05);在EGF濃度方面,PD組定向障礙與PD組正常間存在顯著差異(P<0.01),對照組定向障礙與正常組正常間存在顯著差異(P<0.01);在P300電位方面,PD組定向障礙與PD組正常間存在顯著差異(P<0.01),對照組定向障礙與正常組正常間存在顯著差異(P<0.01);患者MoCA總分、血漿EGF濃度及P300電位潛伏期及波幅兩兩行Pearson相關分析,均存在相關性(P<0.05)。結論 PD患者血清表皮生長因子(EGF)濃度與PD認知功能障礙存在密切關系,低濃度的EGF對判斷帕金森病認知障礙及預后有預測價值。
帕金森病;蒙特利爾認知評價量表;血漿EGF;事件相關電位;P300電位
帕金森病(PD)是以靜止性震顫、強直、動作緩慢和姿勢協調性障礙等運動癥狀為主要臨床表現的神經系統慢性變性疾病,在確診初期即有20%會出現輕度認知障礙(MCI),20%~80%會在以后發生癡呆(PDD)[1]。MoCA評定認知障礙受到多因素影響,有時并不能真實反映患者的認知功能障礙[2-3]。因此,加強對PD相關的認知障礙的早期判斷和適當干預,對PD患者的治療和改善遠期生活質量有重要意義。研究顯示[4],在模擬PD的小鼠中也發現EGF濃度低于正常水平的現象,給予小鼠EGF將阻止多巴胺能神經元變性,因此說明EGF濃度水平與帕金森病認知障礙間存在密切關系。本次課題旨在探討帕金森病患者血漿EGF水平及事件相關電位P300電位測定的波幅和潛伏期改變與PD認知障礙間的關系,結果如下。
1 資料和方法
1.1 一般資料 選擇我院2010—2012年門診及住院的原發性PD患者50例,所有患者診斷均符合英國腦庫PD診斷標準和2006年制定的PD診斷標準,經頭顱CT或MRI檢查,排除腦血管病、腦炎、外傷、藥物所致的帕金森綜合征、帕金森疊加綜合征、惡性腫瘤,排除視力、聽力、肢體嚴重功能障礙,不能用語言交流及精神疾病患者,另選取健康體檢者50例為研究對象,應用蒙特利爾認知評價量表(MoCA)進行認知功能評估,分為PD組認知損害28例,PD組認知正常22例及對照組認知正常24例,認知損害26例,4組間性別構成和年齡比較差異無統計學意義(P>0.05)。
1.2 實驗方案
1.2.1 儀器及設備:采用BIO-RAD 680酶標儀,上海醫療器械有限公司的80-2臺式低速離心機(最高轉速4 000r/min)、上海一恒科學儀器有限公司的隔水式恒溫培養箱及keypoint.net肌電-誘發電位儀進行測試。
1.2.2 試劑:采用北京四正柏生物科技有限公司生產的人EGF定量EIA試劑盒。
1.3 操作步驟
1.3.1 MoCA評分:應用蒙特利爾認知評價量表(MoCA)對4組患者進行評分:包括視空間執行能力、命名、記憶、注意、語言流暢、抽象思維、延遲記憶、定向力等八個方面,共計30分;受試者受教育年限≤12a者,在MoCA測試結果上加1分以矯正文化程度的偏倚;MoCA評分在26分以下屬于認知障礙。
1.3.2 EGF濃度測量:采用雙抗體夾心ABC-ELISA法測量血漿EGF濃度:抽取清晨空腹靜脈血3mL,離心15min,取血清-20℃儲存待測。
1.3.3 采用短音刺激測定P300電位的潛伏期及波幅:檢查方法:應用丹麥產keypoint.net肌電-誘發電位儀,采用聽覺Oddball程序測定P300。靶刺激發聲頻率2kHz,隨機出現,占20%;非靶刺激發聲頻率1kHz,占80%;刺激強度80dB,靈敏度為10uv/cm,帶通范圍1~30Hz,靶刺激疊加30次。受試者清醒,取舒適坐位,囑其微閉雙眼,集中注意力。要求受檢者在測試中出現靶刺激時,迅速按鍵。每位受檢者均重復測兩輪,取其平均值。記錄P300的潛伏期(PL)和波幅(Amp),記錄電極置于Cz點,參考電極置于一側耳垂,前額接地,電極與皮膚間阻抗<5Ω。判斷標準:PL、Amp取正常對照組的均值±2.5倍標準差(±2.5s)為正常范圍。
1.4 統計方法 所有統計數據均采用SPSS17.0統計軟件進行分析,計量資料采用(±s)表示,采用t檢驗,計數資料以率(%)表示,采用χ2檢驗,血漿EGF水平、P300測定電位的潛伏期及波幅變化與MoCA評分相互關系采用Pearson相關分析,P<0.05為差異有統計學意義。
2 結果
2.1 4組患者MoCA評分比較 在MoCA各項評分方面,除定向不存在差異(P>0.05),PD組定向障礙與PD組正常間其余各項均存在差異(P均<0.05);對照組定向障礙與正常組正常之間存在差異(P均<0.05),PD組定向障礙與對照組定向障礙無差異(P>0.05),PD組正常與對照組正常無差異(P>0.05)。見表1。
表1 4組患者MoCA各分檢測狀況分析(±s,分)

表1 4組患者MoCA各分檢測狀況分析(±s,分)
總分PD組定向障礙28 2.43±1.63 2.62±0.68 4.93±1.12 2.46±0.86 1組別 n 視空間和執行 命名 注意力 語言 抽象 延遲回憶 定向 MoCA .09±0.84 1.67±1.48 5.72±0.97 20.92±4.02 PD組正常 22 4.56±0.81 2.94±0.28 5.68±0.66 2.97±0.29 1.86±0.43 3.75±1.01 5.98±0.13 27.74±1.35對照組定向障礙26 2.20±1.57 2.51±0.70 3.98±1.45 1.76±1.05 0.97±0.78 2.01±1.48 5.18±1.51 18.61±4.57對照組正常 24 4.53±0.83 2.98±0.25 5.86±0.49 2.94±0.32 1.79±0.45 4.21±0.95 5.86±0.15 28.17±1.39
2.2 4組患者血漿EGF濃度測定及P300電位的潛伏期及波幅狀況 在EGF濃度方面,PD組定向障礙與PD組正常間存在顯著差異(t=14.47、P=0.00<0.01),對照組定向障礙與正常組正常間存在顯著差異(t=12.22,P=0.00<0.01),PD組定向障礙與對照組定向障礙存在顯著差異(t=2.938,P=0.004<0.01),PD組正常與對照組正常無差異(P>0.05);在P300電位方面,PD組定向障礙與PD組正常間存在顯著差異(t=5.204,6.404,P=0.00<0.01),對照組定向障礙與正常組正常間存在顯著差異(t=3.302,10.19,P =0.00<0.01),PD組定向障礙與對照組定向障礙存在顯著差異(t=3.638,2.55,P<0.05),PD組正常與對照組正常間波幅上存在顯著差異(t=5.270,P<0.01),潛伏期無差異(P >0.05)。見表2。
表2 4組患者血漿EGF濃度測定及P300電位的潛伏期及波幅狀況(±s)
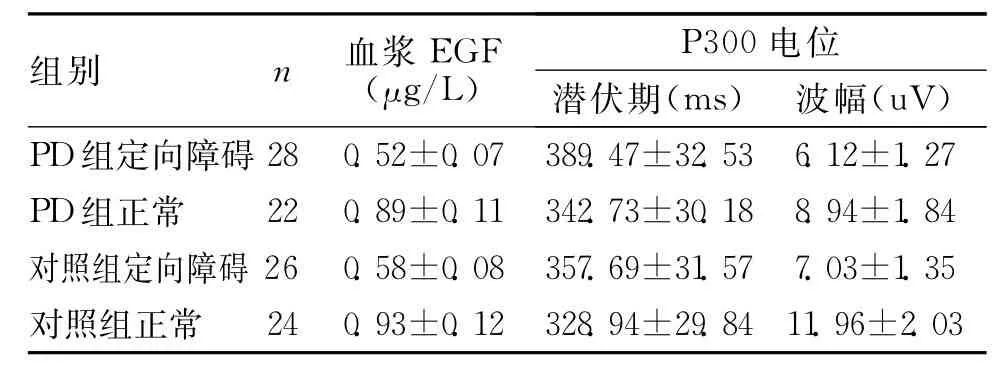
表2 4組患者血漿EGF濃度測定及P300電位的潛伏期及波幅狀況(±s)
組別 n 血漿EGF(μg/L)電位潛伏期(ms)波幅(uV)P300 PD組定向障礙28 0.52±0.07 389.47±32.53 6.12±1.27 PD組正常 22 0.89±0.11 342.73±30.18 8.94±1.84對照組定向障礙26 0.58±0.08 357.69±31.57 7.03±1.35對照組正常24 0.93±0.12 328.94±29.84 11.96±2.03
2.3 PD患者MoCA總分、血漿EGF濃度及P300電位潛伏期及波幅相關關系分析 對MoCA總分、血漿EGF濃度及P300電位潛伏期及波幅間行Pearson相關分析,MoCA總分與血漿EGF濃度存在正相關(r=0.486,P=0.026<0.05),MoCA總分與P300電位潛伏期存在負相關(r=-0.621,P =0.007<0.01),MoCA總分與P300電位波幅存在正相關(r=0.533,P=0.010<0.05),血漿EGF濃度與P300電位潛伏期存在負相關(r=-0.512,P=0.012<0.05),血漿EGF濃度與P300電位波幅存在正相關(r=-0.607,P=0.008<0.01)。見表3。

表3 PD患者MoCA總分、血漿EGF濃度及P300電位潛伏期及波幅相關關系分析
3 討論
帕金森病(PD)是以靜止性震顫、強直、動作緩慢和姿勢協調性障礙等運動癥狀為主要臨床表現的神經系統慢性變性疾病[5]。隨著對PD認識的加深,PD患者的非運動癥狀,包括精神癥狀、自主神經功能異常,特別是認知障礙日漸受到重視。PD患者在確診初期即有20%會出現輕度認知障礙(MCI),20%~80%會在以后發生癡呆(PDD)。PD相關的認知障礙和癡呆增加了患者的致殘率和病死率,也給家人和社會帶來沉重負擔。因此,加強對PD相關認知障礙的早期判斷和適當干預,對PD患者的治療和改善遠期生活質量有重要意義。PD患者認知功能障礙主要表現在視空間功能、執行功能、記憶力、注意力等方面[6]。研究表明,氧化應激、線粒體功能障礙、泛素蛋白酶體系統功能障礙、炎性反應、興奮性氨基酸毒性和凋亡均參與PD的發病過程。PD主要病理特征是黑質多巴胺等神經元的變性壞死和殘存神經元內路易小體形成。文獻報道[7],PD患者存在額葉功能受損,認為PD患者出現認知障礙和癡呆可能與額葉紋狀體環路破壞有關。多巴胺能、非多巴胺能系統(包括乙酰膽堿、去甲腎上腺素、5-羥色胺等)均與PD認知障礙有關。
目前,對PD患者認知功能評定主要依賴于神經心理學測試,如簡易智能狀態檢查量表(MMSE)及蒙特利爾認知評估量表(MoCA)等,最近多項研究表明MoCA作為一種新的認知篩查工具較MMSE更適合用于PD患者早期認知障礙的篩查[8]。但由于量表的評價受多方面因素(如文化程度、年齡、抑郁情緒、藥物不良反應等)的影響,所以有時并不能真實反映患者的認知功能障礙。表皮生長因子(EGF)為一種低分子量的多肽類生長因子,是一種強有力的細胞分裂促進因子,存在于人體組織和細胞外液,與胚胎發生與生長、組織修復和再生以及腫瘤發生等均有密切關系[9]。EGF可促進神經系統的生長發育,促進神經干細胞的增殖,并參與神經元的氧化性損傷。EFG對中腦多巴胺神經元產生神經營養活性,測量PD患者死后腦中EGF含量[10],發現患者額前皮質和新紋狀體中EGF和酪氨酸羥化酶減少,且EGF受體的表達在前腦區也明顯下調。在模擬PD的小鼠中也發現這種現象,給予小鼠EGF將阻止多巴胺能神經元變性,從而揭示了EGF神經營養活性是由中腦多巴胺神經元傳入信號維持的,而在PD患者中EGF的營養活性受損。
綜上所述,PD患者血清表皮生長因子(EGF)濃度與PD認知功能障礙存在密切關系,低濃度的EGF對判斷帕金森病認知障礙及預后有預測價值。
[1]Hely MA,Reid WGJ,Adena MA,et al.The Sydney multicenter study of Parkinson’s disease:the inevitability of dementia at 20 years[J].Movement Disorders,2008,23(6):837-844.
[2]Modak A,Durso R,Josephs E,et al.A rapid non invasive LDOPA-C breath test for optimally suppressing extracerebral AADC enzyme activity-toward individualizing carbidopa therapy in Parkinson’s disease[J].J Parkinsons Dis,2012,2(4):349-56.
[3]Parrao-Diaz T,Chana-Cuevas P,Juri-Claverias C,et al.Evalu-ation of congnitive impairment in a population of patients with Parkinson′s disease by means of the mini mental Parkinson test [J].Rev Neurol,2005,40(6):339-344.
[4]James E,Galvin MD.Cognitive change in Parkinson disease[J].Alzheimer Dis Assoc Disord,2006,20(4):302-310.
[5]Hausdorff JM,Doniger GM,Springer S,et al.A common cognitive profile in elderly fallers and in patients with Parkinson’s disease:the prominence of impaired executive function and attention[J].Exp Agin Res,2006,32(4):411-429.
[6]Sage MD,Bryden PJ,Roy EA,et al.The relationship between the grooved pegboard test and clinical motor symptom evaluation across the spectrum of Parkinson's disease severity[J].J Parkinsons Dis,2012,2(3):207-213.
[7]Cha YK,Kim YH,Ahn YH.Epidermal growth factor induces oxidative neuronalinjury in cortical culture[J].J Neurochem,2000,75(1):298-303.
[8]Iwakura Y,piao YS,Mizuno M,et al.Influcnces of dopaminergic lesion on epidermal growth factor ErbB signals in Parkinson’s disease and its model:neurotrophic implication in nigrostriatal ncurons[J].J Neurochem,2005,93(4):974-983.
[9]陳伶,劉衛國,趙燕燕,等.蒙特利爾認知評估量表在帕金森病認知障礙患者中的應用價值[J].中華神經科雜志,2011,44(3):200-202.
[10]郜風清,馮慶波,高潔,等 .頂、顳、枕葉白質在帕金森患者認知障礙發病中的測定價值[J].臨床合理用藥,2014,7(4A):131-132.
(收稿2015-02-12)
R742.5
A
1673-5110(2015)21-0041-03
獲2012年常州市科技局立項(編號CY 20120011)及2012年南京醫科大學科技發展基金重點項目立項(編號2012NJMU130)

