油橄欖鮮果中多酚提取工藝優化及不同成熟度含量變化分析
劉 露,鄧俊琳,王寒冬,丁春邦*,李 天
1 四川農業大學生命科學學院,雅安 625014;2 四川農業大學農學院,成都 611130
油橄欖(Olea europaea L.)是木犀科木犀欖屬常綠喬木,為世界著名油料作物,原產地中海沿岸國家[1]。中國從1956 年開始引種油橄欖,到2013 年栽植面積達到3 萬余公頃,主要分布于甘肅、四川以及云南西北部金沙江流域等地區[2]。油橄欖是一種油果兼用的獨特樹種,用鮮果榨取的橄欖油,是最為理想的健康食用油之一;用鮮果制成的果用油橄欖更是世界流行的高質量食品,營養成分保存完整,具有促消化、預防心血管疾病和抗腫瘤等多種功能[3]。植物多酚是一類廣泛存在于植物體內的天然大分子化合物,具有抗氧化、抗衰老、抗輻射、抗腫瘤、殺菌等多種生物活性[4,5]。多酚是油橄欖果的主要活性物質之一,其含量也是評價油橄欖制品的指標之一[6]。
目前植物多酚的提取方法主要有溶劑提取法、生物酶解提取法、微波輔助提取法、超臨界流體萃取法、膜技術提取法和超聲波輔助提取法等[7]。其中,超聲波輔助提取法是利用空化效應促進樣品和溶劑的分子運動,具有提取效率高、成本低、便于大規模生產等優點[8],現已廣泛應用于植物天然產物的提取[9,10]。因此,本試驗采用響應面法(response surface methodology,RSM)優化油橄欖果中多酚的超聲波輔助提取工藝,并分析8 個油橄欖品種5 個成熟度的多酚含量變化,為油橄欖果中多酚化合物的進一步研究提供一定的理論基礎。
1 材料與方法
1.1 材料與儀器
油橄欖鮮果于2014 年7~10 月采自四川西昌的北河油橄欖種植基地,共選取8 個品種(皮瓜爾、弗奧、克羅萊卡、卡林、鄂植、云臺、配多靈和科拉蒂)5 個成熟度,成熟度以果皮、果肉色澤區分[11],洗凈冷凍儲存備用。無水碳酸鈉、沒食子酸標準品、甲醇、福林酚顯色試劑溶液等。所有試劑均為分析純。
微量移液槍;BT-124S 電子天平,德國Sartorius公司;RM-220 試驗室超純水機,四川沃特爾科技發展有限公司;KQ-300GDV 恒溫數控超聲波清洗器,昆山舒美超聲儀器有限公司;高速冷凍離心機,德國Thermo 公司;UV-1750 分光光度計,日本島津公司。
1.2 試驗方法
1.2.1 油橄欖鮮果多酚提取
將冷凍的油橄欖果實去核,用液氮研磨至均勻粉末,迅速稱取0.5 g,加入80%甲醇進行超聲輔助提取,提取液高速冷凍離心(8000 rpm,4 ℃,10 min),收集上清液。
1.2.2 油橄欖鮮果多酚含量測定
多酚含量的測定采用Folin-Ciocalteu 法[12],稍加改進:取上清液100 μL,加3 mL 蒸餾水,再加0.2 mL 福林酚試劑混勻,約5 min 后加0.8 mL 10%的Na2CO3溶液混勻,避光反應1 h,于765 nm 檢測吸光值。以沒食子酸為標準品,標準曲線為Y=0.0029X,R2=0.9989,其中X 為沒食子酸質量濃度(μg/mL),Y 為吸光值。
多酚提取量(mg/g)=樣品液中多酚質量濃度×樣品液體積×1000/油橄欖粉末質量
1.2.3 單因素試驗
料液比分別以1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),于40 ℃的條件下超聲輔助提取30 min,探討料液比對油橄欖多酚提取量的影響;超聲時間分別以10、20、30、40、50 min,在料液比1∶20(g/mL)、40℃的條件下進行超聲輔助提取,探討超聲時間對油橄欖多酚提取量的影響;超聲溫度分別以20、30、40、50、60 ℃,在料液比1∶20(g/mL)的條件下超聲輔助提取30 min,探討超聲溫度對油橄欖多酚提取量的影響。
1.2.4 響應面法優化試驗設計
在單因素試驗結果的基礎上,選擇料液比(A)、超聲時間(B)、超聲溫度(C)為自變量,以油橄欖多酚提取量(Y)為響應值。根據Box-Behnken 的中心組合試驗設計原理[13],設計三因素三水平響應面試驗(表1),預測油橄欖多酚超聲輔助提取的最佳工藝。

表1 響應面分析因素及水平表Table 1 Factors and levels of RSM experiments
1.2.5 不同成熟度油橄欖鮮果多酚含量測定
采用優化的提取工藝,提取測定8 個品種5 個成熟度的油橄欖鮮果多酚含量,每個成熟度重復3次,以探討多酚含量在油橄欖果實不同成熟階段的變化。
1.2.6 數據處理
所有數據均為3 次重復試驗的平均值,應用Microsoft Excel 2010、SPSS 20.0、Design-Expert 8.0、Origin 9.0 對數據進行處理、分析和作圖。
2 結果與分析
2.1 單因素試驗
2.1.1 料液比對油橄欖多酚提取量的影響
由圖1A 可知,當料液比在1∶10~1∶30(g/mL)時,油橄欖多酚的提取量隨著料液比的增加而增加,當料液比達到1∶30(g/mL)時,多酚提取量達到最大值為5.6306 mg/g,之后隨著料液比增加多酚提取量緩慢下降。考慮到節約成本和后續濃縮工作,將優化料液比選為1∶20、1∶30、1∶40(g/mL)。
2.1.2 超聲時間對油橄欖多酚提取量的影響
由圖1B 可知,當超聲時間在10~30 min 時,油橄欖多酚的提取量隨著超聲時間的增加而增加,當超聲時間達到30 min 時,多酚提取量達到最大值為5.8970 mg/g,之后隨著超聲時間的增加多酚提取量迅速下降。這可能是因為超聲時間過長,引起多酚結構變化,從而導致提取量下降。因此,將優化超聲時間選為20、30、40 min。
2.1.3 超聲溫度對油橄欖多酚提取量的影響
由圖1C 可知,當超聲溫度在20~40 ℃時,油橄欖多酚提取量隨著超聲溫度的增加迅速增加,當超聲溫度達到40 ℃時,多酚提取量達到7.0496 mg/g;之后隨著超聲溫度的增加多酚提取量緩慢增加。考慮到多酚的穩定性和能耗等因素,將優化超聲溫度選為30、40、50 ℃。
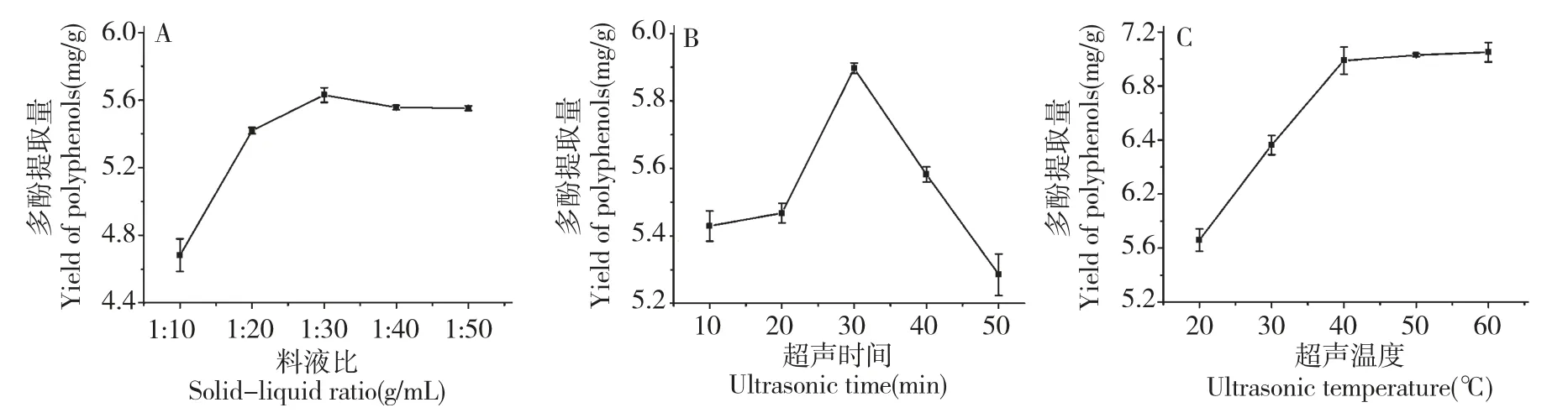
圖1 料液比(A)、超聲時間(B)及超聲溫度(C)對油橄欖多酚提取量的影響Fig.1 Effect of solid-liquid ratio(A),ultrasonic time(B)and ultrasonic temperature(C)on the extraction yield of polyphenols
2.2 響應面法優化油橄欖多酚提取工藝
2.2.1 響應面試驗設計與結果
以單因素試驗結果為基礎,根據Box-Behnken中心組合試驗設計原理,設計響應面試驗(表2)。利用Design-Expert 8.0 軟件對表2 中的試驗結果進行二次多元回歸擬合,得到油橄欖多酚提取量(Y)與料液比(A)、超聲時間(B)和超聲溫度(C)之間的回歸模型為:
Y=6.77+0.28A+0.16B+0.27C-0.037AB+0.19AC-0.18BC-0.86A2-0.37B2-0.22C2

表2 響應面試驗設計及結果Table 2 Results of response surface experiments

2.2.2 回歸模型方差分析與顯著性檢驗
利用Design-Expert 8.0 軟件對回歸模型進行方差分析(analysis of variance,ANOVA)(表3),結果顯示,模型極顯著(P<0.01),失擬項不顯著(P>0.05),相關系數R2=0.9755,說明該模型擬合度較好,可以用于預測超聲輔助提取油橄欖多酚的最佳工藝參數。另外,該模型的變異系數C.V 為2.38%,說明試驗結果重復性好、可信度高。
A、C、A2、B2 影響極顯著,B、AC、BC、C2影響顯著,因此,各因素對油橄欖多酚提取量的影響并不是簡單的線性關系。根據F 值的大小,可以得出三個因素對油橄欖多酚提取量的影響大小為料液比>超聲溫度>超聲時間。

表3 回歸模型方差分析和顯著性檢驗Table 3 Estimated regression coefficients and analysis of variance(ANOVA)for the model
2.2.3 響應面分析
根據試驗結果,利用Design-Expert 8.0 軟件作圖,得到三個因素交互作用的響應面和等高線圖(圖2),可直觀反映試驗因素的交互作用。由響應面圖可知,當超聲溫度為40 ℃時,油橄欖多酚提取量隨著料液比的增加先增加后減少,隨著超聲時間的增加先增加后趨于穩定(圖2A);超聲時間為30 min 時,油橄欖多酚提取量隨著料液比的增加先增加后減少,隨著超聲溫度的增加先增加后趨于穩定(圖2B);料液比為1∶30 g/mL 時,油橄欖多酚提取量隨著超聲時間和超聲溫度的增加逐漸增大(圖2C)。等高線的形狀可以反映交互作用的強弱,橢圓形表示交互作用顯著,而圓形則與之相反,同時閉合的橢圓形或圓形表示有最大值[14]。料液比和超聲時間的等高線呈圓形(圖2a),表明這兩者交互作用不顯著;料液比與超聲溫度以及超聲時間與超聲溫度的等高線呈橢圓形(圖2b 和2c),表明這些因素間的交互作用顯著;這與方差分析一致。
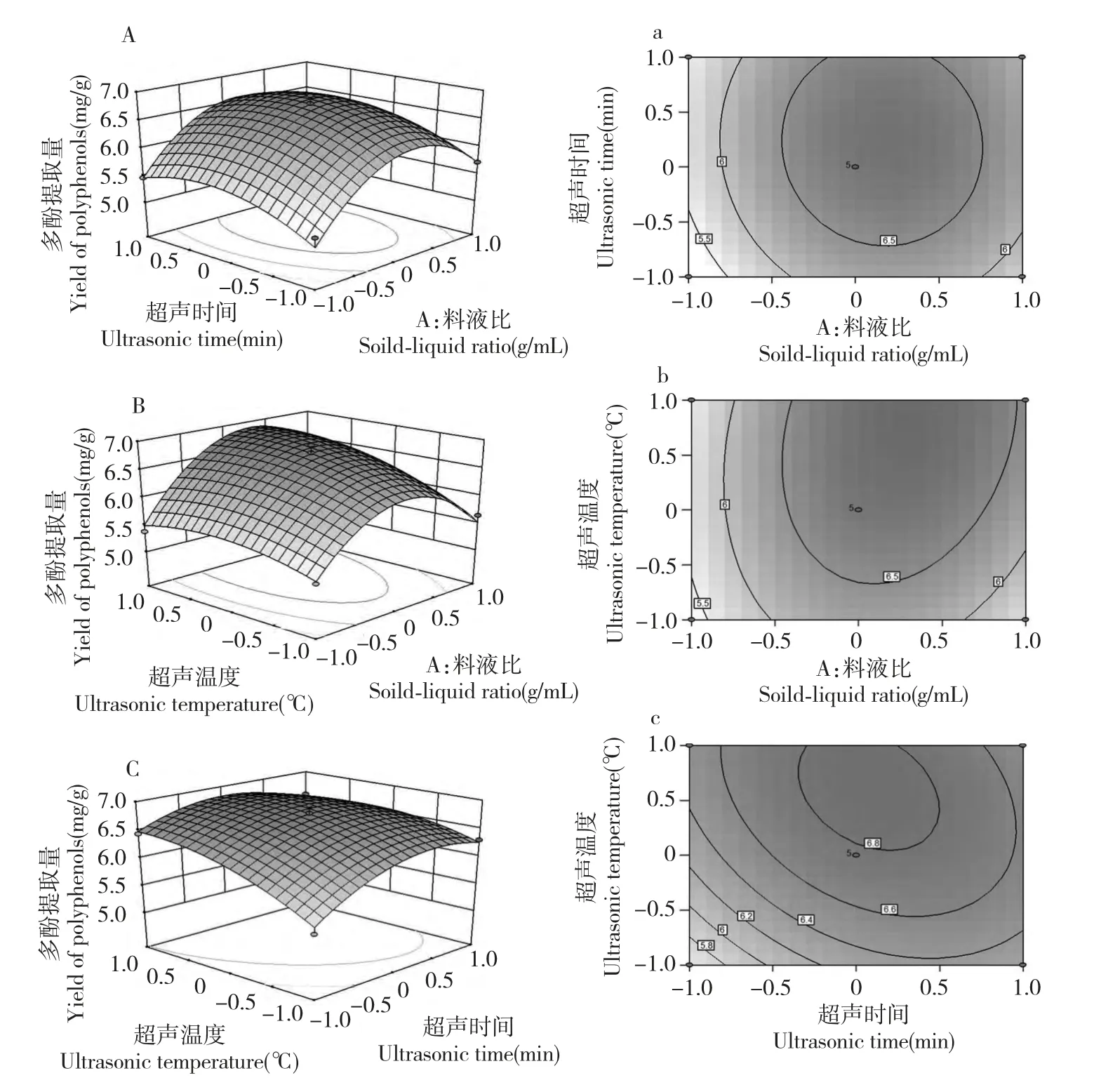
圖2 各因素間交互作用對多酚提取量影響的響應面(A、B 和C)及等高線圖(a、b 和c)Fig.2 Response surface plots(A,B and C)and contour plots(a,b and c)showing the effects of different factors on extraction yield of polyphenols
2.2.4 驗證試驗
通過響應面優化,得到超聲輔助提取油橄欖多酚的最佳工藝條件為料液比1∶22.4(g/mL)、超聲時間30.3 min、超聲溫度47.2 ℃,在此條件下油橄欖多酚提取量為6.9074 mg/g。
考慮到實際操作的可行性,將優化的工藝條件修改為料液比1∶22(g/mL)、超聲時間30 min、超聲溫度47 ℃,在此條件下進行3 次重復試驗,油橄欖多酚實際平均提取量為6.8145 mg/g,與預測值的相對誤差為1.35%。表明回歸模型擬合度高,可用于優化超聲輔助提取油橄欖多酚的工藝條件,具有實用價值。
2.3 不同成熟度油橄欖鮮果多酚含量的變化
油橄欖鮮果多酚含量因品種不同而有差異。從總體變化趨勢來看,第一成熟度油橄欖鮮果中多酚含量最高,之后隨著成熟度增加多酚含量逐漸下降,在第三成熟度達到最低,之后略有增加,最終趨于相對穩定(圖3)。8 個油橄欖品種鮮果中的多酚含量平均值從第一成熟度的17.1281 mg/g 減少到第三成熟度的5.6273 mg/g(降幅超過60%),之后小幅增長到第五成熟度的6.5807 mg/g。隨著油橄欖鮮果成熟度的增加,果肉中水解酶活性持續增強,導致橄欖苦甙含量的逐漸下降,而橄欖苦甙是油橄欖果肉中多酚的主要成分,其含量的變化將影響多酚含量[15]。這可能是油橄欖多酚含量從第一成熟度到第三成熟度逐漸下降的主要原因。油橄欖果實在第三成熟度后,花青素逐漸增加,果皮和果肉顏色逐漸變深,這可能是油橄欖后期成熟過程中多酚含量有所增加的原因[16,17]。油橄欖果中的多酚類物質的代謝是一個復雜的代謝途徑,需要更進一步的研究探索其代謝機制。
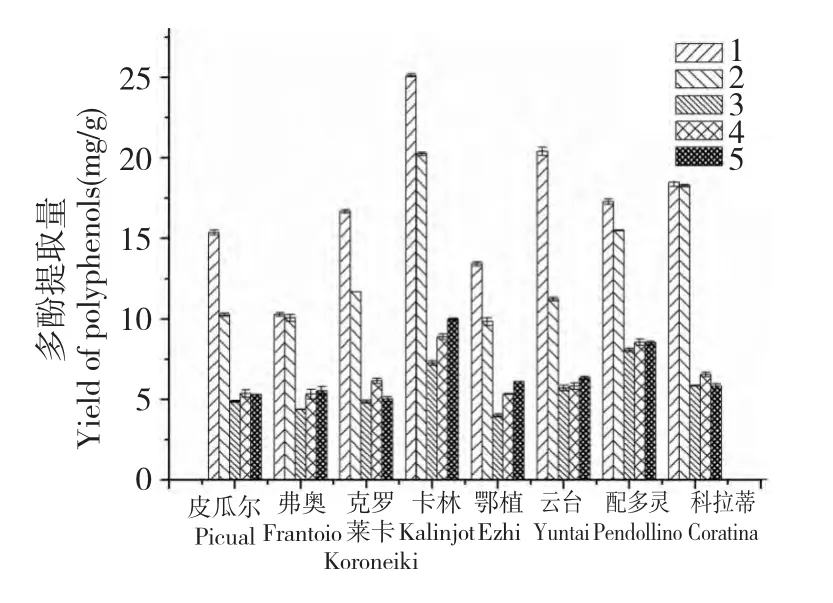
圖3 油橄欖不同品種果實中多酚提取量隨成熟度的變化Fig.3 Content variation on polyphenols of O.europaea fruits during different ripening stages
3 結論
本試驗以油橄欖鮮果為原料,甲醇為溶劑,經單因素試驗和響應面法優化,得到超聲輔助提取油橄欖鮮果中多酚的最佳工藝條件為料液比1∶22 g/mL、超聲時間30 min、超聲溫度47 ℃,在此條件下進行3 次平行重復試驗,得到油橄欖鮮果多酚實際平均提取量為6.8145 mg/g,與預測值的相對誤差為1.35%。說明模型擬合度好,提取工藝穩定可行,具有實用價值。
油橄欖鮮果多酚含量因品種不同而有差異,在總體變化趨勢上,第一成熟度油橄欖鮮果中多酚含量最高,之后隨著成熟度增加多酚含量逐漸下降,在第三成熟度達到最低,之后略有增加,最終趨于相對穩定。
1 Li JZ(李聚楨).The research of the development of the Chinese olive industry.Sci Tech Cereal Oil Food(糧油食品科技),2012,20:23-26.
2 Wang CZ(王成章),Chen Q(陳強),Luo JJ(羅建軍),et al.Development and industrial prospect of China’s olive.Biomass Chem Eng(生物質化學工程),2013,47:41-46.
3 Xu WY(徐緯英).Chinese Olive(中國油橄欖).Jilin:Changchun Publishing House,2001.230-242.
4 Manach C,Scalbert A,Morand C,et al.Polyphenols:food sources and bioavailability.Am J Clin Nutri,2004,79:727-747.
5 Arts ICW,Hollman PCH.Polyphenols and disease risk in epidemiologic studies.Am J Clin Nutri,2005,81:317S-325S.
6 Obied HK,Karuso P,Prenzler PD,et al.Novel secoiridoids with antioxidant activity from Australian olive mill waste.J Agric Food Chem,2007,55:2848-2853.
7 Pang DR(龐道睿),Liu F(劉凡),Liao ST(廖森泰),et al.Research progress and application of plant polyphenols compounds.Guangdong Agri Sci(廣東農業科學),2013,40:91-94.
8 Chen F,Sun Y,Zhao G,et al.Optimization of ultrasound-assisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry.Ultrason Sonochem,2007,14:767-778.
9 Wang J,Sun B,Cao Y,et al.Optimisation of ultrasound-assisted extraction of phenolic compounds from wheat bran.Food Chem,2008,106:804-810.
10 Khan MK,Abert-Vian M,Fabiano-Tixier AS,et al.Ultrasound-assisted extraction of polyphenols(flavanone glycosides)from orange(Citrus sinensis L.)peel.Food Chem,2010,119:851-858.
11 Dabbou S,Dabbou S,Chehab H,et al.Content of fatty acids and phenolics in coratina olive oil from Tunisia:influence of irrigation and ripening.Chem Biodivers,2015,12:397-406.
12 He ZY(何志勇),Xia WS(夏文水).Study on determination of polyphenol content in Canarium album(Lour.)rauesch.By Folin-Ciocalteucolorimetry.Chem Ind For Prod(林產化學與工業),2006,26:15-18.
13 Ferreira SLC,Bruns RE,Ferreira HS,et al.Box-Behnken design:an alternative for the optimization of analytical methods.Anal Chim Acta,2007,597:179-186.
14 Mao JX(毛俊霞),Zhang WJ(張文君),Li XM(李曦默),et al.Optimization of extraction conditions of resveratrol from grape surface methodology.Nat Prod Res Dev(天然產物研究與開發),2014,26:2027-2032.
15 Baccouri O,Guerfel M,Baccouri B,et al.Chemical composition and oxidative stability of Tunisian monovarietal virgin olive oils with regard to fruit ripening.Food Chem,2008,109:743-754.
16 Menz G,Vriesekoop F.Physical and chemical changes during the maturation of Gordal sevillana olives(Olea europaea L.,cv.Gordal Sevillana).J Agric Food Chem,2010,58:4934-4938.
17 Wang W(王偉),Ma YT(馬雨婷),Zhang T(張婷).Study on microwave extraction technology and stability of pigment from Xinjiang munage grape skin.China Condiment(中國調味品),2011,36:92-97.

