籽瓜多糖對H2O2致PC12 細胞氧化損傷的保護作用
劉 琴,宋 珅,郭 杰,羅 順,張 繼,2*
1 西北師范大學生命科學學院;2 甘肅特色植物有效成分制品工程技術研究中心;3甘肅萬州健順生物科技有限公司,蘭州 730070
由活性氧介導的氧化應激損傷在神經退行性疾病中起了至關重要的作用[1],H2O2是體內代謝產生的一種ROS,能夠與多種生物靶標分子(如DNA、蛋白、脂質)反應,可以透過細胞膜[2-4]。大鼠腎上腺髓質嗜鉻瘤細胞系PC12 廣泛用作研究氧化應激誘導的神經細胞損傷模型[5]。近年來,從天然產物中尋找具有清除自由基活性的物質用于保護細胞免受氧化損傷備受關注[6]。
籽瓜,葫蘆科,性溫,有暖胃祛寒、滋嫩肌膚、清腎排毒等功效,富含果酸、核黃酸、尼可酸等18 種氨基酸、維生素及多種微量元素,具有利尿、潤肺、健脾的功效因子,對糖尿病、肥胖癥也有輔助醫療作用,籽瓜人藥可作“白虎湯”藥引[7-9]。植物多糖是一類由單糖組成的天然高分子化合物,如人參、枸杞、蘆薈、牛膝、刺五加等均具有增強免疫力、抗腫瘤、降血糖、抗衰老、抗病毒作用等功能[10,11]。籽瓜多糖作為植物多糖的一種,已有報道其具有體外清除自由基的功效[12],但確切機制不明。本研究在此背景下,探討SWP 對H2O2誘導的PC12 細胞損傷的保護作用和機制。
1 材料與方法
1.1 材料
籽瓜,產地為甘肅靖遠,籽瓜切碎去除瓜子和瓜皮后粉碎得到籽瓜汁待用。
PC12 細胞購自昆明動物所。DMEM 粉末(Gibco);青霉素(華北制藥股份有限公司);鏈霉素(大連美羅大藥廠);胰蛋白酶(上海華美生物工程公司);CCK-8 試劑盒(武漢博士德有限公司);MTT(Sigma-Aldrich 公司);乳酸脫氫酶試劑盒(南京建成生物工程研究所),線粒體膜電位檢測試劑盒、ROS 活性檢測試劑盒和caspase-3、caspase-9 活性檢測試劑盒(碧云天生物技術研究所);8-OHdG 檢測試劑盒(上海欣美生物試劑公司);其他試劑均為國產分析純。
1.2 儀器
NJC03-2 型微波提取設備(南京匯研微波系統工程有限公司);TDL5M 型臺式大容量冷凍離心機(湘儀離心機廠);LGJ-185 型真空冷凍干燥機(北京松源華興科技發展有限公司);CO2細胞培養箱(Thermo Scientific);Vi-cell 細胞計數分析儀(Beckman);生物安全柜(力康生物醫療科技控股有限公司);倒置顯微鏡(OLYMPUS);SpectraMax M5多功能酶標儀(美國分子儀器有限公司);UV2450紫外分光光度計(上海美析儀器有限公司);熒光分光光度計(上海精密儀器有限公司),高速低溫離心機(Beckman);電子天平(天津市天馬儀器廠)。
1.3 實驗方法
1.3.1 籽瓜多糖的制備
取一定量的準備好的籽瓜汁,按照宋珅等[13]的方法分離和純化籽瓜多糖,苯酚硫酸法測得糖含量為93.1%,凝膠阻滯色譜法測得其分子量為121.3×105,GC-MS 法分析表明,SWP 由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖六種單糖組成,摩爾比為4.48∶13.14∶4.16∶7.82∶10.1∶60.3。
1.3.2 PC12 細胞傳代培養
用含10% 胎牛血清的DMEM 培養基培養PCI2細胞,按每毫升104個細胞接種到培養瓶中,在37℃5% CO2飽和濕度的條件下培養,每2 d 換一次液。細胞為上皮樣貼壁生長,傳代時加0.25%的胰蛋白酶2~3 mL,在顯微鏡下觀察待細胞消化至剛從培養瓶底部脫落,加入含血清的DMEM 培養基終止消化,用吸管輕輕吹打成單細胞懸液,按1∶3 每2~3 d 傳代一次,取對數生長期細胞用于實驗。
1.3.3 H2O2誘導PC12 細胞氧化損傷模型的建立
按照李朝暉等[14]的方法確定H2O2誘導PC12細胞凋亡的濃度和時間。細胞消化、計數、配制成濃度為5×104個/mL 的細胞懸液,接種于96 孔板中,每組設6 個復孔,置于37 ℃,5% CO2培養箱中培養24 h;棄去培養基,用培養基稀釋的不同濃度(100、300、500、700、1000 μmol/L)的H2O2處理細胞,設對照組,加入相同體積的不含H2O2的培養基,置于37 ℃,5% CO2培養箱中繼續培養1、2、4、8、12、24 h,吸出培養液,加入無血清新鮮培養液100 μL 和CCK-8 試劑10 μL,輕微震蕩5 min,37 ℃孵育2 h,于450 nm 處用多功能酶標儀測定各孔吸光度值,計算各組別細胞存活率。以對照組吸收度作為100%存活對照,不同組別吸光度值表示為對照組的百分比。
實驗組細胞存活率(%)=(A藥物-A空白)/(A對照-A空白)×100%
實驗組抑制率(%)=1-實驗組細胞存活率(%)
1.3.4 籽瓜多糖給藥劑量篩選
細胞消化,制成5×104個/mL 的細胞懸液,接種于96 孔,設立對照組(不加入SWP,但加入相同體積的培養基),籽瓜多糖組(3.125、6.25、12.5、25、50 mg/mL),每組設6 個復孔。將96 孔細胞培養板置于37 ℃,5% CO2培養箱中繼續培養24 h,吸出培養液,每孔加入無血清新鮮培養液100 μL 及CCK-8 試劑10 μL,輕微震蕩5 min,37 ℃孵育2 h,于450 nm 處用多功能酶標儀測定各孔吸光度值。計算不同濃度SWP 對細胞的抑制率。確定籽瓜多糖給藥劑量范圍,按照實驗分組進行如下實驗。以籽瓜多糖對細胞無毒性劑量范圍作為對細胞氧化損傷保護劑量范圍。
1.3.5 SWP 對H2O2損傷PC12 細胞活力的影響
按照上述方法處理細胞,待細胞貼壁后,加入不同濃度等體積的籽瓜多糖(10、25、50 mg/mL),每組設六個復孔,分別孵育12、24、48 h 后,加入終濃度為500 μmol/L 的H2O2,繼續孵育24h,MTT 法檢測細胞活率。
1.3.6 LDH 釋放量的檢測
[15]的方法,分組培養細胞,背景空白對照孔為無細胞的培養液,孵育結束后,取各孔上清120 μL 于新的96 孔板中,再加入60 μL LDH 檢測工作液,避光室溫孵育30 min 后,在490 nm 處測量吸光度值。
計算公式:LDH(%)=(A樣品-A空白)/(A對照-A空白)×100%
式中A樣品、A空白、A對照分別為樣品孔、空白對照孔和正常對照孔吸光度值。
1.3.7 胞內ROS 檢測
采用ROS(reactive oxygen species)敏感熒光探針DCFH-DA 檢測胞內ROS。細胞處理同1.3.5后,各孔加入DCFH-DA 至終濃度10μmol/L,于37℃繼續孵育4h,收集細胞,PBS 洗滌,制備單細胞懸液,加入1 mL 10 μmol/L 的DCFH-DA 無血清培養液,37 ℃孵育20 min。每3~5 min 顛倒混勻,使探針和細胞充分接觸。為除去未進入細胞內的DCFH-DA,需無血清培養基洗滌細胞三次,然后用熒光分光光度計測定(激發波長為488 nm,發射波長為521 nm)細胞內熒光強度。以對照組熒光強度為100%,其余各組與對照組熒光強度相比,計算胞內ROS 變化。
1.3.8 8-羥基脫氧鳥苷酶聯免疫分析
應用雙抗體夾心法測定8-羥基脫氧鳥苷(8-OHdG)水平。參照郭春燕[16]方法,通過標準品的稀釋與加樣—溫育—配液—洗滌—加酶—溫育—洗滌—顯色—終止—測定,嚴格按照8-OHdG 含量的檢測試劑盒說明進行操作。
1.3.9 線粒體膜電位的檢測
取對數生長期的PC12 細胞,消化后接種于6孔板中,培養24 h 后按照實驗分組加入不同濃度的SWP 孵育12、24、48 h,然后加入終濃度為500 μmol/L 的H2O2,繼續孵育24 h,收集細胞,離心,棄上清,加細胞培養液重懸細胞,加0.5 mL JC-1 染色工作液,渦旋混勻,37 ℃孵育20 min,然后4 ℃800×g 離心3 min,棄上清,用JC-1 染色緩沖液洗滌二次,200 μL 染色緩沖液重懸后,取100 μL 細胞懸液于96 孔板,多功能酶標儀檢測熒光強度,計算比值。
1.3.10 Caspase-3、caspase-9 酶活性的檢測
按照1.3.4 處理細胞,待細胞貼壁后,加入不同濃度等體積的籽瓜多糖(10、25、50 mg/mL),每組設六個復孔,孵育24 后,加入終濃度為500 μmol/L 的H2O2,繼續孵育24 h,收集細胞,加細胞裂解,重懸,冰浴裂解15 min。4 ℃16000×g 離心15 min。取上清,按照總體積100 μL 反應體系加入待測樣品10 μL,Ac-DEVD-pNA 和Ac-LEHD-pNA 底物10 μL 的比例測定分別測定caspase-3、caspase-9 的酶活性。
1.3.11 統計學處理
所有數據結果均為計量單位,應用SPSS 統計軟件,采用單因素方差分析,結果均以(±s)表示。P<0.05 認為有統計學差異。
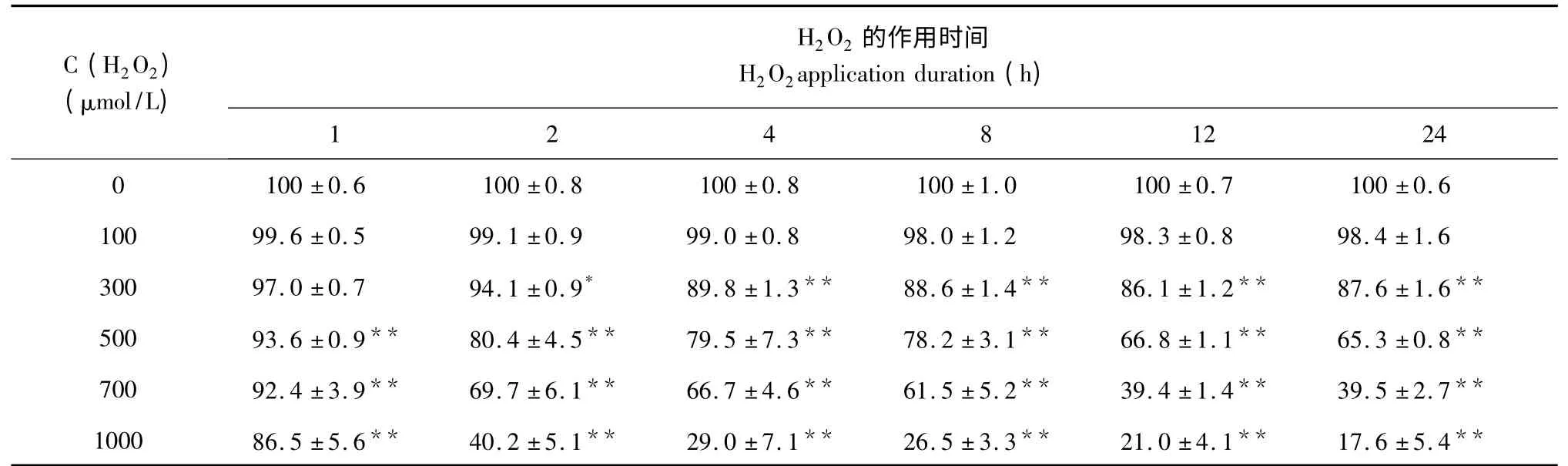
表1 不同濃度H2O2對PC12 細胞活率的影響(n=6)Table 1 Effect of different concentrations of H2O2on cell viability of PC12 cells(n=6)
2 結果與分析
2.1 H2O2誘導PC12 細胞損傷濃度和時間的確定
CCK-8 結果如表1 所示,H2O2終濃度為100 μmol/L 時對細胞沒有明顯的損傷作用(P>0.05),H2O2終濃度為500 μmol/L 以上時,作用2h 細胞活力明顯下降(P<0.01),細胞毒性相對于正常細胞顯著增強,抑制率達20%,到12 h 抑制率為33%,作用24 h,對PC12 細胞抑制率約為35%,此時細胞受損但不至于大量死亡,所以H2O2誘導細胞損傷的條件確定為500 μmol/L 損傷24 h。
2.2 SWP 單獨作用于PC12 對細胞增殖毒性的影響
采用CCK-8 法篩選SWP 對H2O2損傷保護劑量范圍,如圖1 所示,在所設置的五個濃度范圍內,SWP 單獨作用于PC12 細胞,對細胞基本無毒性,我們選定12.5、25、50 mg/mL 三個劑量來研究SWP 對H2O2損傷PC12 細胞的保護作用。

圖1 不同濃度SWP 對PC12 細胞活率的影響(n=6)Fig.1 Effect of different concentrations of H2O2on cell viability of PC12 cells(n=6)
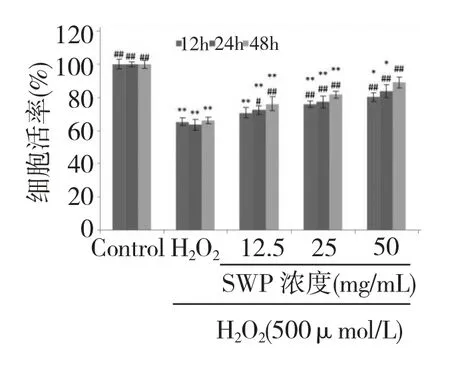
圖2 不同濃度的籽瓜多糖對H2O2損傷PC12 細胞存活率的影響Fig.2 Effect of different concentrations of SWP on H2O2-induced viability of PC12 cells
2.3 SWP 對H2O2損傷PC12 細胞活力的影響
如圖2 所示,與對照組相比,H2O2組的細胞活率明顯下降(P<0.01),與H2O2模型組相比,不同濃度(12.5~50 mg/mL)籽瓜多糖預處理后,能夠明顯改善H2O2引起的PC12 細胞存活率的降低(P<0.01),并且隨著作用時間和劑量濃度的增加,細胞存活率增加。說明籽瓜多糖,對H2O2損傷PC12 細胞的活力有一定的保護作用。
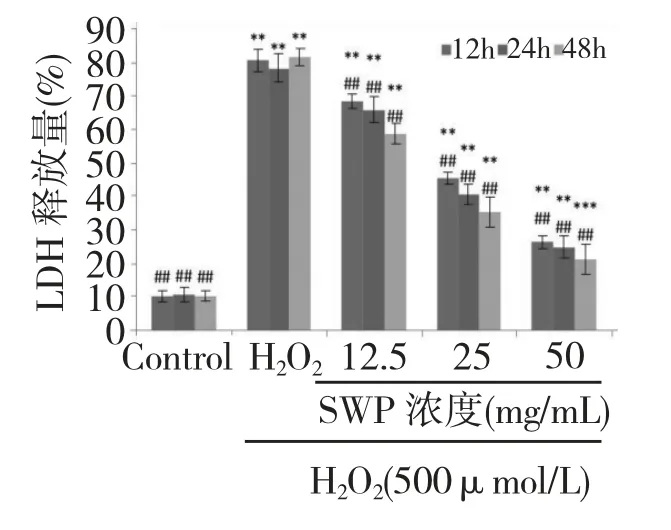
圖3 不同濃度的籽瓜多糖對H2O2損傷的PC12 細胞LDH 釋放量的影響Fig.3 Effect of different concentrations of SWP on LDH leakage of PC12 cells injured by H2O2
2.4 LDH 釋放量的檢測

圖4 不同濃度的籽瓜多糖對H2O2損傷的PC12 細胞內ROS 水平的影響Fig.4 Effect of different concentrations of SWP on H2O2-induced intracellular accumulation of ROS in PC12 cells
如圖3 所示,與對照組相比,H2O2明顯引起了PC12 細胞膜的損壞,使得模型組細胞內的LDH 大量外漏,而與模型組相比,加入籽瓜多糖預處理后,LDH 漏出量明顯降低(P<0.01),并且隨著SWP 濃度的升高和孵育時間的增加,LDH 釋放量減少,有一定的劑量和時間依賴性,表明SWP 能夠保護H2O2引起的細胞損傷。
2.5 SWP 對H2O2導致的細胞內ROS 水平的影響
如圖4 所示,采用DCFH-DA 熒光探針檢測胞內ROS 變化情況。與對照組相比,500μmol/L H2O2單獨作用PC12 細胞24 h 后DCF 熒光信號顯著增高(P<0.01),即ROS 水平增加;而SWP 組(12.5、25、50 mg/mL)劑量依賴地抑制H2O2導致的胞內ROS 水平的升高(P<0.05),并且隨著籽瓜多糖孵育時間的增加,這種抑制作用越明顯。表明SWP 能夠顯著抑制H2O2誘導PC12 細胞產生活性氧。

圖5 不同濃度的籽瓜多糖對H2O2損傷的PC12 細胞內ROS 水平的影響Fig.5 Effect of different concentrations of SWP on H2O2-induced 8-OHdG level in PC12 cells
2.6 SWP 對H2O2導致的細胞內8-OHdG 水平的影響
如圖5 所示,與對照組相比,500 μmol/L H2O2單獨作用PC12 細胞24 h 后,8-OHdG 水平顯著提高(P<0.01);而籽瓜多糖提前孵育12、24、48 h 后,8-OHdG 水平顯著降低(P<0.01),有一定的劑量依賴性和時間依賴性。表明SWP 能在一定程度上保護H2O2引起的細胞DNA 的損傷。

圖6 不同濃度的籽瓜多糖對H2O2損傷的PC12 細胞線粒體膜電位的影響Fig.6 Effect of different concentrations of SWP on mitochondrial membrane potential induced by H2O2in PC12 cells
2.7 SWP 對H2O2誘導的細胞線粒體膜電位的影響
如圖6 所示,與正常組相比,模型組中H2O2誘導的PC12 細胞線粒體膜電位明顯下降(P<0.01);與模型組相比,12.5、25、50 mg/mL SWP 提前孵育后,能夠抑制H2O2誘導的PC12 細胞線粒體膜電位下降(P<0.01),有一定的時間依賴性。

表2 籽瓜多糖對H2O2誘導的PC12 細胞的caspase-3、caspase-9 酶活性的影響(n=6)Table 2 Effect of SWP on activities of caspase-3,caspase-9 of H2O2-induced PC12 cells(n=6)
2.8 SWP 對H2O2誘導的細胞內caspase-3、caspase-9 酶活性的影響
如表2 所示,與對照組比較,模型組中PC12 細胞內caspase-3、caspase-9 酶的活性明顯增加(P<0.01);而預先加入不同劑量SWP(12.5、25、50 mg/mL)處理后,caspase-3、caspase-9 酶的活性明顯下降(P<0.05),在12.5~50 mg/mL 濃度范圍內有劑量依賴關系。表明SWP 可能通過影響Caspase 通路對H2O2誘導的PC12 起到了保護作用
3 討論
本研究為了探討SWP 對H2O2誘導的PC12 細胞損傷的保護作用和機制,首先采用CCK-8 對H2O2誘導的PC12 細胞損傷濃度和時間進行檢測。實驗結果表明500 μmol/L H2O2作用細胞24 h 后,細胞活力抑制率為35%,該濃度下細胞有一定比例凋亡,但又不至于大量死亡,所以本研究選用500 μmol/L H2O2造模。為了篩選合適的SWP 量,我們仍然采用CCK-8 方法,檢測SWP 單獨用藥對細胞無毒的劑量范圍。根據此實驗結果,確定了3 個劑量:12.5、25、50 mg/mL 對SWP 進行保護作用和機制的研究。
我們進行了DNA 損傷標志物8-OHdG 的檢測,結果表明,與正常組相比,H2O2誘導細胞損傷后8-OHdG 顯著增加僻;SWP 組與H2O2模型組相比,籽瓜多糖預孵育組8-OHdG 顯著降低。8-OHdG 是DNA 氧化損傷的重要標志物,ROS 是造成DNA 氧化損傷主要原因之一,進一步地我們檢測了ROS,檢測結果進一步證明了該劑量范圍內,SWP 的保護作用與清除活性氧,減輕DNA 損傷有關。細胞損傷時LDH 會釋放入培養液中,故其上清液中LDH 的濃度可反映出細胞的損傷程度,與正常對照組相比,H2O2能造成培養液中LDH 顯著提高;12.5~50 mg/mL SWP 能顯著降低H2O2誘導的LDH 的提高。
ROS 會通過多種途徑造成線粒體的損傷,我們推測一定劑量范圍內的SWP 對過氧化氫損傷的保護作用可能與線粒體途徑有關。于是我們測定了線粒體膜電位,結果表明12.5~50 mg/mL SWP 可以顯著的抑制H2O2造成的線粒體膜電位的下降。
Caspase 是一個在細胞凋亡過程中起重要作用的蛋白酶家族。Caspase-9 是細胞凋亡信號轉導過程中比較上游的一個Caspase,激活的Caspase-9 可以激活細胞凋亡的最關鍵酶Caspase-3,Caspase-3介導的蛋白剪切是細胞凋亡分子機制的重要組成部分。另外,Caspase-3 在細胞核凋亡過程中也起到了關鍵作用,包括染色質固縮,DNA 片段化等。為了探明Caspase 通路是否參與了SWP 對H2O2誘導PC12 的保護作用,我們檢測了 Caspase-3 和Caspase-9 活性。結果表明12.5、25、50 mg/mL SWP可以顯著抑制H2O2誘導的PC12 細胞Caspase-3 和Caspase-9 活性。
綜合以上結果分析12.5、25、50 mg/mL SWP 對H2O2誘導的PC12 細胞損傷具有保護作用,其機制可能與清除ROS,減輕DNA 氧化損傷,抑制線粒體膜電位下降,抑制誘導細胞凋亡的Caspase 通路的激活有關。研究結果提示,SWP 在一定劑量范圍內對于氧化應激相關的神經退行性疾病的治療可能有效。
參考文獻
1 Friedlander RM.Apoptosis and caspases in neurodegenerative diseases.N Engl J Med,2003,348:1365-1375.
2 Zhang HA,Gao M,Zhang L,et al.Salvianolic acid A protects human SH-SY5Y neuroblastoma cells against H2O2-induced injury by increasingstress tolerance ability.Bioc Bioph Res Com,2012,231:479-483.
3 Rhee SG.H2O2,a necessary evil for cell signaling.Science,2006,312:1882-1883.
4 Chen HY(陳紅艷),Di M(耿淼),Hu YZ(胡亞卓),et al.Effects of hydrogen peroxide on SH-SY5Y cell mitochondrial membrane potential.Int J Lab Med(國際檢驗醫學雜志),2011,32:1665-1667.
5 Li WW(黎巍威),Wang XM(王學美).Advances in cellular oxidative stress in PC12 cells as a model.Chin J Med(中國中西醫結合雜志),2011,48:128-132.
6 Kwon SH,Kim JA,Hong SI,et al.Loganin protects against hydrogen peroxide-induced apoptosis by inhibiting phosphorylation of JNK,p38,and ERK 1/2 MAPKs in SH-SY5Y cells.Neu Int,2011,58:533-541.
7 Li JW(李金王),Sun XW(孫曉偉),Yang LS(楊來勝).et al.Lanzhou Watermelon.Chin Veg(中國瓜菜),2007,13(2):8-9.
8 Gansu Horticultural Society of Professional Committee of melons(甘肅省園藝學會瓜類專業委員會).Opinions on black watermelon production and research to define some of the terms of the standard.Chin Veg(中國瓜菜),2006,23(2):31-33.
9 Ma GC(馬成廣).Chinese Native(中國土特產大全).Watermelon and Lanzhou Tracts,1986.313-314.
10 Franz G.Polysaccharides in pharmacy:current applications and future concepts.Planta Med,1998,55:493-497.
11 Chen X(陳旋),Zhang Y(張翼),Zhang JB(張劍波).Research advances in plant polysaccharides.Flavonoids from Lycoris aurea.Nat Prod Res Dev(天然產物研究與開發),2005,17:539-541.
12 Wang CP(王翠平).Research on antitumor activity and oxidation resistant of watermelon.Anhui Agric Sci(安徽農業科學),2011,29:17833-17836.
13 Song S(宋珅),Zhao BT(趙寶堂),Yin ZX(殷振雄),et al.Separation of watermelon extract polysaccharides andmonosaccharide composition analysis by GC-MS.Food Ferment Ind(食品與發酵工業),2013,22:212-224.
14 Li ZH(李朝暉),Wang F(王芬),Liu SP(劉水平),et al.The establishment of PC12 cell injury induced by hydrogen peroxide model.J Forensic Med(法醫學雜志),2007,35(3):41-46.
15 Cao BY,Yang YP,Luo WF,et al.Paeoniflorin,a potent natural compound,protects PC12 cells from MPP+and acidic damage via autophagic pathway.J Ethnopharmacol,2010,131:122-129.
16 Guo CY(郭春燕).Study of several active ingredients of traditional Chinese medicine on H2O2-induced oxidative damage in SH-SY5Y cell mechanism.Shijiazhuang:Hebei Medical University(河北醫科大學),PhD.2013.

