健脾生血顆粒對腎性貧血模型大鼠的治療作用
譚靜玲, 趙 剛 , 呂承恬, 熊富良, 陳 興, 張雪瓊
(1. 湖北省食品藥品監督檢驗研究院,湖北 武漢430064;2. 健民藥業集團兒童藥物研究院,湖北 武漢430052;3. 武漢理工大學化學化工與生命科學學院,湖北武漢430070)
腎性貧血主要是由于促紅細胞生成素減少所致,中醫視為腎精不足。而健脾生血顆粒具有健脾填精、益氣養血之功效,因此,基于精血同源理論,健脾生血顆粒可能對治療腎性貧血有效果,但需要通過動物實驗進行驗證。本實驗通過建立腎性貧血模型,旨在考察健脾生血顆粒對腎性貧血大鼠模型的治療效果,為健脾生血顆粒的二次開發提供參考。
1 材料
1.1 動物 Wistar 大鼠50 只(SPF 級),購自湖北省實驗動物研究中心,合格證號SCXK2008-0005。于實驗前飼養3 d 以適應本實驗動物室環境后稱量,大鼠體質量為180 ~220 g。
1.2 試劑 健脾生血顆粒(生產批號20131211,武漢健民藥業集團股份有限公司,相當于生藥0.36 g +硫酸亞鐵0.02 g/g);健脾生血浸膏(原處方中藥部分,相當于生藥材3.27 g/g);六水合硫酸亞鐵(生產批號20130116,國藥集團化學試劑有限公司)。
1.3 儀器 紫外分光光度計(SP-1920,上海光譜儀器有限公司);電子稱(JS-S,昆山天金崗金屬制品有限公司);離心機(TGL-16,常州市萬合儀器制造有限公司);電子天平(FA2004,上海方瑞儀器有限公司);全自動血液分析儀(美國庫爾特);自動生化分析儀(CXT,美國貝克曼);酶標儀(BIO-BAD BECHMARK)。
2 實驗方法
2.1 造模與給藥 大鼠經適應性飼養3 d,腺嘌呤[1]用去離子水配制3%的混懸液,灌胃劑量為10 mL/kg,每天1次,連續灌胃6 周,制作腎性貧血模型[2-4]。依據動物劑量換算表設定,實驗組大鼠等效劑量為人用劑量的6.3 倍,各組給藥劑量按照下列公式計算。健脾生血組給藥量=6.3 ×0.214 ×大鼠體質量(按成人70 kg 計,每天劑量為15 g,成人每天服藥劑量為0.214 g/kg);健脾生血浸膏組給藥量=6.3 ×0.214 ×0.11 ×大鼠體質量(每克顆粒相當于浸膏0.11 g);硫酸亞鐵組給藥量=6.3 ×0.214 ×0.0198 ×大鼠體質量;正常對照組和模型組給予等劑量的0.9%氯化鈉溶液,每只大鼠給藥2 mL。6 周后,眼眶采血測定血象指標,實驗組的血象指標均顯著低于正常對照組水平,即顯示造模成功。
2.2 樣本采集和指標測定
2.2.1 血象指標 分別于灌胃給藥前后眼眶采血2 mL,采用全自動血液分析儀檢測RBC、HGB、HCT。
2.2.2 血清中促紅細胞生成素 (EPO)的測定 按照ELISA 試劑盒操作說明進行EPO 的[5]測定。取大鼠眼眶血收集于離心管中,將裝有血液的離心管橫在實驗臺,于室溫下自然凝固,再放入冰箱4 ℃下凝固,離心。仔細收集上清。檢查上清液如果仍有紅色沉淀,應吸取上清液再次離心[6-8]。
2.2.3 腎功能檢查 眼眶采血后,采用Beckmann 自動生化分析儀測定BUN 及Cr[9-12],進行腎功能檢查。
2.2.4 紅細胞脆性試驗 麻醉后處死大鼠,眼眶取血,立即取0.9%氯化鈉、0.44%氯化鈉和純水各2.5 mL,分別加入全血50 μL 混勻,離心,取上清液在紫外分光光度法波長575.2 nm 處測定,計算紅細胞溶解率[13]。
2.3 統計學處理 采用SPSS 19.0 軟件對數據進行處理,以±s 表示,各組之間比較采用單因素方差分析(one-way ANOVA)檢驗,以P <0.05 為有顯著性差異。
3 實驗結果
3.1 對大鼠血液學指標的影響
3.1.1 對外周血紅細胞(RBC)的影響 造模6 周后,與正常對照組相比,其余組RBC 水平顯著較低(P <0.05),即示造模成功。灌胃給藥后,除模型組外,其余各組RBC水平均顯著上升(P <0.05),且健脾生血顆粒組和健脾生血浸膏組恢復至正常對照組水平。硫酸亞鐵組RBC 水平有所恢復但尚未恢復到正常水平。健脾生血顆粒組明顯高于其他各組(見表1)。
3.1.2 對大鼠血紅蛋白(HGB)的影響 造模后,與正常對照組比較,其余組明顯低于正常對照組(P <0.05)。給藥后,各組水平均有上升,且各組間差別顯著 (P <0.05)。硫酸亞鐵組有所上升但尚未恢復到正常水平(見表1)。
3.1.3 對大鼠紅細胞比容(HCT)的影響 造模后,除正常對照組外,各組HCT 水平顯著下降,(P <0.05)。給藥后,除硫酸亞鐵組外,其余各組與正常對照相比均顯著升高(P <0.05)。各組間相比,HCT 差異顯著,具有統計學意義(P <0.05)。健脾生血顆粒組效果明顯高于健脾生血浸膏組和硫酸亞鐵組,升高情況有顯著性差別(P <0.05)(見表1)。
表1 大鼠給藥后對血常規的影響(±s,n=8)
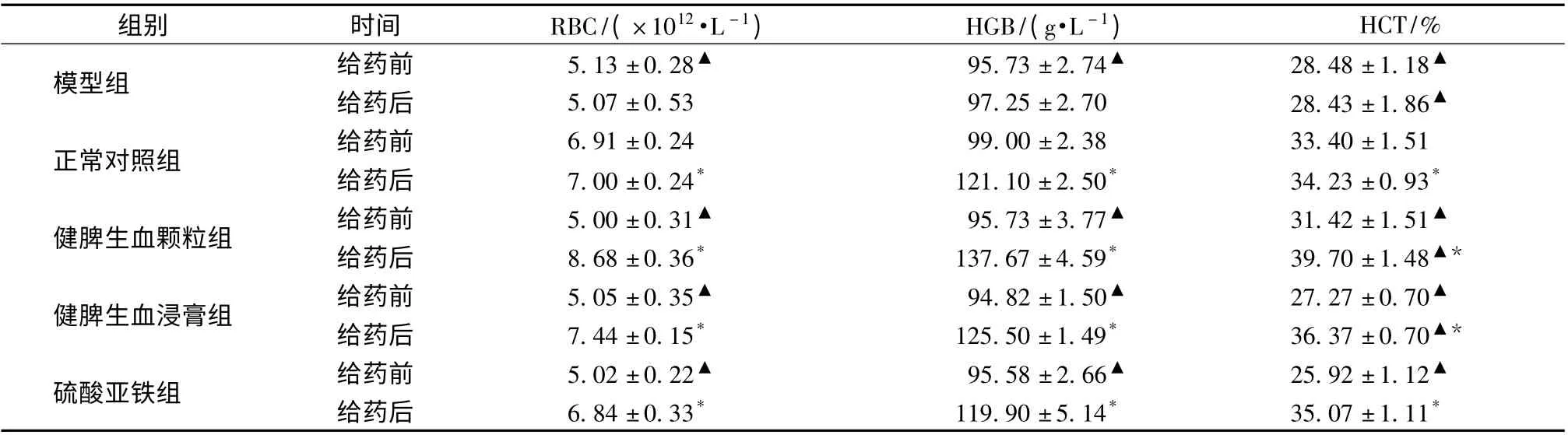
表1 大鼠給藥后對血常規的影響(±s,n=8)
注:與正常對照組比較,▲P <0.05,與模型組比較,*P <0.05
組別 時間 RBC/(×1012·L -1) HGB/(g·L -1) HCT/%模型組 給藥前 5.13 ±0.28▲ 95.73 ±2.74▲ 28.48 ±1.18▲給藥后 5.07 ±0.53 97.25 ±2.70 28.43 ±1.86▲正常對照組 給藥前 6.91 ±0.24 99.00 ±2.38 33.40 ±1.51給藥后 7.00 ±0.24* 121.10 ±2.50* 34.23 ±0.93*健脾生血顆粒組 給藥前 5.00 ±0.31▲ 95.73 ±3.77▲ 31.42 ±1.51▲給藥后 8.68 ±0.36* 137.67 ±4.59* 39.70 ±1.48▲*健脾生血浸膏組 給藥前 5.05 ±0.35▲ 94.82 ±1.50▲ 27.27 ±0.70▲給藥后 7.44 ±0.15* 125.50 ±1.49* 36.37 ±0.70▲*硫酸亞鐵組 給藥前 5.02 ±0.22▲ 95.58 ±2.66▲ 25.92 ±1.12▲給藥后 6.84 ±0.33* 119.90 ±5.14* 35.07 ±1.11*
3.2 對大鼠EPO 的影響 給藥后,取大鼠眼眶血收集于離心管中,將裝有血液的離心管橫在實驗臺,自然凝固,再放入4 ℃下凝固,離心。收集上清。檢查上清液若仍有紅色沉淀,應吸取上清液再次離心。健脾生血顆粒組大鼠EPO 的量低于正常對照組,但顯著高于健脾生血浸膏組和硫酸亞鐵組(P <0.05),各組大鼠EPO 含有量見表2。
表2 大鼠給藥后對EPO 的影響(±s,n=8)
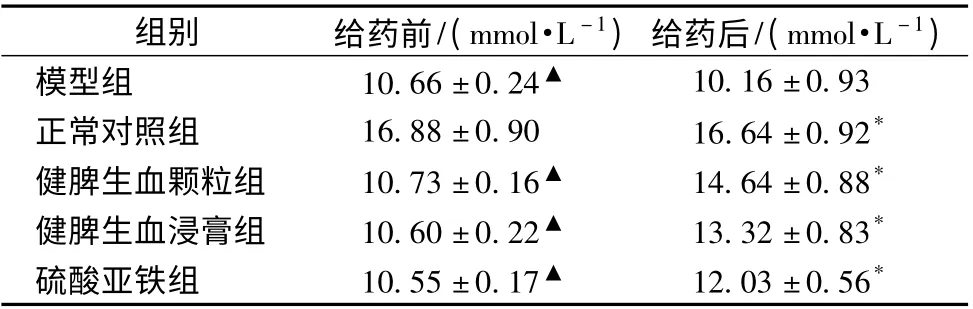
表2 大鼠給藥后對EPO 的影響(±s,n=8)
注:與正常對照組比較,▲P <0.05;與模型組比較,* P <0.05
組別 給藥前/(mmol·L -1)給藥后/(mmol·L -1)模型組 10.66 ±0.24▲ 10.16 ±0.93正常對照組 16.88 ±0.90 16.64 ±0.92*健脾生血顆粒組 10.73 ±0.16▲ 14.64 ±0.88*健脾生血浸膏組 10.60 ±0.22▲ 13.32 ±0.83*硫酸亞鐵組 10.55 ±0.17▲ 12.03 ±0.56*
3.3 對大鼠腎功能的影響 給藥后,除模型組外,各組大鼠BUN 的量均有所下降,提示三組大鼠腎功能均有所恢復。三組間BUN 的量存在統計學差異,其中健脾生血顆粒組BUN 的量最低,健脾生血浸膏組、硫酸亞鐵組稍高,但均未降低到正常對照組水平。大鼠肌酐(Cr)水平變化趨勢與BUN 變化趨勢基本吻合。進一步印證了大鼠腎功能的變化。大鼠BUN、Cr 的量如表3、表4。
3.4 對大鼠紅細胞脆性的影響 麻醉后處死大鼠,眼眶取血,立即取0.9%氯化鈉、0.44%氯化鈉和純水各2.5 mL,分別加入全血50 μL 混勻,離心,取上清液在紫外分光光度法波長575.2 nm 處測定,計算紅細胞溶解率。大鼠通過灌胃健脾生血顆粒和健脾生血浸膏恢復至正常水平。雖然硫酸亞鐵組大鼠紅細胞溶解率未恢復到正常值,但給藥后仍降低,接近正常值。見表5。
表3 大鼠給藥后對BUN 的影響(±s,n=8)

表3 大鼠給藥后對BUN 的影響(±s,n=8)
注:與正常對照組比較,▲P <0.05;與模型組比較,*P <0.05
組別 給藥前/(mmol·L -1)給藥后/(mmol·L -1)模型組 26.71 ±5.44▲ 26.05 ±6.74正常對照組 10.37 ±0.59 10.40 ±0.61*健脾生血顆粒組 25.13 ±5.41▲ 11.87 ±2.04*健脾生血浸膏組 26.23 ±4.99▲ 16.00 ±2.89*硫酸亞鐵組 25.39 ±5.52▲ 17.56 ±2.27*
表4 大鼠給藥后對Cr 的影響(±s,n=8)

表4 大鼠給藥后對Cr 的影響(±s,n=8)
注:與正常對照組比較,▲P <0.05;與模型組比較,*P <0.05
組別 給藥前/(μmol·L -1)給藥后/(μmol·L -1)模型組 140.17 ±11.14▲ 144.89 ±11.26正常對照組 76.77 ±8.86 79.54 ±8.26*健脾生血顆粒組 141.90 ±11.28▲ 90.90 ±6.57*健脾生血浸膏組 143.47 ±10.56▲ 101.22 ±7.18*硫酸亞鐵組 141.57 ±8.93▲ 112.88 ±6.24*
4 討論
本實驗考察腎性貧血大鼠給藥前后血象指標(RBC、HGB、HCT)、EPO、腎功能指標(BUN、Cr)、紅細胞脆性,給藥后,除模型組外,實驗組三組大鼠的外周血象指標水平均已基本恢復至正常對照組水平,且健脾生血顆粒組、健脾生血浸膏組和硫酸亞鐵組間血象指標水平存在顯著差異。健脾生血顆粒效果優于其余兩組。由此可見,健脾生血顆粒能明顯提高EPO 的量,降低BUN、Cr 的量,有效治療大鼠腎性貧血并能改善腎功能,并可降低紅細胞脆性。健脾生血顆粒中的中藥浸膏部分和硫酸亞鐵部分均可改善腎性貧血,但單獨使用效果不如健脾生血顆粒,可以初步推測,健脾生血顆粒中藥部分與硫酸亞鐵協同作用于腎性貧血大鼠的治療。
表5 大鼠給藥后對紅細胞溶血率的影響(±s,n=8)

表5 大鼠給藥后對紅細胞溶血率的影響(±s,n=8)
注:與正常對照組比較,▲P <0.05;與模型組比較,* P <0.05
組別 給藥前/% 給藥后/%模型組 64.50 ±2.37▲ 64.20 ±1.90正常對照組 53.45 ±2.78 53.87 ±2.34*健脾生血顆粒組 64.03 ±1.97▲ 54.07 ±6.15*健脾生血浸膏組 64.97 ±2.12▲ 54.27 ±4.99*硫酸亞鐵組 64.55 ±2.50▲60.95 ±2.14
[1] 董志剛,馬曉燕,姚春雷,等. 溫腎益精降濁法方藥治療腺嘌呤致大鼠腎性貧血的實驗研究[J]. 中國中醫藥科技,2010,17(4):302-303.
[2] 張曉東,宋保利,方敬愛,等. 活血復腎膠囊對慢性腎衰竭大鼠腎性貧血的影響[J]. 中國中西醫結合腎病雜志,2006,7(5):267-268.
[3] 陳 新,張 麗,羅分平. 丹芍湯對大鼠腎性貧血的治療作用[J]. 中華中醫藥學刊,2010,28(5):1086-1087.
[4] 李 靖,吳云霞,王 晶. 鬼針草治療大鼠腎性貧血的實驗研究[J]. 中西醫結合研究,2009,1(5):233-235.
[5] 劉茂玄,羅 潔,王東亮,等. 復方阿膠漿對腎性貧血大鼠的治療作用及其機制[J]. 中草藥,2014,45(3):380-381.
[6] 汪 軍,鄭佳新,張春戩. 腎血康對腎性貧血大鼠外周血象與紅細胞脆性及EPO 含量的影響[J]. 中國中西醫結合腎病雜志,2004,5(4):195-196.
[7] 劉海虹,何學紅. 補腎生血顆粒對實驗性慢性腎衰大鼠血EPO 及TNF 的影響[J]. 遼寧中醫藥大學學報,2006,8(4):137-138.
[8] 袁 鋼,魏連波,李玉明,等. 腎衰養真膠囊對腎衰貧血大鼠及EPO 基因表達的影響[J]. 中成藥,2005,27(7):836-837.
[9] 李永新,孟陸亮,張延英,等. 益氣化濕膠囊對腺嘌呤腎衰大鼠BUN、SCr 及造血功能的影響[J]. 中醫研究,2010,23(5):17-18.
[10] 曾海飛,何澤云,徐 琴,等. 六味地黃湯對5/6/腎切除大鼠肌酐、尿素氮及24 h 尿蛋白定量的影響[J]. 湖南中醫雜志,2013,29(8):114 -115.
[11] 郭冰云,徐美華,許浩彬. 不同光照制對大鼠血清尿酸、尿素氮、肌酐含量晝夜節律的影響[J]. 福州醫科大學學報,1998,32(2):136-137.
[12] 李香蘭,祁海峰,劉 凱,等. 黃芪水提取液對運動后小鼠肌糖原和血清中肌酐含量的影響[J]. 延邊大學醫學學報,2009,32(4):235-236.
[13] 李利根,郭振榮,趙 霖,等. 補鋅對燙傷大鼠血清鋅、鐵和紅細胞脆性的影響[J]. 軍醫進修學院學報,1999,20(1):32-33.

