補陽還五湯對大鼠肌源性干細胞體外生長分化的影響
郭占鵬, 劉 堃, 黃米娜, 王巖松, 袁亞江, 郭 躍, 劉安琪, 梅晰凡*
(1. 遼寧醫學院附屬第一醫院,遼寧 錦州121001;2. 遼寧醫學院護理學院,遼寧錦州121001;3. 遼寧醫學院,遼寧錦州121001)
在以往的研究中發現肌源性干細胞有向軟骨細胞、神經細胞、肌肉細胞分化的潛能[1-2]。相關研究和臨床實踐證明,補陽還五湯可以改善脊髓損傷后大鼠的功能[3]。因此推斷是否補陽還五湯具有通過調節微環境促進多潛能干細胞向神經細胞分化的可能。據此將體外培養的肌源性干細胞分為對照組及補陽還五湯含藥血清組,研究補陽還五湯對肌源性干細胞體外生長分化的影響。
1 材料和方法
1.1 材料
1.1.1 試驗動物 清潔級SD 大鼠,體質量(100 ±5)g,雌雄不限,隨機分為對照血清組和藥物血清組,各30 只。所有大鼠均由遼寧醫學院動物實驗中心提供(許可證號SCXK [遼]2003-2007)。
1.1.2 試驗試劑及儀器 補陽還五湯由黃芪、當歸、赤芍、地龍、川芎、紅花、桃仁(飲片)組成,各成分比例為20 ∶3 ∶3 ∶3 ∶3 ∶2 ∶3。生藥由遼寧醫學院附屬第一醫院藥劑科一次性購買后水煎2 次,合藥后濃縮至0.8 g/mL,過濾除菌后分袋包裝,冷凍保存備用。Ⅱ型膠原酶(Sigma);Ⅱ型分散酶(Sigma);高糖DMEM 培養基(Gibco 公司);兔抗大鼠Desmin、神經元特異性烯醇化酶(NSE)、膠質纖維酸性蛋白(GFAP)抗體購自北京中杉金橋公司。
1.2 實驗方法
1.2.1 含藥血清制備 藥物血清組大鼠每日灌服濃縮中藥湯劑4 mL/次,藥物劑量按照3 g/kg (劑量按照成人體表面積的2 倍計算),早晚各1 次,連續給藥3 d,對照血清組每天灌服相同劑量生理鹽水。末次給藥4 ~6 h 內采尾血2 mL,靜置3 h 后離心分離血清,56 ℃滅活30 min,-20 ℃冷凍備用。
1.2.2 原代MDSCs 的分離純化培養 無菌條件下取新生1 ~3 d 的SD 乳鼠四肢肌肉組織,剔除脂肪、肌腱等組織后應用混合酶(含有Ⅱ型膠原酶2 g/L、Ⅱ型分散酶4.8 g/L、CaCl20.28 g)消化約60 min 后終止消化,經過濾離心后去上清,加入DMEM 培養液重懸細胞,移入培養瓶中,采用差速貼壁法分離純化肌源性干細胞,細胞在達到約70% ~80%匯合時傳代培養。
取傳代后生長狀態良好的細胞,載入24 孔板(約1 ×104細胞),隨機分為2 組(對照血清組和含藥血清組),每組10 孔,每孔加入培養液1 mL,37 ℃、5% CO2溫箱中培養7 d。倒置相差顯微鏡下觀察2 組細胞形態變化。
1.2.3 免疫熒光法檢測 在含有細胞懸液的培養皿中放入蓋玻片,將培養皿放入5%CO2培養箱,每天換液,培養2 ~3 d,多聚甲醛(4%)固定25 ~30 min;Triton -100(0.3%)作用5 min,H2O2(3%)作用20 ~30 min;加封閉液20 min,去除多余液體,不需漂洗,滴加一抗4 ℃過夜;繼續滴加二抗(1 ∶100 稀釋)作用2 h;SABC 30 min;DAB 試劑盒顯色作用30 min;蘇木素染色0.5 min;梯度酒精(75% →85% →95% →100%)脫水,脫水時間4 min/次。二甲苯Ⅰ滴定10 min,二甲苯Ⅱ滴定10 min。緩沖甘油封片,無熒光指甲油封4 周。
1.2.4 Western blot 檢測蛋白表達 采集肌源性干細胞和分化的神經樣細胞,采用2 ∶1 的裂解液 (RIPA + 1%PMSF)裂解充分,4 ℃條件下12 000 r/min 離心20 min。以牛血清白蛋白(BSA)為對照 品,用BCA 法測定蛋白質含有量,按得出的蛋白量(蛋白樣品TBS、RSB)加入無菌EP 管,加樣,沸水煮4 min,降溫后放入-20 ℃冰箱,保存試驗備用。
采用經典SDS-PAGE 法(12%)分離蛋白質,每個點樣孔的蛋白上樣量為20 μg。凝膠電泳結束后將PAGE 膠體中的蛋白質電轉移至硝酸纖維素膜上,將膜放入3%(m/V)BSA 阻斷緩沖液中,封閉條件60 min,用TBS 緩沖液(10 mmol/L Tris (pH 8.0)、150 mmol/L NaCl)洗膜3次,清洗條件10 min/次。將膜放入兔抗大鼠Hes1 一抗中(抗體1 ∶500 稀釋),4 ℃過夜。TTBS (含0.05% Tween 20)緩沖液低溫沖洗3 次后,室溫條件下將膜放入含有辣根過氧化酶標記的羊抗兔IgG 二抗中孵育1 ~2 h,繼續用TTBS[1 L TBS 緩沖液中加入0.5 mL Tween 20 (0.05%)]洗膜3 次,清洗條件5 min/次,TTBS 沖洗后,將膜放入二抗中,室溫搖床上孵育1 h,再用TTBS 洗膜3 次/5 min 后,倒掉洗膜液,甩去多余液體,轉膜時與膠相鄰的一面向上鋪于玻璃板上。將ECL 試劑盒內的detection reagent 1 與detection reagent 2 等體積混合后,均勻滴在PVDF 膜上,反應1 ~2 min,上機檢測。
表達相對水平=[(實測灰度值/β -actin)/(對照組灰度值/β-actin)的均數]×100%
2 結果
2.1 細胞形態學觀察 培養7 d 后,兩組細胞均貼壁生長,狀態良好。對照血清組細胞與分離純化后細胞相似,多數呈紡錘狀或梭形生長。含藥血清組細胞胞漿出現長突起,類似神經細胞的神經突起,細胞突起間相互融合,但是并未出現典型的神經球(圖1)。
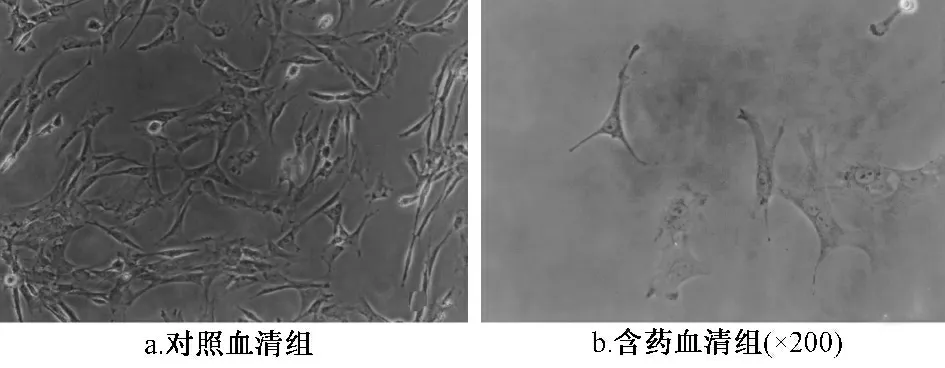
圖1 細胞形態學觀察
2.2 免疫熒光檢測 NSE 和GFAP 在對照血清組細胞胞漿內可見少量表達,而其在含藥血清組細胞內可見高表達(圖2)。
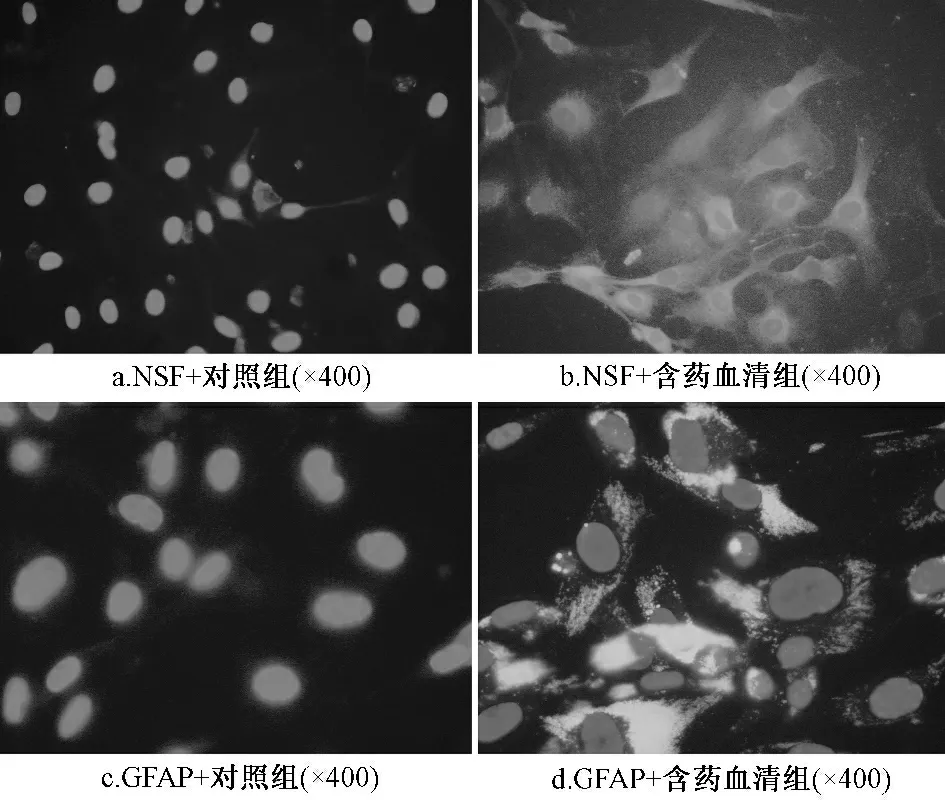
圖2 免疫熒光檢測圖
結果可知,NSE 在對照血清組細胞胞漿可見少量表達;NSE 在含藥血清組細胞內可見高表達;GFAP 在對照血清組細胞胞漿可見少量表達;GFAP 在含藥血清組細胞內可見高表達(×400)。
2.3 蛋白表達水平分析 NSE 和GFAP 蛋白在對照血清組細胞內可見少量表達,而其在含藥血清組細胞內可見強表達,二者均具有統計學差異(P <0.05)(圖3)。

圖3 NSE 和GFAP 蛋白在對照血清組和含藥血清組細胞中表達水平變化
3 討論
根據脊髓損傷后出現的癥狀與中醫古籍中對“體惰、痿病”的描述相類似。督脈受損則經氣不通、氣血阻滯,導致陽氣不能通達四肢,從而出現肢體麻木、癱瘓、二便失禁等經絡不通的現象;同時督脈貫脊、絡腎,故督脈受損必傷及腎。補陽還五湯是由黃芪、當歸、赤芍、地龍、川芎、紅花、桃仁熬制而成的湯藥。黃芪意在大補元氣、使氣旺血行,赤芍、桃紅活血化瘀,地龍、川芎通絡止痙,當歸補血活血[4]。研究表明:補陽還五湯對脊髓缺血再灌注損傷有保護作用,其可能抑制神經細胞的凋亡[5]。另有研究發現:補陽還五湯能夠促進大鼠脊髓損傷后移植的胚胎神經干細胞存活、增殖和遷移[6]。大量的研究均表明補陽還五湯對脊髓損傷修復具有一定的積極作用,而經過研究發現肌源性干細胞(muscle derived stem cells,MDSCs),又稱為群旁細胞(side populations,SP),具有多向分化潛能,良好的增殖和自我更新能力,體外分化為神經細胞、骨細胞、平滑肌細胞[7-11]等系的細胞,能夠實現離體分離、培養及擴增,且來源豐富、方便,具有良好的免疫反應調節能力。郭占鵬等[12-13]通過實驗證明肌源性干細胞在一定作用下可體外誘導分化為神經樣細胞。因此本次研究側重于通過實驗觀察補陽還五湯對大鼠肌源性干細胞體外生長分化的影響。
神經元特異性烯醇化酶(neuron-specific enolase,NSE)和膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)被視為經典的神經內分泌細胞的標記[14]。本次研究通過對含藥血清組和對照組兩組中NSE、GFAP 的表達進行比對分析,發現藥物血清組的細胞可見多邊形改變類似神經樣突起,對照組細胞呈紡錘狀;藥物血清組中細胞的NSE 和GFAP 的表達均明顯高于對照組(P <0.05)。通過實驗觀察到含藥血清組使肌源性干細胞向神經樣細胞分化,其細胞形態改變出現類似神經樣突起,而對照組無此變化。因此認為補陽還五湯對大鼠肌源性干細胞體外生長分化具有一定促進作用,能夠在一定程度上促進肌源性干細胞的分化。
本實驗采用補陽還五湯對肌源性干細胞進行體外誘導分化成神經樣細胞,獲得了滿意的分化效果,充分說明補陽還五湯作為中藥湯劑在適當的條件下是可以促進體內神經樣細胞的形成,這也為脊髓損傷細胞移植中藥輔助治療提供了一定理論基礎。但由于中藥湯劑成分比較復雜,其具體作用機制尚需進一步探討。
[1] 李全雙,梅晰凡,郭占鵬,等. 成肌干細胞在透明質酸凝膠載體中誘導分化為軟骨細胞的研究[J]. 解放軍醫學雜志,2010,35(7):829-832.
[2] Huang M N,Guo Z P,Liu K,et al. Protein hairy enhancer of split-1 expression during differentiation of muscle-derived stem cells into neuron-like cells[J]. Neural Regen Res,2012,7(28):2182-2187.
[3] Chen A,Wang H,Zhang J. BYHWD rescues axotomized neurons and promotes functional recovery after spinal cord injury in rats[J]. J Ethnopharmacol,2008,117(3):451-456.
[4] Fan L,Wang K,Cheng B. Effects of buyang huanwu decoction on apoptosis of nervous cells and expressions of Bcl-2 and bax in the spinal cord of ischemia-reperfusion injury in rabbits[J]. J Tradit Chin Med,2006,26(2):153-156.
[5] Wang L,Jiang D M. Neuroprotective effect of Buyang Huanwu Decoction on spinal ischemia/reperfusion injury in rats[J]. J Ethnopharmacol,2009,124(2):219-223.
[6] 張 敏,柴 勇,楊 成,等. 補陽還五湯對大鼠脊髓損傷后移植神經干細胞存活、增殖與遷移的影響[J]. 神經解剖學雜志,2011,27(3):326-330.
[7] Danisovic L,Varga I,Polák S,et al. Biological and morphological characterization of in vitro expanded human muscle-derived stem cells[J]. Tsitologiia,2011,53(6):482-487.
[8] Nieponice A,Soletti L,Guan J,et al. Development of a tissueengineered vascular graft combining a biodegradable scaffold,muscle-derived stem cells and a rotational vacuum seeding technique[J]. Biomaterials,2008,29(7):825-833.
[9] Zhang Y,Lian J B,Stein J L,et al. The Notch-responsive transcription factor Hes-1 attenuates osteocalcin promoter activity in osteoblastic cells[J]. J Cell Biochem,2009,108(3):651-659.
[10] Baek Y S,Kang S H,Park J S,et al. Long-term cultured skeletal muscle-derived neural precursor cells and their neurogenic potentials[J]. Neuroreport,2009,20(12):1109-1114.
[11] Rc'h P,Romero-Ramos M,Chivatakarn O,et al. Isolation and characterization of cells with neurogenic potential from adult skeletal muscle[J]. Biochem Biophys Res Commun,2004,317(3):893-901.
[12] 郭占鵬,梅晰凡,袁亞江,等. Detlal 基因在肌源性干細胞分化為神經樣細胞過程中的表達[J]. 解剖學雜志。2011,34(5):641-643.
[13] 郭占鵬,梅晰凡,李全雙,等. Jagged1 蛋白在肌源性干細胞分化為神經樣細胞過程中的表達差異[J]. 遼寧醫學院學報,2009,30(5):389-391.
[14] Buas M F,Kabak S,Kadesch T. Inhibition of myogenesis by Notch:evidence for multiple pathways[J]. J Cell Physiol,2009,218(1):84-93.

