七氟烷預處理聯合后處理對肺缺血再灌注損傷大鼠的保護作用及機制
劉備,唐冬梅,杜寧,徐桂萍
(1石河子大學醫學院,石河子832000;2新疆維吾爾自治區人民醫院)
肺缺血再灌注損傷(IRI)多發生于肺移植、失血性休克、體外循環后,IRI發生時,肺組織缺血后的再灌注不僅不能使肺功能恢復,反而可加重肺功能障礙和結構損傷,并最終發展為急性肺損傷(ALI)或急性呼吸窘迫綜合征(ARDS)[1]。肺移植時,IRI發生率高達25%[2]。IRI機制較多,其中氧自由基及炎癥反應等是主要因素[3]。七氟烷是臨床常用吸入麻醉藥,具有血氣分配系數低、誘導蘇醒快、血流動力學穩定等優點。有學者已證明七氟烷對急性肺損傷的保護作用優于其他吸入麻醉藥[4],且該種保護作用與減輕脂質過氧化、減少炎癥介質釋放有關[5]。本研究在建立IRI大鼠基礎上,擬探討七氟烷預處理聯合后處理對IRI大鼠的保護作用及其機制。
1 材料與方法
1.1 材料 新疆醫科大學動物實驗中心提供的成年雄性SD大鼠54只,體質量300~350 g。七氟烷(Maruishi Pharmaceutical公司),TNF-α 測定試劑盒(北京永輝生物科技有限公司),逆轉錄試劑盒(Thremo公司),超氧化物歧化酶(SOD)試劑盒(南京建成生物工程研究所)。小動物呼吸機(成都泰盟科技有限公司)。凝膠圖像分析系統(Bio-Rad公司,美國)。
1.2 IRI模型制作及動物分組 采用隨機數字表法將54只SD大鼠分為假手術組(S組)、肺缺血再灌注組(I/R組)和七氟烷預處理聯合后處理組(SP組)各18只。參照文獻[6]采用Epinger方法制備IRI模型。腹腔注射20%烏拉坦4 mL/kg進行麻醉,仰臥位固定;游離頸內靜脈,行頸內靜脈穿刺并置管,持續輸注生理鹽水;游離氣管,行氣管切開并插管,接小動物呼吸機行機械通氣,通氣頻率65~70次/min,潮氣量10~15 mL/kg,呼吸比1.0∶1.5。呼吸機的進氣口與裝有七氟烷揮發罐的麻醉機呼吸回路末端相連。通氣30 min后,將大鼠改為右側臥位,左側第5肋間入胸,離斷左下肺韌帶,游離左肺門,經由頸內靜脈三通處注射50 U肝素,5 min后,于呼氣末采用無創血管夾夾閉左肺門(包括左主支氣管、左肺動、靜脈),通氣時肺組織不再膨脹,顏色由淡紅變為暗紫紅色,表明阻斷成功。阻斷45 min后松開血管鉗恢復血液循環和通氣形成再灌注,觀察5 min內肺組織膨脹,顏色逐漸恢復,表明再灌注成功。S組僅游離左肺門,不阻斷;I/R組按上述方法制備IRI模型;SP組吸入2.1%七氟烷30 min后,停止吸入洗脫10 min,然后阻斷左肺門45 min,并于松開血管夾即刻再次吸入2.1%七氟烷30 min制備IRI模型。
1.3 觀察指標及方法 ①血漿SOD活性。分別于再灌注30、60、120 min時各組隨機取6只大鼠,做死亡心臟采血,吸取血液2 mL加入含肝素溶液的試管中,3 000 r/min離心20 min后取上清,采用比色法檢測SOD活性。②肺組織中TNF-α表達。分別于再灌注30、60、120 min時各組隨機取6只大鼠處死,取部分肺組織,采用ELISA法測定TNF-α。③肺組織濕/干質量比(W/D比)。切取大鼠部分肺組織,生理鹽水沖干肺上血跡,濾紙吸干表面水分,稱得濕質量(W值)后將該肺組織置于風箱中12 h至橫重,稱得干質量(D值),二者相比得W/D值。④血管緊張素轉化酶(ACE)mRNA表達。取部分-80℃冰箱保存的左肺組織,采用TRIzol法處理、分離、RNA沉淀、RNA洗滌、RNA溶解提取總RNA,并測定其濃度和純度,逆轉錄試劑盒合成反轉錄cDNA,然后進行RT-PCR反應。取所得PCR產物5 μL點樣于2%的瓊脂糖凝膠進行電泳,用凝膠圖像分析系統掃描測定PCR擴增條帶的吸光度值,以ACE mRNA條帶吸光度值與β-actin條帶吸光度值的比值表示ACE mRNA水平。⑤肺組織病理學改變。取出部分左肺組織,10%中性甲醛固定過夜,脫水,石蠟包埋,連續切片(厚4 μm),HE染色,100倍光鏡下觀察病理學變化。
1.4 統計學方法 采用SPSS17.0統計軟件。計量資料以±s表示,組間及組內比較采用方差分析。P≤0.05為差異有統計學意義。
2 結果
2.1 各組肺組織W/D、TNF-α 表達、ACE mRNA表達及血漿SOD活性比較 三組大鼠各個時點肺組織W/D、TNF-α表達、ACE mRNA表達及血漿SOD活性水平的比較見表1。
2.2 各組肺組織病理學結果比較 光鏡下,S組肺組織未見明顯異常。I/R組肺泡結構破壞嚴重,肺泡腔內可見大量紅細胞及炎性細胞浸潤,且I/R組120 min組織破壞最為嚴重,SP組肺組織病理學損傷較I/R組輕。
表1 三組不同時點肺組織中W/D、TNF-α、ACE mRNA表達及血漿SOD活性水平比較(n=6,±s)
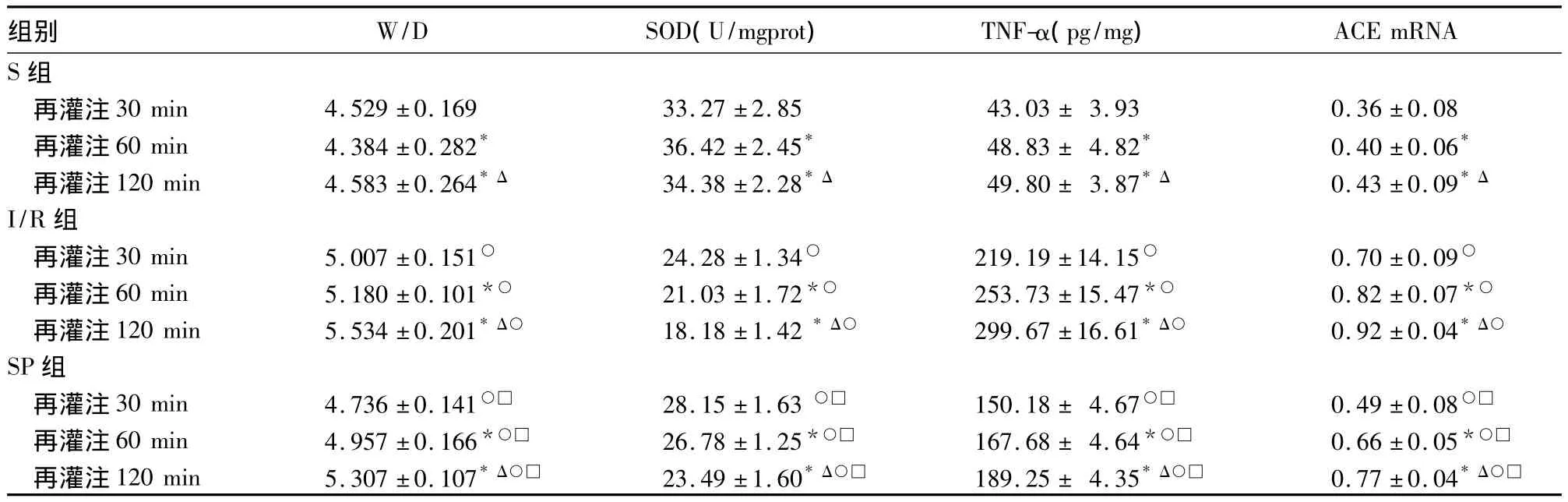
表1 三組不同時點肺組織中W/D、TNF-α、ACE mRNA表達及血漿SOD活性水平比較(n=6,±s)
注:與同組再灌注30 min時相比,*P<0.05;與同組再灌注60 min時相比,ΔP<0.05;與S組同時間點相比,○P<0.05;與I/R組同時間點相比,□P <0.05。
組別 W/D SOD(U/mgprot) TNF-α(pg/mg)ACE mRNA S 組再灌注 30 min 4.529 ±0.169 33.27 ±2.85 43.03 ± 3.93 0.36 ±0.08再灌注 60 min 4.384 ±0.282* 36.42 ±2.45* 48.83 ± 4.82* 0.40 ±0.06*再灌注120 min 4.583±0.264*Δ 34.38±2.28*Δ 49.80± 3.87*Δ 0.43±0.09*Δ I/R組再灌注30 min 5.007 ±0.151○ 24.28±1.34○ 219.19 ±14.15○ 0.70±0.09○再灌注60 min 5.180±0.101*○ 21.03±1.72*○ 253.73±15.47*○ 0.82±0.07*○再灌注120 min 5.534 ±0.201*Δ○ 18.18±1.42*Δ○ 299.67 ±16.61*Δ○ 0.92±0.04*Δ○SP組再灌注30 min 4.736±0.141○□ 28.15±1.63 ○□ 150.18± 4.67○□ 0.49±0.08○□再灌注60 min 4.957±0.166*○□ 26.78±1.25*○□ 167.68± 4.64*○□ 0.66±0.05*○□再灌注120 min 5.307 ±0.107*Δ○□ 23.49 ±1.60*Δ○□ 189.25 ± 4.35*Δ○□ 0.77 ±0.04*Δ○□
3 討論
IRI時肺內氧自由基大量生成,致使肺脂質過氧化,造成肺內毛細血管及氣道損傷[7];與此同時,這種損傷促使肺內炎癥介質釋放,激活IRI的炎癥反應[8]。
SOD是生物體內重要的抗氧化酶,在IRI過程中可抑制肺脂質過氧化反應,減少氧自由基損害。Yang等[9]研究證實缺血再灌注開始即刻便有大量活性氧物質生成,發生氧化應激反應,本實驗中I/R組較S組各時點SOD活性降低,證實了以上觀點;而經由七氟烷聯合處理后,SP組較I/R組各時點SOD活性均升高,表明七氟烷聯合處理后肺內SOD活性增加,氧化應激反應減輕。
目前,IRI的詳細機制尚未明了,其特征性病理變化為肺毛細血管內皮細胞受損后,肺泡—毛細血管屏障功能障礙,使炎癥細胞和炎性介質滲出,肺泡及肺泡間質水腫,組織細胞死亡[10]。肺組織中含有豐富的ACE,ACE mRNA表達上調可促使AngⅡ產生,同時伴有少量TNF-α的生成,進而激活炎癥反應[11]。W/D比則可通過肺微血管損傷情況反映IRI程度,本實驗中,光鏡下I/R組較S組肺組織破壞嚴重,且肺組織W/D、TNF-α及ACE mRNA表達水平均升高,提示ACE mRNA及TNF-α表達可使毛細血管擴張充血,誘導炎性細胞浸潤,造成肺泡間隔水腫增寬。隨再灌注時間的延長,肺組織損傷逐漸加重,I/R組120 min組織破壞最為嚴重,表明IRI具有時間相關性。七氟烷聯合處理后,SP組較I/R組肺組織W/D、TNF-α及ACE mRNA表達水平均降低,表明七氟烷聯合處理可通過抑制肺內ACE mRNA及TNF-α表達,減輕IRI的炎癥反應,發揮肺保護作用。
綜上所述,七氟烷預處理聯合后處理可能通過抑制氧化應激及炎癥反應對IRI大鼠發揮保護作用。
[1]Sakai S,Tajima H,Miyashita T,et al.Sivelestat Sodium hydrate inhibits neutrophil migration to the vessel wall and suppresses hepatic ischemia-reperfusion injury[J].Dig Dis Sci,2013,59(4):787-794.
[2]Villar J,Blanco J,Anon JM,et al.The ALLEN study:incidence and outcome of acute respiratory distress syndrome in the era of lung protective ventilation[J].Intensive Care Med,2011,37(12):1932-1941.
[3]聶君,李勁松,王建軍.肺缺血再灌注損傷的機制和防治進展[J].國際移植與血液凈化雜志,2007,5(3):20-26.
[4]Bouwman RA,Salic K,Padding FG,et al.Cardio protection via activation of protein kinase C-delta depends on modulation of the reverse mode of the Na+/Ca2+exchanger[J].Circulation,2006,114(1 Suppl):1226-1232.
[5]Rancan L,Huerta L,Cusati G,et al.Sevoflurane prevents liver inflammatory response induced by lung ischemia-reperfusion[J].Transplantation,2014,98(11):1151-1157.
[6]Bellido-Reyee YA,Akamatsu H,Kojima K,et al.Cytosolic phospholipase A2 inhibition attenuates isehemia-reperfusion injury in an isolatedrat lung model[J].Transplantation,2006,81(12):1700-1707.
[7]Farivar AS,Woolley SM,Fraga CH,et al.Intratracheal poly(ADP)ribose synthetase inhibition ameliorates lung ischemia reperfusion injury[J].Ann Thorac Surg,2004,77(6):1938-1943.
[8]Suter D,Spahn DR,Blumenthal S,et al.The immune modulatory effect of sevoflurane in endotoxin-injured alveolar epithelial cells[J].Anesth Analg,2007,104(3):638-645.
[9]Yang XM,Proctor JB,Cui L,et al.Multiple,brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways[J].J Am Coll Cardiol,2004,44(5):1103-1110.
[10]宋先斌,肖軍.血管緊張素Ⅱ信號通路與急性肺損傷[J].醫學綜述,2011,17(23):3529-3532.
[11]林峰,徐桂萍.七氟醚預處理對大鼠肺缺血再灌注時肺組織血管緊張素轉化酶mRNA表達的影響[J].中華麻醉學雜志,2013,33(3):346-349.

