電針介導eNOS動員內源性EPCs促MCAO/R大鼠腦內血管再生
朱艷含,羅勇 ,胥虹貝,王盼欣
(重慶醫科大學附屬第一醫院神經內科 重慶市神經病學重點實驗室,重慶 400016)
缺血性卒中(ischemic stroke),約占全部腦卒中的70%,嚴重威脅著人類的生命健康。如何改善急性腦缺血后的血供,增加缺血區的血管再生從而促進神經功能的恢復日益成為現今研究的熱點。內皮祖細胞(endothelial progenitor cells,EPCs)是近年來發現的具有較強促血管再生能力的一種干細胞。研究表明,EPCs 主要存在于機體的骨髓中,在某些病理生理環境下,可以從骨髓動員至外周血循環[1]。當機體發生急性腦梗死時,如何更加有效地調動內源性(即骨髓內)EPCs 參與腦梗死后的血管再生是目前研究的熱點之一。前期研究發現電針可促進腦梗死大鼠的血流恢復及血管再生,并改善其神經功能癥狀[2-4,13],但具體機制尚不十分明確。研究表明,eNOS 的磷酸化可促進NO 的釋放并激活MMP-9,進而促進內源性EPCs 的釋放[5-6]。本研究將電針與eNOS 通路相結合來研究局灶腦缺血/再灌注后內源性EPCs 的動員情況,進一步探討電針治療腦梗死的機制。
1 材料與方法
1.1 實驗動物及分組
SPF 級成年雄性SD 大鼠100 只,250 ~300 g,由重慶醫科大學動物中心【SCXK(渝)2012-0002】提供,重慶醫科大學附屬第一醫院實驗研究中心【SYXK(渝)2010-0002】提供實驗操作平臺,并按實驗動物使用的3R 原則給予人道的關懷。100 只大鼠隨機分為正常組(N 組)、模型組(I/R 組)、模型+電針組(I/RE 組)、模型+電針+L-NAME 組(I/REL 組),除N 組外的其余三組根據局灶腦缺血1.5 h 再灌注后的觀察時間點,分為1、2、7 d 三個亞組,各亞組10 只。
1.2 主要試劑
兔抗大鼠VEGFR2 抗體購自CST 公司,Biotin-KDR 購自Novus Biology 公司,FITC-鏈球菌抗生物素蛋白購自eBiosciense 公司,小鼠抗大鼠CD34 抗體購自Santa Cruz Biotechnology 公司,L-NAME 購自北京碧云天公司,免疫組化試劑盒購自北京中杉金橋生物技術有限公司,熒光定量PCR 相關試劑購自Takara 公司。
1.3 動物模型制備及評判標準
線栓法制備大鼠右側大腦中動脈局灶腦缺血/再灌注模型(middle cerebral artery occlusion/reperfusion,MCAO/R)[7-8]。缺血1.5 h。大鼠清醒后根據Longa 等[9]5 分制評分標準對大鼠進行評分。以評分為2、3 分為納入標準。因各種原因不能納入實驗的大鼠,相應組別通過隨機抽樣原則補齊。
1.4 電針刺激方法及腹腔給藥
針刺方法:選擇大鼠“百會”穴(GV 20)及左側“四關”穴(合谷LI 4/太沖LR 3)作為針刺穴位。取華佗牌不銹鋼銀針(直徑為0.38 mm,長度為1 寸)一根斜刺“百會”穴;兩根直刺“合谷”穴,間距約2 mm;兩根直刺“太沖”穴,間距約2 mm。連接電針治療儀,頻率為2/20 Hz,波型為疏密波,針刺20 min,每日一次,強度以大鼠左側肢體輕微顫動為宜。腹腔注射L-NAME(eNOS 抑制劑):造模成功后,立即給予藥物抑制組大鼠腹腔注射L-NAME,注射濃度為8 mg/kg,配藥濃度為8 mg/mL (每8 mg 的LNAME 溶于1 mL 的生理鹽水)[10]。
1.5 取樣及檢測
1.5.1 取材
每組取5 只大鼠到相應觀察時間點時,采集腹主動脈血約2 mL,流式細胞學檢測備用;預冷的PBS 沖出雙側后肢骨腔中的骨髓細胞,并調整細胞數在1 ×106~1×107左右,流式細胞學檢測備用;流式取材完畢立即斷頭取腦,取大腦中動脈供血范圍的缺血大腦皮質,-80℃保存,熒光定量PCR 備用。各組其余5只大鼠到相應觀察時間點時,經左心室內固定腦組織,取視交叉前后2 mm 腦組織作石蠟切片。
1.5.2 流式細胞術檢測外周血及骨髓EPCs 數量(EPCs 占單核細胞數量的百分比)
取外周血及骨髓細胞懸液各100 μL,分別加1 μL 兔抗大鼠VEGFR2 抗體避光孵育30 min,繼而加2 mL 紅細胞裂解液避光孵育5 min,4℃下1500 r/min 離心5 min,棄上清,2 mL PBS 重懸離心洗滌2次之后,加FITC 標記的二抗避光孵育30 min,2 mL PBS 重懸離心洗滌之后用100 μL PBS 重懸細胞沉淀,流式細胞儀上機檢測EPCs 數量。
1.5.3 熒光定量PCR 技術檢測缺血大腦皮質VEGFR2 mRNA 的表達
將保存于-80℃的缺血大腦皮質取出,按Takara 說明書提取總RNA,并逆轉錄成20 μL 體系的cDNA。據GenBank 提供的序列,擴增大鼠VEGFR2 mRNA的上游引物為5′-GGAAAGGGTGTT GGTGACTG-3′,下游引物為5′-GGTGTCCCGATAGAAGCACT-3′,產物長度112 bp。擴增條件為預變性95℃30 s,PCR 反應95℃5 s、60℃30 s,40 個循環。
1.5.4 免疫組化法檢測腦缺血區VEGFR2 陽性細胞表達及CD34 微血管計數
根據免疫組化試劑盒步驟對腦組織石蠟切片進行處理。結果的判定:VEGFR2 陽性細胞:采用Image-Pro Plus 16.0 圖像測量分析軟件計算VEGFR2陽性細胞數(個/HP)。微血管密度:所有切片均編號,取非連續的3 張切片,每張切片讀取2 個非連續視野數值。缺血區微血管計數(microvessel count,MVC)結果的判定:在200 倍視野下觀察,染成棕褐色或棕黃色的細胞或細胞簇,直徑<20 μm,與相鄰的血管分界清楚,均認為是1 條微血管。由第一作者和另2 名經過專業訓練的專業技術人員觀察計數,微血管數(個/HP)為每個視野下的血管數。
1.5.5 統計學分析
2 結果
2.1 大鼠外周血VEGFR2+EPCs 數量變化情況
大鼠局灶腦缺血/再灌注損傷后I/R 組外周血VEGFR2+EPCs 數量明顯高于N 組(P <0.05,P <0.01);I/RE 組在各時間點與I/R 組相比均具有統計學差異(P <0.01,P <0.05);而I/REL 組的VEGFR2+EPCs 數量相比I/RE 組則顯著降低(P <0.01)。見圖1。
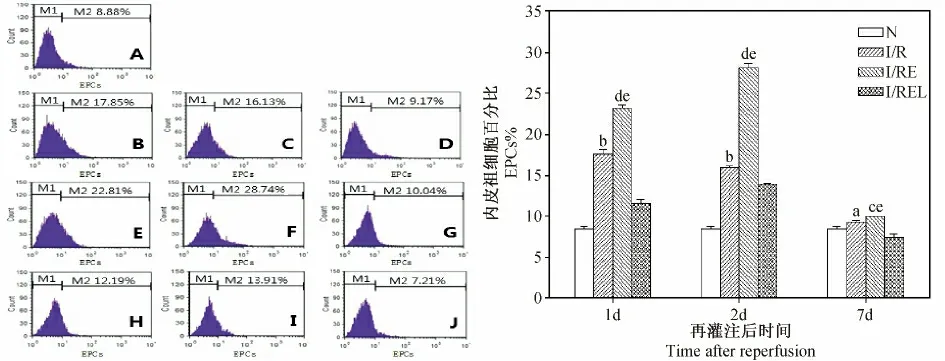
圖1 各組大鼠外周血VEGFR2 +EPCs 數量的比較Fig.1 Comparison of VEGFR2 +EPCs percentage in the rat peripheral blood of each group
2.2 大鼠骨髓VEGFR2+EPCs 數量變化情況
大鼠局灶腦缺血/再灌注損傷后1、2d I/R組骨髓VEGFR2+EPCs 數量明顯高于N 組(P <0. 01),7d 時與N 組相比無差異(P >0. 05);I/RE 組在各時間點與I/R 組相比有顯著差異(P<0. 01,P <0. 05);而I/REL 組 的VEGFR2+EPCs 數量相比 I/RE 組則顯著降低(P <0. 01)。見圖2。
2.3 大鼠局灶大腦缺血皮質區VEGFR2 mRNA及VEGFR2 陽性細胞表達情況
與N 組比較,I/R 組各時間點VEGFR2 陽性細胞表達均增高(P <0.01);I/RE 組各時間點VEGFR2 mRNA 的表達量及VEGFR2 陽性細胞表達較I/R 組均明顯增高(P <0.01);當eNOS 被抑制后,電針促VEGFR2 mRNA 及VEGFR2 陽性細胞表達作用則明顯降低(P <0.01)。見圖3、表1。
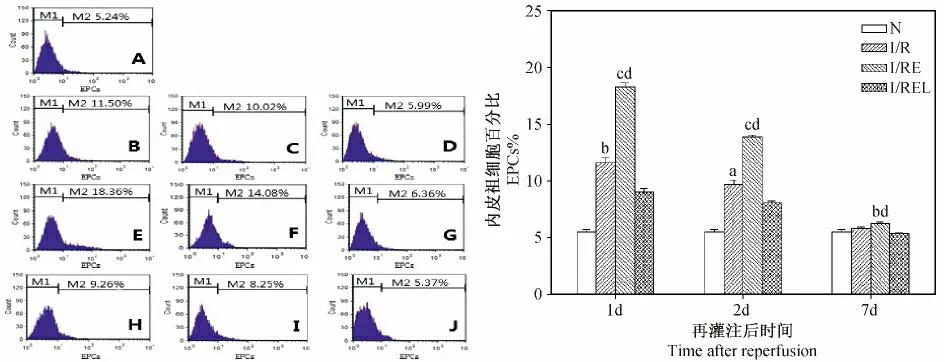
圖2 各組大鼠骨髓VEGFR2 +EPCs 數量的比較Fig.2 Comparison of VEGFR2 +EPCs percentage in the rat bone marrow of each group
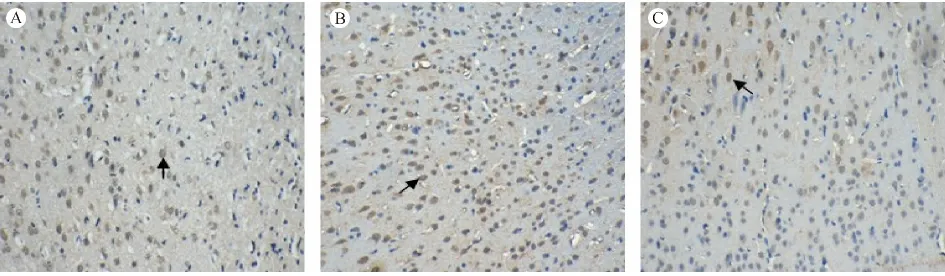
圖3 各組大鼠缺血腦皮質區VEGFR2 陽性細胞表達情況(×200)Fig.3 VEGFR2-positive cells in the ischemic cerebral cortex of rats in each group(×200)
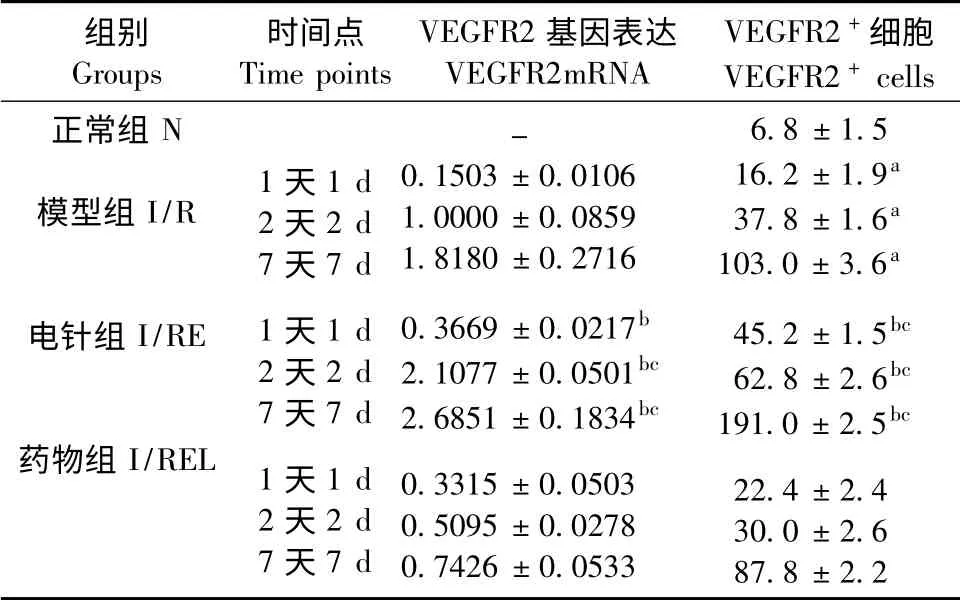
表1 各組大鼠缺血皮質區VEGFR2 mRNA 及VEGFR2陽性細胞的表達Tab.1 The expression of VEGFR2 mRNA and VEGFR2 +cells in ischemic cerebral cortex of the rats in each group
2.4 大鼠局灶大腦缺血皮質區CD34 微血管計數
與I/R 組比較,I/RE 組各時間點CD34 微血管計數均顯著增多(P <0.01),在eNOS 被抑制后電針促微血管生成的作用顯著降低(P <0.01)。見圖4。
3 討論
在我國針刺用于治療腦梗死已有數千年的歷史。研究表明,電針可通過促骨髓干/祖細胞如EPCs 等的動員來參與缺血區血管的再生[11]。EPCs是血管內皮細胞的前體細胞,在成人主要存在于骨髓。在缺血缺氧等病理因素的刺激下,EPCs 可從骨髓動員出去,并歸巢至缺血靶區參與血管再生[12-13]。現階段關于可以準確代表EPCs 的表面標記物的研究尚未明確,一致認為VEGFR2、CD34、CD31、CD133 等為主要標記物,其中VEGFR2+EPCs具有較強的血管修復能力[14]。
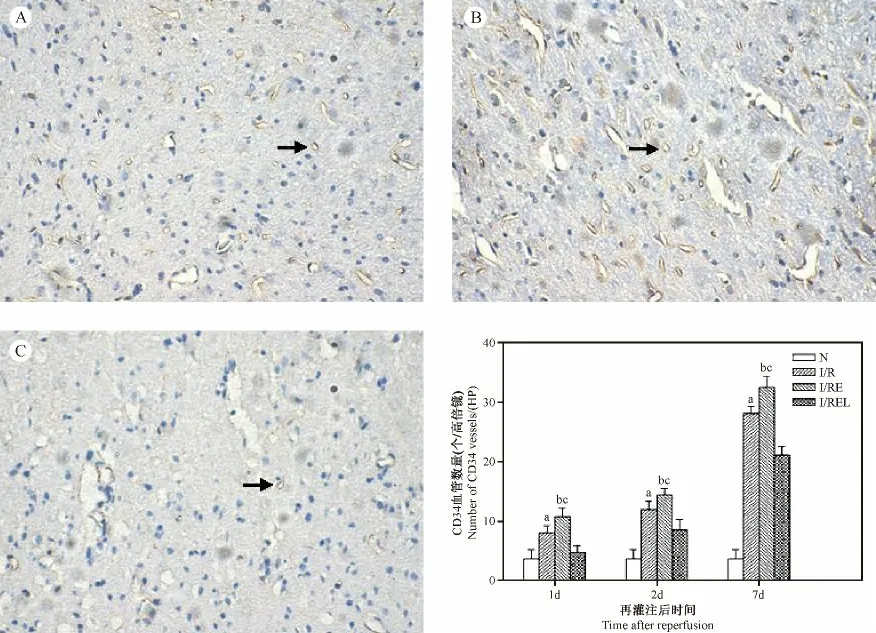
圖4 各組大鼠缺血皮質區CD34 微血管計數的比較(×200)Fig.4 Comparison of the number of CD34 +blood vessels in ischemic cerebral cortex in the rats of each group(×200)
張彤等[15]發現電針預處理可上調局灶腦缺血/再灌注后大鼠骨髓及外周血中VEGFR2+EPCs 數量,推測電針對腦梗死的修復作用與對EPCs 的動員有關;孫宏毅等[12]研究表明電針治療后局灶腦缺血/再灌注大鼠骨髓及外周血中VEGFR2+EPCs 數量明顯增高,推測電針動員EPCs 可促腦缺血區血管再生。此外,電針還可以上調局灶腦缺血/再灌注大鼠外周血中VEGFR2+PECAM-1+EPCs、VEGFR2+CD31+EPCs、CD34+EPCs 等的數量,從而促進血管再生[16-18]。組織發生缺血后,是通過何種途徑將骨髓龕內處于靜止狀態的EPCs 激活并動員至外周血,進而參與缺血組織的血管再生,是目前研究的熱點。
研究表明,eNOS 在干/祖細胞的動員及缺血組織的保護中起關鍵作用。Kim 等[19]發現電針提高小鼠局灶腦缺血后的腦血流量及改善神經功能缺損癥狀的作用,在敲除eNOS 基因的小鼠體內明顯受到抑制。Cui 等[6]發現eNOS 可以促進腦梗死后的血管再生,敲除eNOS 基因的小鼠腦梗死后較野生型小鼠死亡率增高,神經功能缺損癥狀更為明顯,在使用NO 供體DETA-NONOate 后明顯改善。Aichner等[20]發現缺乏eNOS 的小鼠,VEGF 誘導的EPCs 的動員能力顯著降低。同時,研究表明SDF-1α 對EPCs 的動員作用,亦可在eNOS 被阻斷后受到抑制[21]。提示eNOS 在EPCs 的動員及缺血后腦保護中處于關鍵地位。故本研究旨在探討電針對EPCs的動員作用及對腦梗死的保護作用是否是通過對eNOS 的調控來實現的。本研究結果發現,電針可以促進局灶腦缺血/再灌注大鼠骨髓及外周血中VEGFR2+EPCs 的數量,其中骨髓內VEGFR2+EPCs 數量隨大鼠缺血時間的延長逐漸減少,而外周血中VEGFR2+EPCs 數量則是先有一個增多的趨勢繼而再減少,可能與VEGFR2+EPCs 在機體內先由骨髓內動員至外周血,之后又歸巢到缺血腦區有關;同時,本研究發現電針上調大鼠缺血大腦皮質中VEGFR2 mRNA 及VEGFR2 陽性細胞數的表達,這種作用在eNOS 被阻斷后受到抑制,有可能提示eNOS 被阻斷后,電針促局灶腦缺血后VEGFR2 陽性細胞的歸巢能力減弱;且電針治療后大鼠缺血大腦皮質區微血管的數量生成增多,而電針的這種對腦梗死大鼠的保護作用在使用eNOS 抑制劑后明顯減弱。研究表明,電針可上調eNOS 的表達[22]。故我們推斷電針或可通過介導eNOS 的激活來促局灶腦缺血后骨髓EPCs 動員至外周血,上調骨髓及外周血中EPCs 數量,同時歸巢到缺血腦區的EPCs 數量增加,進而促進缺血大腦皮質區的血管再生。
本研究對電針動員EPCs 的機制做了較為深入研究,既往研究發現電針一方面可以上調外周血及骨髓EPCs 的數量,另一方面可以上調VEGF、SDF-1α、eNOS 等一系列與EPCs 動員、歸巢密切相關的因子,但大多未將電針動員EPCs 的機制與介導相關通路結合起來,僅是推測電針動員EPCs 是通過激活EPCs 動員相關因子來實現的,故本研究在既往的研究基礎上,更加深入的探討了電針動員內源性EPCs,進而歸巢到缺血腦區參與血管再生的機制,發現使用eNOS 抑制劑L-NAME 后電針對局灶腦缺血大鼠EPCs 的動員作用及對腦血管的保護作用明顯受到抑制。可見電針可通過介導eNOS 動員內源性EPCs 促局灶腦缺血大鼠腦內血管再生,進一步證明了電針治療腦梗死的作用機理,為電針在臨床上治療腦梗死中提供堅實的理論依據。
[1]Asahara T,Masuda H,Takahashi T,et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization[J].Circ Res,1999,85(3):221 -228.
[2]Lu T,Luo Y,Sun H,et al. Electroacupuncture improves behavioral recovery and increases SCF/c-kit expression in a rat model of focal cerebral ischemia/reperfusion[J]. Neurol Sci,2013,34(4):487 -495.
[3]唐曦,劉小衛,殷堅,等. 全經針刺法對恢復期腦梗死腦血流動力學影響的臨床研究[J]. 中國醫藥導報,2011,8(17):102 -105.
[4]周秀麗,范為民. 電針對腦缺氧缺血新生大鼠海馬結構Nestin 與Brdu 表達的影響[J]. 中國醫藥導報,2008,5(27):9-11.
[5]Cui X,Chopp M,Zacharek A,et al. Role of endothelial nitric oxide synthetase in arteriogenesis after stroke in mice[J]. Neuroscience,2009,159(2):744 -750.
[6]Heissig B,Hattori K,Dias S,et al. Recruitment of stem and progenitor cells from the bone marrow niche requires MMP-9 mediated release of kit-ligand[J]. Cell,2002,109(5):625-637.
[7]羅勇,董為偉. Wistar 大鼠插線法局灶性腦缺血/再灌注模型的實驗研究[J]. 重慶醫科大學學報,2002,27(1):1-4.
[8]包新杰,趙浩,趙英杰,等. 線栓法插線深度對大鼠腦梗死模型制備的影響[J]. 中國實驗動物學報,2011,19(3):233 -236.
[9]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84 -91.
[10]Li XL,Zou XM,Gao P,et al. Role of nitric oxide in ischemiareperfusion injury and acute rejection in rat intestinal transplantation[J]. Transplant Proc,2008,40(10):334 -3345.
[11]孫宏毅,羅勇,盧桃利,等. 電針對局灶性腦缺血/再灌注大鼠外周血和骨髓內皮祖細胞的作用[J]. 針刺研究,2012,37(3):179 -185.
[12]Orlic D,Kajstura J,Chimenti S,et al. Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J]. Proc Natl Acad Sci U S A,2001,98(18):10344 -10349.
[13]謝宸宸,羅勇,高祥,等. 電針對局灶腦缺血/再灌注模型大鼠缺血海馬區血管再生的影響及其機制[J]. 中國實驗動物學報,2014,22(4):41 -46.
[14]Friedrich EB,Walenta K,Scharlau J,et al.CD34-/CD133+/VEGFR-2+endothelial progenitor cell subpopulation with potent vasoregenerative capacities[J]. Circ Res,2006,98(3):e20 -e25.
[15]張彤,林濤,王秀志,等. 電針預處理對腦缺血再灌注大鼠骨髓及血漿中EPCs 及VEGF 的影響[J]. 中國康復醫學雜志,2009(5):428 -432.
[16]王秀志,張莉,蔡紹皙,等. 電針對腦缺血再灌注大鼠缺血局部腦血管形成的影響[J]. 針灸臨床雜志,2010,26(8):61 -63.
[17]趙瑛,陳斯佳,于文娟,等. 電針刺激對腦缺血大鼠內源性EPCs 及相關血清細胞因子的影響[J]. 生物醫學工程學雜志,2010,27(6):1322 -1326.
[18]謝宸宸,羅勇,龐月珊,等. 電針對局灶腦缺血/再灌注大鼠骨髓及外周血CD34+EPCs 的影響[J]. 針刺研究,2014,39(4):277 -282.
[19]Kim JH,Choi KH,Jang YJ,et al. Electroacupuncture acutely improves cerebral blood flow and attenuates moderate ischemic injury via an endothelial mechanism in mice[J]. Plos One,2013,8(2):e56736
[20]Aicher A,Heeschen C,Mildner-Rihm C,et al. Essential role of endothelial nitric oxide synthase for mobilization of stem and progenitor cells[J]. Nat Med,2003,9(11):1370 -1376.
[21]Zheng H,Fu GS,Dai T,et al. Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1alpha/CXCR4 via PI3K/Akt/eNOS signal transduction pathway[J]. J Cardiovasc Pharmacol,2007,50(3):274 -280.
[22]盧桃利,羅勇,孫宏毅,等. 電針對局灶腦缺血再灌注大鼠大腦皮質eNOS mRNA 及蛋白、MMP-9 蛋白表達的影響[J].基礎醫學與臨床,2012,32(2):158 -163.

