農桿菌介導的西瓜枯萎病菌遺傳轉化
任俊杰, 王麗霞, 高洪波, 呂桂云
(河北農業大學,保定 071001)
農桿菌介導的西瓜枯萎病菌遺傳轉化
任俊杰, 王麗霞, 高洪波, 呂桂云*
(河北農業大學,保定 071001)
為獲得帶GFP標記的西瓜枯萎病菌轉化株,用于后期觀察病原菌侵染過程,采用農桿菌介導的方法,對西瓜枯萎病菌1號生理小種進行了遺傳轉化。結果表明:共培養時間為36 h,枯萎病菌孢子和農桿菌AGL1比例為1∶1時該菌株的遺傳轉化效率最高,可以達到117.33個轉化子/107個孢子。轉化株的孢子、菌絲體及萌發的孢子均能發出穩定而強的綠色熒光。轉化株的致病力檢測顯示其致病力與轉化前的野生菌株致病力無明顯差異。結果表明本研究獲得的帶GFP標記的西瓜枯萎病菌轉化株可用于觀察病菌在西瓜根系的侵染過程。
枯萎病菌; 西瓜; 遺傳轉化; 綠色熒光蛋白
西瓜枯萎病是由尖孢鐮刀菌西瓜專化型(Fusarium oxysporumf.sp.niveum)引起的一種毀滅性土傳真菌病害,在世界范圍廣泛發生,該病害在我國的發生面積約占西瓜總栽培面積的42%,是危害最為嚴重,造成經濟損失最大的西瓜病害之一[1-3]。尖孢鐮刀菌西瓜專化型共有4個生理小種,分別為0號、1號、2號和3號,目前在世界生產中造成危害的主要是1號生理小種[4-6]。
綠色熒光蛋白(green fluorescent protein,GFP)最早是從水母中分離出來的,在紫外或藍光激發下發出綠色熒光,是目前能在活細胞中表達的發光蛋白之一[7]。GFP檢測方便,熒光穩定,且可以進行活體無損傷檢測。Skadsen等用GFP轉化F.graminearum詳細研究了其對大麥和擬南芥的侵染模式[8]。Lagopodi等運用GFP研究了番茄根腐病菌(F.oxysporumf.sp.radicis-lycopersici)對番茄根的侵染過程[9]。玉米與輪枝鐮孢菌(F.verticillioides)早期互作過程[10],擬南芥(Arabidopsis thaliana)與病原菌Colletotrichum destructivum互作研究[11],都充分體現了GFP作為標記基因的優越性。根癌農桿菌介導的遺傳轉化已經被廣泛地作為各種真菌插入突變的主要方法,目前在F.oxysporum0 685[12]、玉米大斑病菌[13]、甘藍枯萎病菌[14]、香蕉枯萎病菌[15]及甜瓜蔓枯病菌[16]上都已建立了根癌農桿菌介導的遺傳轉化體系。肖榮鳳利用PEG-CaCl2介導的原生質體轉化方法,將gfp基因成功轉入到西瓜枯萎病菌(F.oxysporumf.sp.niveum)FOV-135菌株中[17],但還未見關于西瓜枯萎病菌根癌農桿菌介導的gfp基因轉化的報道。
本試驗以西瓜枯萎病菌1號生理小種為材料,以根癌農桿菌AGL1為介導,將帶有gfp基因T-DNA片段整合到西瓜枯萎病菌1號生理小種中,以期獲得攜帶GFP標記的西瓜枯萎病菌轉化子,為觀察病原菌在西瓜抗、感寄主根系中的侵染過程提供工具,同時為揭示西瓜與枯萎病菌的互作和致病機理奠定基礎。
1 材料和方法
1.1 材料
1.1.1 病原材料
西瓜枯萎病菌(Fusarium oxysporumf.sp.niveum)1號生理小種(FON1),為本實驗室鑒定并保存。
1.1.2 根癌農桿菌的來源
Agrobacterium tumefaciensAGL1(帶有pCH-sGFP質粒)由中國農業科學院蔬菜花卉研究所謝丙炎研究員惠贈,sGFP在來源于Cochliobolus heterostrophus的glyceraldehydes-3-phosphate dehydrogenase基因啟動子下,篩選標記hygromycin B phosphotransferase基因(hph)在Aspergillus nidulanstrpC啟動子下(圖1)。

圖1 pCH-sGFP質粒結構圖Fig.1 Construction of the vector pCH-sGFP
1.1.3 植物材料
西瓜[Citrullus lanatus(Thunb.)Matsum.& Nakai]枯萎病的鑒別寄主材料‘Black Diamond’(感病,S),‘Sugar Baby’(感病,S),‘Crimson Sweet’(中抗,M),‘Charleston’(中抗,M),‘Calhoun Gray’(抗病,R),‘PI296341-FR’(抗病,R),用于對轉化株進行致病力鑒定。
1.2 方法
1.2.1 根癌農桿菌及西瓜枯萎病菌1號生理小種(FON1)菌液的準備
1.2.1.1 根癌農桿菌的活化
取-80℃保存帶有pCH-sGFP質粒的AGL1號農桿菌在YEB培養基上畫線培養,挑取單菌落于液體MM培養基中,搖培20~24 h(28℃、200 r/ min)。離心集菌,將所集菌混到IM液體培養基,(調節A600至0.18~0.22),搖培約6 h,使A600達到0.3~0.45。
1.2.1.2 西瓜枯萎病菌孢子懸浮液的制備
將培養于PDA培養基中的枯萎病菌接種于PL培養基中,置于28℃恒溫搖床中,125 r/min培養5 d后即可使用,用血球計數板計數,調整孢子濃度為5×106個/m L。
1.2.2 不同轉化條件對轉化效率的影響
枯萎病菌孢子和經誘導后的農桿菌AGL1不同比例的篩選:枯萎病菌孢子懸浮液5×106個/mL和經誘導后的農桿菌AGL1按1∶1、2∶1、1∶2三個比例混合,分別取400μL混合液均勻地涂到鋪有滅菌濾紙條的共培養平板上,每個比例涂4個板,28℃下避光共培養36 h。將濾紙條揭下,反鋪到含hygB(50μg/ mL)和頭孢霉素(200μg/mL)的選擇培養基(PDA培養基)上,28℃培養2~3 d。揭下濾紙條,在28℃培養1~3 d,每天檢查是否有新的抗hygB的單菌落出現。挑取選擇培養基上能抗hygB的單菌落至二篩板(含hygB的PDA培養基)上進一步篩選驗證。
共培養時間篩選:枯萎病菌孢子懸浮液5×106個/mL和經誘導后的農桿菌AGL1按1∶1比例的混合菌液共培養時間分別設置為24、36、48、60 h,其他同上,最后分別進行轉化效率的計算分析。
1.2.3 用熒光顯微鏡觀察菌絲和分生孢子的熒光表型
將尖孢鐮刀菌西瓜專化型轉化菌株轉接到添加hygB的PDA培養基平板上,觀察生長情況。同時通過熒光顯微鏡觀察菌絲和分生孢子的熒光強度。
1.2.4 對轉化子的抗病性鑒定
6個西瓜枯萎病的鑒別寄主材料種子用1.5%次氯酸鈉溶液消毒20 min,常規浸種和催芽。
接種:將西瓜枯萎病菌1號生理小種及其轉化菌株配制成濃度為5×106個/mL的孢子懸浮液,西瓜播種8~10 d后待子葉展平時進行接種,采用浸根法接種15 min,每個野生菌株及其轉化菌株接種30株,以無菌水接種為空白對照。接種后在溫室26~30℃條件下培養,記錄發病情況。
發病率(%)=萎蔫株數/調查株數×100[18]。
2 結果與分析
2.1 共培養條件對轉化效率的影響
2.1.1 枯萎病菌孢子懸浮液和農桿菌AGL1比例對轉化效率的影響
由圖2可知,在共培養時間為36 h,枯萎病菌孢子懸浮液和誘導后的農桿菌AGL1比例為1∶2、2∶1時的轉化效率分別為74.67、42.00個轉化子/107個孢子,但當其比例為1∶1時,轉化效率達到117.33個轉化子/107個孢子,極顯著高于其他比例處理。
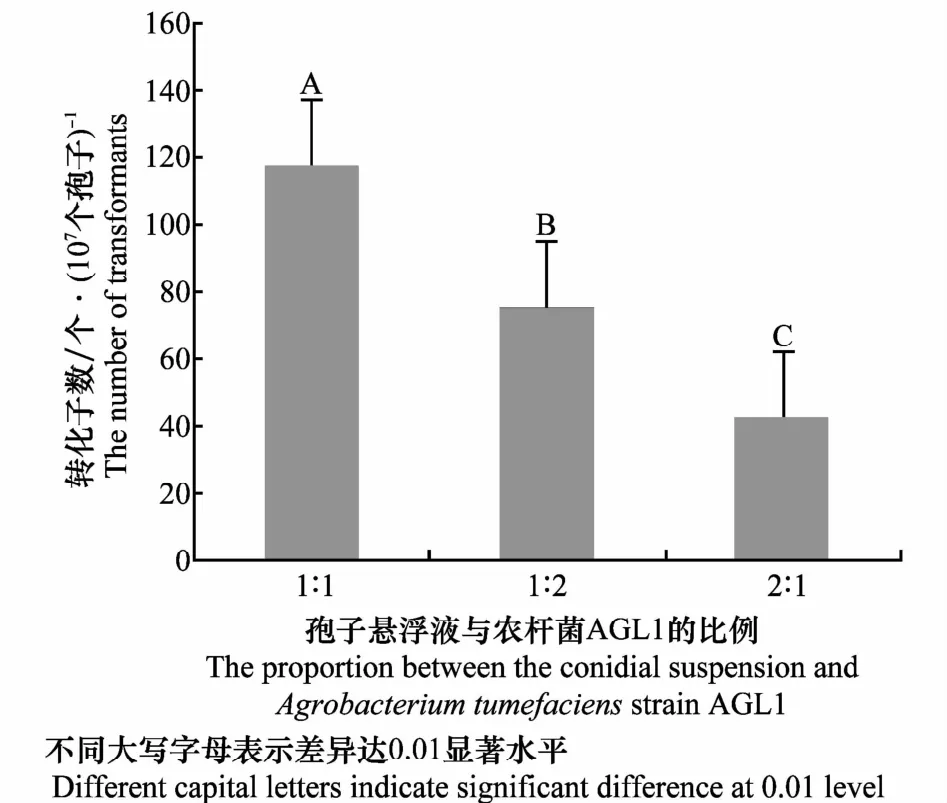
圖2 孢子懸浮液與農桿菌AGL1比例對轉化效率的影響Fig.2 Effects of the proportion between the conidial suspension andAgrobacterium tumefaciensstrain AGL1 on transformation efficiency
2.1.2 共培養時間對轉化效率的影響
在枯萎病菌孢子懸浮液和農桿菌AGL1比例為1∶1的條件下,共培養24、48、60 h的轉化效率分別為30.67、72.67、17.33個轉化子/107個孢子(圖3)。而共培養36 h的轉化效率為117.33個轉化子/107個孢子,極顯著高于其他共培養時間下的轉化效率,表明將西瓜枯萎病菌分生孢子與農桿菌AGL1共培養36 h轉化效率最高。
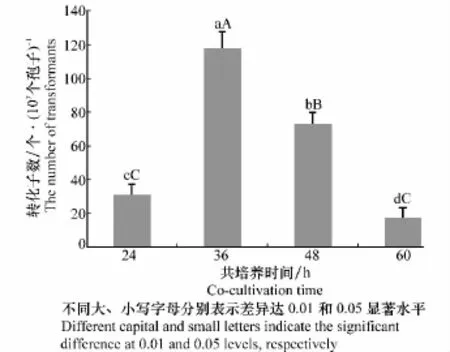
圖3 共培養時間對轉化效率的影響Fig.3 Effects of co-cultivation time on transformation efficiency
2.1.3 共培養條件
由以上兩個條件的篩選可知,當孢子和誘導后農桿菌AGL1比例為1∶1,共培養時間為36 h時,轉化效率高,當同時滿足這兩個條件時,轉化效率達到最高,為117.33個轉化子/107個孢子。
2.2 轉化子的熒光檢測
按前面敘述的方法,共獲得西瓜枯萎病菌轉化株352個,隨機挑選出10個進行熒光觀察,其轉化株4號熒光表型如圖4,轉化子所有菌體包括菌絲(圖4a)、分生孢子(圖4b)、孢子萌發的芽管(圖4c)、繼代培養后的菌體都有穩定而強的熒光信號,但在細胞質中的液泡無熒光信號(圖4d)。結果表明gfp在西瓜枯萎病菌的轉化株中得到了穩定而持續的表達。選擇菌絲、分生孢子熒光信號表達穩定而強的轉化子5個,進行下一步研究。
2.3 轉化子的致病力檢測
對從2.2轉化子的熒光檢測中篩選出的5個轉化株,通過人工接種,在無菌的條件下進行致病力的檢測,由表1可見,其中4號轉化子在不同品種上的致病力分別為85.67、93.00、67.67、52.33、10.00、5.00,與轉化前的FON1在西瓜抗、感鑒別寄主上的表現無明顯差異,將該菌株命名為FON1-sGFP,說明GFP的轉化和表達對枯萎病菌4號轉化子的致病力無明顯影響。

圖4 綠色熒光蛋白在西瓜枯萎病菌轉化子中的表達Fig.4 Expression of green fluorescent protein in transformants of watermelonFusarium oxysporumf.sp.niveum

表1 FON1及轉化子在西瓜抗、感寄主上致病力鑒定1)Table 1 Incidence of resistant and susceptible watermelon cultivars inoculated with transformants
3 小結與討論
本試驗是在參考前人關于根癌農桿菌介導的真菌轉化方法的基礎上進行的[12-16,19],成功地將gfp基因轉化到西瓜枯萎病菌1號生理小種中,單孢繼代培養多代后仍能夠穩定遺傳,且轉化效率高,操作簡單方便。
本研究最優良的轉化條件為共培養時間36 h,枯萎病菌孢子的懸浮液和農桿菌AGL1比例為1∶1,轉化效率可以達到117.33個轉化子/107個孢子。這與其他病菌的轉化條件不太相同,在玉米大斑病菌(Setosphaeria turcica)的轉化中,張嬌等得出在20℃條件下與根癌農桿菌共培養48 h,共培養介質為微孔濾膜時轉化效果最佳[19]。香蕉枯萎病菌1號生理小種(F.oxysporumf.sp.cubenserace 1)遺傳轉化體系的最優轉化體系是農桿菌A600為0.15,共培養時間為48 h[15]。甜瓜蔓枯病的最優轉化體系為農桿菌懸浮液A600為0.15,共培養時間與香蕉枯萎病菌一致,病菌的分生孢子懸浮液濃度為1×106個孢子/mL[16]。Mullins[12]對尖孢鐮刀菌的農桿菌轉化的研究中表明,影響轉化效率的因素主要有兩個,一是共培養之前在培養基中加入乙酰丁香酮(AS);二是共培養時間,在培養基中加入AS,共培養時間為48 h時,轉化效率最高,達到300~500個轉化子/106個孢子,遠遠高于本試驗的轉化效率,可能是因為載體的構成不同造成的。肖榮鳳等[17]利用PEG-CaCl2介導的原生質體轉化體系,成功地將綠色熒光蛋白基因轉入到西瓜尖孢鐮刀菌FOV-135中,每微克質粒可獲得4~6個轉化子,轉化效率較低。說明遺傳轉化效率與轉化條件、轉化方法、載體的構成及病菌本身的遺傳特性等都有關系。
對轉化株進行熒光觀察,發現轉化子菌體的菌絲、分生孢子、孢子萌發的芽管、繼代培養后的菌體都具有穩定而強的熒光信號,但在細胞質中的液泡卻無熒光信號,在熒光顯微鏡下呈暗黑色。在番茄的枯萎病菌[9](F.oxysporumf.sp.radicis-lycopersici)和水稻稻瘟病菌(Magnaporthe oryzae)[20]的gfp轉化株中發現了同樣現象。本試驗獲得的帶gfp的西瓜枯萎病菌的轉化株,可以用來觀察病菌在寄主根系內的侵染過程,為進一步揭示西瓜與枯萎病菌的互作和致病機理提供了工具。
參考文獻
[1] Miguel A,Maroto J V,San Bautista A,et al.The grafting of triploid watermelon is an advantageous alternative to soil fumigation by methyl bromide for control ofFusariumwilt[J]. Scientia Horticulturae,2004,103:9 17.
[2] 錢偉,余杭,孫耘子,等.西瓜砧木抗逆性研究[J].中國西瓜甜瓜,1995,1(4):8 10.
[3] 管懷驥,陳莉,丁克堅.幾種藥劑防治西瓜枯萎病的初步研究[J].安徽農學通報,2001,7(6):43 45.
[4] Martyn R D,Netzer D.Resistance to races 0,1 and 2 ofFusariumwilt of watermelon inCitrullussp.PI296341-FR[J]. HortScience,1991,26(4):429 432.
[5] Zhou X G,Everts K L,Bruton B D.Race 3,a new and highly virulent race ofFusariumoxysporumf.sp.niveumcausingFusariumwilt in watermelon[J].Plant Disease,2010,94(1):92 98.
[6] Zhang Z,Zhang J,Wang Y,et al.Molecular detection ofFusarium oxysporumf.sp.niveumandMycosphaerella melonisin infected plant tissues and soil[J].FEMS Microbiology Letters,2005,249(1):39 47.
[7] 徐進,莫明和,張克勤.綠色熒光蛋白(GFP)在真菌研究中的應用[J].生物技術,2004,14(6):74 77.
[8] Skadsen R W,Hohn T M.Use ofFusarium graminearumtransformed withgfpto follow infection patterns in barley andArabidopsis[J].Physiological and Molecular Plant Pathology,2004,64(1):45 53.
[9] Lagopodi A L,Ram A F,Lamers G E,et al.Novel aspects of tomato root colonization and infection byFusariumoxysporumf.sp.radicis-lycopersicirevealed by confocal laser scanning microscopic analysis using the green fluorescent protein as a marker[J].Molecular Plant-Microbe Interactions,2002,15(2):172 179.
[10]Oren L,Ezrati S,Cohen D,et al.Early events in theFusarium verticillioides-maize interaction characterized by using a green fluorescent protein-expressing transgenic isolate[J].Applied and Environmental Microbiology,2003,69(5):1695 1701.
[11]O′Connell R,Herbert C,Sreenivasaprasad S,et al.A novelArabidopsis-Colletotrichumpathosystem for the molecular dissection of plant-fungal interactions[J].Molecular Plant-Microbe Interactions,2004,17(3):272 282.
[12]Mullins E D,Chen X,Romaine P,et al.Agrobacterium-mediated transformation ofFusarium oxysporum:an efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2001,91(2):173 180.
[13]劉建光,王艷輝,張國珍,等.農桿菌介導的玉米大斑病菌的遺傳轉化[J].植物病理學報,2007,37(6):675 678.
[14]李二峰,王殿東,楊宇紅,等.根癌農桿菌介導甘藍枯萎病菌的遺傳轉化[J].中國蔬菜,2011,1(14):28 34.
[15]林妃,曾濤,曾會才.香蕉枯萎病菌1號生理小種遺傳轉化體系的建立[J].熱帶作物學報,2010,31(10):1790 1796.
[16]任海英,方麗,李崗,等.農桿菌介導的甜瓜蔓枯病菌遺傳轉化體系的建立[J].生物工程學報,2010,26(6):802 808.
[17]肖榮鳳,朱育菁,李燕丹,等.西瓜尖孢鐮刀菌FOV-135的綠色熒光蛋白基因轉化[J].福建農業學報2009,24(6):521 524.
[18]耿麗華,郭紹貴,呂桂云,等.西瓜枯萎病菌生理小種鑒定技術體系的建立和驗證[J].中國蔬菜,2010,1(20):52 56.
[19]張嬌,谷守芹,李青為,等.根癌農桿菌介導的玉米大斑病菌轉化條件的優化[J].河北農業大學學報,2010,33(4):85 88,108.
[20]Campos-Soriano L,San Segundo B.Assessment of blast disease resistance in transgenicPRmsrice using agfp-expressingMagnaporthe oryzaestrain[J].Plant Pathology,2009,58:677 689.
Agrobacterium tumefaciens-mediated transformation ofFusarium oxysporumf.sp.niveum
Ren Junjie, Wang Lixia, Gao Hongbo, LüGuiyun
(Agricultural University of Hebei,Baoding071001,China)
The purpose of this study is to obtain GFP-tagged transformants ofFusarium oxysporumf.sp.niveumrace 1,which can be used to study colonization of watermelon roots by the pathogen ofFusariumwilt.F.oxysporumf.sp.niveumrace 1 was transformed with the pCH-sGFP transformation vector usingAgrobacterium tumefaciensAGL1.The results indicated that the transformation efficiency was the highest at 117.33 transformants/107conidia when the mix was co-cultivated for 36 h with an equal volume of conidial suspension andA.tumefaciensAGL1.The expression of green fluorescent protein in the hyphae,conidia and germinating spores of the transformants were stable with strong green fluorescent signal.Pathogenicity tests confirmed that the mean disease severity caused by the isolate FON-sGFP was not significantly different from that of the wild-type isolate FON1.FON1-sGFP might be a useful tool for visualizing colonization process of watermelon roots byF.oxysporumf.sp.niveum.
Fusarium oxysporumf.sp.niveum; watermelon; transformation; green fluorescent protein
S 436.5
A
10.3969/j.issn.0529 1542.2015.01.018
2014 02 17
2014 05 28
國家自然科學基金項目(31201632);河北省自然科學基金項目(C2012204072);河北省高等學校科學技術研究青年基金項目(2011173)
*通信作者 E-mail:guiyunlv@hebau.edu.cn

