化學理論教學中培養學生反思性學習能力的實踐——以“化學反應的方向”的教學為例
朱衛華(江蘇省無錫市第一中學 江蘇無錫 214031)
化學理論教學中培養學生反思性學習能力的實踐——以“化學反應的方向”的教學為例
朱衛華
(江蘇省無錫市第一中學江蘇無錫214031)
摘要:高中化學課程標準提出要提高學生自主學習化學的能力,反思性學習是實現這一目標的有效方式。文章以“化學反應的方向”的教學為例,介紹了在理論教學中培養學生反思性學習能力的教學過程。
關鍵詞:化學理論教學;反思性學習;化學反應的方向
中圖分類號:
文章編號:1008-0546(2015)02-0042-03G633.8
文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2015.02.013
一、化學理論教學中進行反思性學習的思考
高中化學課程目標中提出要提高學生“自主學習化學的能力”[1],反思性學習是實現這一目標的有效方式。所謂反思性學習,就是通過對學習活動過程的反思來進行學習。用元認知的理論來描述,就是學習者對自身學習活動的過程以及活動過程中所涉及的有關事物、材料、信息、思維、結果等學習特征的反向思考。它包含兩層意思:一是對整個思維過程進行檢查,檢驗策略是否合理,答案是否正確等;二是評估問題的解決過程中值得吸收的經驗,并對認知結構進行必要的調整。因此,反思性學習不僅僅是對學習的一般性回顧或重復,而是探究學習活動中所涉及的知識、方法、思路、策略等,具有較強的科學研究性質。反思的目的也不僅僅是為了回顧過去或培養元認知意識,更重要的是指向未來的活動。通過反思性學習可以幫助學生學會學習;可以使學生的學習成為探究性、研究性的活動;可以增強學生的能力,提高學生的創造力,促進他們的全面發展[2]。
反思性學習的基本環節可以概括為以下七個階段:反省階段、評判階段、察覺問題階段、界定問題階段、確定對策階段、實踐驗證階段、總結提高階段。實際的反思活動中,以上七個階段往往前后交錯,界限不甚分明[2]。
化學基本理論的學習能幫助學生深入理解元素化合物知識,能促進學生的化學反應知識系統化、結構化,能幫助學生發展邏輯推理能力,能促進學生的化學素養。以化學反應的方向為例,它可以讓學生了解化學反應的調控原理,讓學生更全面地認識化學反應,拓展學生的視野,提升學生的綜合素質。但是這節課的理論性較強,概念比較抽象,學生理解有一定的難度。因此,教學過程中,要避免填鴨式地羅列理論,應盡可能啟發學生開動腦筋、動手實踐,經過反省、評判、界定等理性思考之后確定方案,再通過實踐驗證歸納生成理論,而這恰恰是反思性學習的基本環節。
這節課的實施能讓學生初步根據反應的焓變、熵變判斷化學反應的方向;在反思探討影響化學反應自發因素時,使學生體會事物的發展變化常常受多種因素制約,培養學生分析、研究問題的全面性,通過反思性學習會幫助學生學會學習,提高自主學習化學的能力;通過聯系生產生活,認識到化學反應原理在生產生活中的重要作用,發展學習化學的興趣。
二、教學過程
1.認識化學反應的方向性
為了能使學生直觀地感受化學反應的方向,教師設計了以下的實驗。
[引入]向盛有雞蛋殼的燒杯中加入鹽酸,其中發生了怎樣的化學反應?
[學生]CaCO3+2HCl=CaCl2+H2O+CO2↑
[追問]倒過來,向氯化鈣溶液中通入CO2氣體,會生成沉淀嗎?
[學生]思考,猜想。
[學生實驗]用塑料吸管向氯化鈣溶液中吹入CO2氣體驗證,無明顯現象。
[小結]看來化學反應具有方向性,許多反應的正反應能自動進行,而其逆反應無法自動進行,又如鋅與硫酸銅溶液的反應、鹽酸和氫氧化鈉的中和反應等等。
設計意圖:熟悉的化學反應可以讓學生很自然地進入探究狀態,簡單易行的實驗驗證可以順暢引出本節課的主題。
2.反省評判,察覺能量因素
[教師]像這些正反應一樣,在一定溫度和壓強下,無需外界幫助就能自動進行的反應,我們稱之為自發反應。這些化學反應為什么能自發進行,具有怎樣特征的化學反應是自發反應呢?
[提問]請大家列舉你熟悉的自然界中的自發過程。
[學生]水由高處自發往低處流,石頭從山坡上自發滾下。
[教師]這些自發過程有什么共同點?
[學生]自發過程發生后,體系的能量降低。
[教師]那么,怎樣的化學反應能自發進行?
[學生]放熱反應,反應后,體系的能量降低。
設計意圖:學生通過反省、廣泛搜集有關的生活經驗,對它們進行認真地分析,察覺到問題的根源,并提出假設。在反思性學習的七個階段中,察覺問題階段是一個關鍵的環節,反思集中體現在此階段。
3.實踐驗證,發現僅從能量因素研究反應自發性的局限性
[教師]研究表明,對于化學反應而言,絕大多數的放熱反應都能自發進行,且反應放出的能量越多,反應就越完全。
[學生]驗證剛才的三個自發反應。
[教師]放熱反應一般能自發,那么吸熱反應就一定不是自發反應嗎?
[學生]思考,猜想,實驗驗證。少量氯化銨固體和氫氧化鋇晶體置于小氣球中,扎緊密封小氣球后,手捏混勻固體,用手摸氣球外壁。
[教師]C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131.3kJ /mol、CaCO3
=CaO+CO2都是吸熱反應,在高溫下也是自發反應。
[學生]吸熱反應也可以自發,只根據焓變判斷反應是否自發是不全面的,焓變只是制約化學反應能否自發進行的因素之一。
設計意圖:氯化銨固體和氫氧化鋇晶體的反應會產生刺激性氣體氨氣,利用小氣球設計成微型實驗,既環保又節約試劑。學生通過實踐檢驗以上階段所形成的規律,這時,如果能夠解釋當前的疑惑,說明檢驗成功,問題解決了,于是進入總結提高階段;如果不能,或者在檢驗過程中遇到新的具體問題,又會進入反思的第一環節,開始新的循環。
4.認識化學反應中的熵變因素
[教師]還有什么因素會制約反應能否自發呢?能不能也從生活中的現象得到啟發?
[學生探索]拿出火柴盒,里面的火柴井然有序,倒出來立刻就亂了,很難恢復到原來的井然有序。
[教師]墨水滴入水中能自發擴散成無序的狀態,恢復到原來的狀態很難;房間收拾整齊,弄亂很容易,重新恢復原樣很困難;體育課解散,同學自由活動很容易,重新集合整隊很困難。
[學生領悟]有序體系都趨向于變為無序體系,趨向于混亂。化學反應也是如此,如果反應體系的混亂度增大,該反應往往能自發進行。
[資料]1850年,德國物理學家克勞修斯引入了一個新的物理量——熵,用符號S表示,來表示任何一種能量在空間中分布的混亂程度,能量分布得越混亂,熵就越大,也可以用來衡量一個體系的混亂度,體系越混亂,熵值也就越大。
[閱讀]根據所給的《無機化學》中附表一些物質的熵值,歸納熵值的特點。
[學生]熵(S)——S(氣)>S(液)>S(固);氣體越多,體系熵越大。
設計意圖:學生翻閱大學教材,查找所需的信息,有利于培養學生查閱資料的能力,提升學生的學科素養。
[提問]為什么那三個吸熱反應是自發反應?
[學生]熵增的反應,所以能自發。
5.焓變和熵變走向融合
[追問]熵減的反應一定不能自發進行嗎?工業上合成氨的反應和鎂條燃燒的反應是熵增的反應還是熵減的反應?
[學生疑問]熵減的反應。
[教師]為什么這兩個反應能自發進行?
[學生領悟]因為這兩個反應是放熱反應ΔH<0。看來,只根據熵變來判斷反應是否自發也是不全面的,熵變也只是制約化學反應能否自發進行的一個因素。
設計意圖:學生通過提出新的對策、實踐驗證,可以不斷地總結優化,最終發現焓變和熵變是制約化學反應能否自發的兩個因素。
[教師]要判斷一個化學反應是否能自發進行,必須綜合考慮反應的焓變和熵變,怎么綜合考慮呢?
[學生]思考以下反應能否自發以及焓變和熵變:
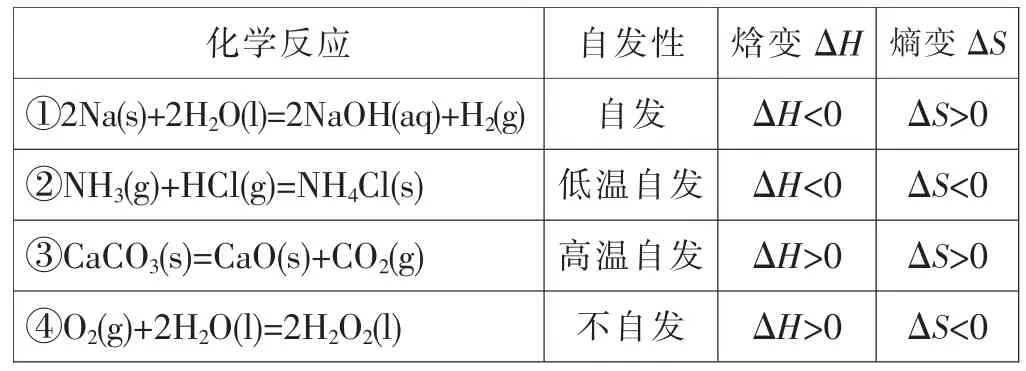
化學反應 自發性 焓變ΔH熵變ΔS ①2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) 自發 ΔH<0 ΔS>0 ②NH3(g)+HCl(g)=NH4Cl(s) 低溫自發 ΔH<0 ΔS<0 ③CaCO3(s)=CaO(s)+CO2(g) 高溫自發 ΔH>0 ΔS>0 ④O2(g)+2H2O(l)=2H2O2(l) 不自發 ΔH>0 ΔS<0
[學生小結]ΔH<0、ΔS>0的反應,必定自發進行;ΔH>0、ΔS<0的反應,必定不自發;ΔH<0、ΔS<0的反應,低溫自發進行;ΔH>0、ΔS>0的反應,高溫自發進行;看來,兩個因素只滿足一個的反應,能否自發取決于溫度。
[化學史]1878年美國著名科學家吉布斯經過大量研究,提出了一個綜合考慮焓變和熵變的公式,可以判斷恒溫恒壓體系下化學反應能否自發進行:ΔH-T ΔS<0
[學生]利用上面的四個化學反應驗證此公式。
[教師]為何向氯化鈣溶液中吹入CO2,不能發生反應?
[學生]ΔH-TΔS>0,不能自發進行。
[教師]汽車尾氣中的主要污染物是NO和CO,為了減輕大氣污染,人們提出通過以下反應來處理汽車尾氣:2NO(g)+2CO(g)=N2(g)+2CO2(g),此方案可行嗎?(298K、100kPa下,該反應的ΔH=-746.8kJ/mol ΔS=-197.5J·mol-1·K-1)
[學生]低溫即可自發。
[教師]低溫時反應速率太慢,怎么辦?
[學生]使用催化劑加快反應速率。
[教師]通常使用鈀、鉑作為催化劑,將其裝入汽車尾氣凈化器中,并將凈化器與汽車尾氣排放管道連接在一起。利用這個裝置,可以有效地將汽車尾氣中的污染物NO和CO同時除去。
[教師]2H2O(g)=2H2(g)+O2(g)是焓增熵增的反應,理論上來講高溫自發,通過數據可以計算出它的分解溫度為10500℃左右的高溫,很難實現,因此實際可認為此反應不自發。那么如何使此反應發生呢?
[學生]電解
[教師]不自發的反應要發生需要外界幫助,主要就是指電解等方式。
設計意圖:對于自發反應的定義中的“無需外界幫助”,學生會誤認為加熱、加壓等方式,通過這個反例,可以讓學生體會其真正含義。
[教師]值得注意的是,研究反應自發性只是研究了反應的可能性,實際工業生產的時候,還要考慮兩個方面:1.反應的速率,有些反應比如2H2(g)+O2(g)=2H2O(g)室溫能自發,但常溫下因為反應速率太慢幾乎不反應,此類反應為了加快反應速率,一般采用高溫;2.大多數化學反應都是可逆反應,存在反應的限度,也要選擇合適的反應條件,達到所需的限度。
設計意圖:如果學生將化學知識應用于生產、生活實踐中,可以對化學有關的社會和生活問題做出合理的判斷,發展學習化學的興趣。
反思性學習是提高學生自主學習能力的一種有效方式,當然,讓學生學會反思、提高反思性學習能力,并非一朝一夕的事,它需要教師遵循“循序漸進”的原則和“始終如一”的耐心對學生進行培養,使反思性學習成為一種常態的學習方法,而不是特例。這樣,常態的方法成為習慣,長期的習慣成為意識,長期的意識養成能力,實現真正意義上的反思性學習。
參考文獻
[1]教育部.普通高中化學課程標準(實驗)[S].北京:人民教育出版社,2003:7-8
[2]鄭菊萍.反思性學習簡論[J].上海教育科研,2002,(8):43-45

