成人重癥哮喘發(fā)病機制及治療的進展
成人重癥哮喘發(fā)病機制及治療的進展
馮維宋旸李滿祥
作者單位: 710061 西安,西安交通大學第一附屬醫(yī)院呼吸內(nèi)科
【關(guān)鍵詞】重癥哮喘;發(fā)病機制;治療
支氣管哮喘是一種世界范圍內(nèi)常見的慢性呼吸道疾病[1-2]。目前全球約有3億患者,每年約有25萬人死亡[3-4]。隨著全球哮喘防治創(chuàng)議(GINA)的推廣,大部分輕至中度哮喘患者經(jīng)過科學、規(guī)范的治療,可以達到哮喘癥狀控制的目標。然而部分確診為哮喘的患者,盡管經(jīng)過長期規(guī)范化治療,甚至使用大劑量糖皮質(zhì)激素,癥狀仍難以控制,同時還要承受使用激素帶來的不良反應(yīng),這部分患者被稱為重癥哮喘。這類患者比例約占10%~20%,具有很高的住院率及病死率,發(fā)生急性惡性事件風險大,醫(yī)療費用高,嚴重影響患者的生活質(zhì)量,因而造成巨大的社會負擔。因此,探究該部分患者的遺傳特性、病理生理及臨床特點,對這類患者的長期治療和管理有很重要的臨床實踐意義[5]。
一、重癥哮喘的概念
目前,國內(nèi)外對于重癥哮喘尚無統(tǒng)一定義。2013年美國胸科學會/歐洲呼吸學會(ERS/ATS)對重癥哮喘的定義是:確診為哮喘,在過去1年內(nèi)需要按照指南建議,采用GINA推薦4~5級哮喘藥物治療方案,同時控制并存狀態(tài)(或疾病),去除誘發(fā)因素后,仍不能良好控制的哮喘,見表1,2;或得到控制的哮喘,在使用大劑量吸入糖皮質(zhì)激素或全身激素(或聯(lián)合生物制劑)后減量時發(fā)生惡化。在此共識中,4~5級藥物治療方案指:成人吸入氟替卡松量>500 μg/d(或其等價劑量),并吸入長效β2受體激動劑等兩種或兩種以上緩解藥物,或全身激素治療≥50%的時間[6]。

表1 常用ICS高劑量表[6]
注:DPI:干粉吸入劑;CFC:氯氟烴;MDI:定量噴霧器;HFA:氫氟烷基化合物

表2 哮喘控制不佳評估標準表[6]
注:上述4項標準,有1項滿足即可
2010年中華醫(yī)學會呼吸病學分會哮喘學組規(guī)定了重癥哮喘的診斷標準,滿足以下3條標準,可診斷為重癥哮喘:①按照我國哮喘防治指南中哮喘的診斷標準,確診為哮喘;②排除患者治療依從性不良,誘發(fā)加重或使哮喘變得難以控制的因素;③按照我國哮喘防治指南,采用第4級治療方案,即使用2種以上控制性藥物規(guī)范治療,同時管理超過6個月,仍不能達到理想控制目標[8]。
二、重癥哮喘的危險因素
哮喘的病因與患者的遺傳過敏體質(zhì)及外界環(huán)境觸發(fā)因素相關(guān)。某些危險因素甚至能誘發(fā)加重哮喘,使癥狀變得難以控制。因此,充分認識這些危險因素,能有效避免哮喘急性發(fā)作,防止病情進一步惡化,對該病的長期控制具有重要意義。
1. 宿主危險因素
(1)遺傳因素:哮喘是一種具有遺傳傾向的疾病,受多基因調(diào)控,目前發(fā)現(xiàn)多個染色體區(qū)域與哮喘相關(guān),包括1p36,2q14,4q13,5q31,6p24,7p14,11q13,12q24,13q14,14q24,16q23-21,20p。重癥哮喘也存在遺傳易感性,目前多認為與受體基因突變及多態(tài)性有關(guān)。在重癥哮喘患者中,β2腎上腺素能受體基因上16位的精氨酸被甘氨酸替換概率較高[9-10];研究還表明,轉(zhuǎn)化生長因子(transforming gronth factor-β, TGF-β)和單核細胞趨化蛋白-1基因突變,可促進氣道纖維化,加重氣道重塑發(fā)生發(fā)展;ADAM33基因產(chǎn)物過表達或修復(fù)機制異常,也可導(dǎo)致氣道重塑的形成及哮喘的發(fā)生發(fā)展。值得注意的是,先天遺傳因素和后天環(huán)境因素在哮喘的發(fā)病中均起著重要作用。
(2)共存疾病或狀態(tài):研究發(fā)現(xiàn)在重癥哮喘患者中常伴發(fā)某些共存的疾病或狀態(tài),這些均能加重哮喘癥狀及急性發(fā)作的次數(shù),如胃食管反流、肥胖、慢性鼻炎/鼻竇炎、阻塞性睡眠呼吸暫停低通氣綜合征及精神心理因素等[11]。
(a)胃食管反流病:因酸性胃內(nèi)容物誤吸入氣道直接或通過食管間接刺激,興奮氣道內(nèi)迷走神經(jīng)感受器,反射性地引起氣道平滑肌收縮,加重哮喘癥狀。因此,對合并胃食管反流患者,單純使用抗喘藥物治療效果不佳時,治療本病可改善肺功能情況[11-12]。
(b)慢性鼻炎/鼻竇炎:在重癥哮喘患者中十分常見,其嚴重程度與哮喘氣道炎癥和肺功能降低程度呈正相關(guān)。當發(fā)生慢性鼻炎或鼻竇炎時,可通過以下機制加重哮喘發(fā)作:鼻黏膜上皮細胞受到病原體刺激, 通過鼻-肺反射途徑,引起氣道平滑肌收縮;鼻腔內(nèi)的微生物順行進入支氣管, 可加重氣道炎癥。因此,對伴有鼻炎或鼻竇炎的哮喘患者, 在給予哮喘藥物治療的同時采取適當?shù)氖侄沃委煴茄谆虮歉]炎,能較好控制哮喘癥狀[13-14]。
(c)阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea-hypopnea syndrome, OSAHS):研究表明,肥胖是OSAHS的危險因素之一,而在肥胖兒童中哮喘的發(fā)生率較高,說明OSAHS也是哮喘的危險因素之一。合并OSAHS的哮喘患者,有更高的氣道反應(yīng)性,其可能原因有以下方面:OSAHS患者常在睡眠時發(fā)生呼吸暫停,通過刺激喉、聲門處神經(jīng)受體,引起支氣管反射性收縮,導(dǎo)致夜間癥狀加重;OSAHS患者常存在上呼吸道狹窄,氣道阻力及迷走神經(jīng)張力增高,可誘發(fā)哮喘急性發(fā)作[8]。
(d)肥胖:研究表明, 肥胖是兒童及成人哮喘的重要危險因素之一。在合并哮喘的兒童中,肥胖可能導(dǎo)致對吸入性糖皮質(zhì)激素敏感性降低[15]。在一項對102例成人重癥哮喘患者進行體質(zhì)量指數(shù)(body mass index, BMI)與哮喘控制程度評價中,隨著BMI增加,ACQ評分增加,F(xiàn)EV1、FVC、FEV1/FVC降低,使用口服糖皮質(zhì)激素聯(lián)合長效β激動劑(long acting β agonist, LABA)時間更長,合并Ⅱ型糖尿病或OSAS的病例數(shù)更多,說明肥胖是重癥哮喘發(fā)生的重要危險因素[16]。其可能的機制是:肥胖狀態(tài)下,白色脂肪含量增加,脂肪組織中大量巨噬細胞浸潤,釋放白介素-1β(interleukin-1β, IL-1β)IL-1β通過活化并增殖Th-17細胞介導(dǎo)炎癥反應(yīng),加重氣道高反應(yīng)性[16]。
(e)精神心理因素:調(diào)查發(fā)現(xiàn)患者的情緒波動常與哮喘的發(fā)作有密切的聯(lián)系[17]。當長期處于抑郁或焦慮狀態(tài)時,哮喘發(fā)作次數(shù)明顯比情緒平穩(wěn)時高。此外,哮喘本身也會引起患者消極或過激的情緒反應(yīng)。不良的心理因素是導(dǎo)致哮喘發(fā)病及影響療效的重要因素。因此重癥哮喘患者更應(yīng)該注重保持積極的心態(tài),保持情緒平穩(wěn)[17]。
(3)依從性差:哮喘是一種需要長期規(guī)律藥物控制的慢性疾病,提高患者的依從性能保證預(yù)期的治療效果。林江濤等[17]發(fā)現(xiàn)治療依從性差是我國重癥哮喘最重要和最常見的危險因素之一。患者依從性差,長期慢性炎癥不能控制,在外界誘因刺激下哮喘癥狀進一步加重。所以,當醫(yī)生發(fā)現(xiàn)患者療效與預(yù)期情況不符合時,應(yīng)首先想到患者的依從性不良問題。而如何評估患者依從性并及時處理, 對患者的治療療效有很重要的意義[8,17]。
2. 外界環(huán)境因素
(1)呼吸道感染:呼吸道感染是重癥哮喘急性加重的重要危險因素之一。急性上呼吸道感染可使哮喘癥狀明顯加重,肺功能急劇惡化。真菌感染與重癥哮喘的急性發(fā)作及嚴重程度相關(guān)。通過支氣管肺活檢發(fā)現(xiàn),依賴口服糖皮質(zhì)激素、急性事件頻繁發(fā)生的重度哮喘患者氣道內(nèi)以嗜酸粒細胞和肥大細胞浸潤為主。肥大細胞活化、脫顆粒,釋放炎性介質(zhì)(IL-4和白三烯B4),在促進炎癥反應(yīng)發(fā)生發(fā)展中扮演重要角色。這提示重癥哮喘可能與潛在病毒感染有關(guān)[17]。研究表明,在成人哮喘急性發(fā)作中,大約60%的急性發(fā)作與上呼吸道感染有關(guān),其中HRV-C、呼吸道合胞病毒、流感病毒感染可導(dǎo)致重癥哮喘急性發(fā)作致死性事件發(fā)生[18]。
(2)吸煙:吸煙是多種慢性病的病因之一,同時吸煙也是哮喘發(fā)病的危險因素之一。無論是主動吸煙還是被動吸煙,均可加速肺功能惡化,加重哮喘病情,降低哮喘藥物治療的有效性[3]。吸煙的損害主要表現(xiàn)為:①增加氣道高反應(yīng)性;吸煙的哮喘患者可同時具有哮喘癥狀和早期慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的某些特點,如氣道中性粒細胞浸潤為主的炎癥、肺過度充氣、肺彌散功能降低和更多的肺氣腫樣影像學表現(xiàn)。Willemse等[19]發(fā)現(xiàn),在戒煙后1年,氣道高反應(yīng)性仍然存在;②激素反應(yīng)性下降;Kobayaski等[20]研究結(jié)果顯示,被動吸煙組兒童氣道巨噬細胞中HDAC2呈過表達,Ak1磷酸化水平與HDAC2活性負相關(guān),推測煙草煙霧通過氧化應(yīng)激作用活化PI3K/Akt信號通路,抑制HDAC2的轉(zhuǎn)錄表達,阻斷激素抗炎作用中抗炎因子基因轉(zhuǎn)錄過程,從而降低激素敏感性;③加重氣道重塑;郭志宏等[21]研究結(jié)果顯示,吸煙組氣道壁厚度、Ⅲ型膠原和TGF-β1 mRNA表達水平均有增高。并且隨著TGF-β1 mRNA表達水平增高,Ⅲ型膠原水平也增高;王銳英等[22]研究結(jié)果顯示,吸煙組氣道壁厚度明顯增加,肺組織中MMP-9和TIMP-1過度表達,比例失調(diào)。推測煙草煙霧可通過以下二方面加重哮喘的氣道重塑:一方面,可能通過TGF-β1 mRNA的過度表達,增加了氣道上皮下Ⅲ型膠原表達;另一方面,通過影響MMP-9/TIMP-1表達比例失衡,導(dǎo)致氣道壁細胞外基質(zhì)沉積增多。
三、發(fā)病機制
哮喘的發(fā)病機制尚不完全清楚。免疫-炎癥反應(yīng)是形成哮喘的病理基礎(chǔ)。在輕中度哮喘患者中,經(jīng)典的發(fā)病模式是以CD4+Th2細胞為主,誘導(dǎo)B細胞合成的特異性IgE抗體介導(dǎo)的免疫炎癥反應(yīng)(圖1)。氣道長期慢性炎癥和高反應(yīng)性,引起一系列咳嗽、氣短、喘息等哮喘發(fā)作癥狀。而重癥哮喘不同于輕-中度哮喘,它具有獨特的炎癥過程。在重癥哮喘患者的氣道內(nèi)有更多的嗜中性粒細胞浸潤、組織損傷及氣道重塑。

圖1支氣管哮喘氣道炎癥反應(yīng)[26,35]
1.氣道炎癥:重癥哮喘的氣道炎癥具有異質(zhì)性,存在不同的氣道炎癥表型[23]。Gibson等[24]通過誘導(dǎo)痰檢查分析,成人哮喘氣道炎性細胞表型可分為:①嗜酸粒細胞增多型:約50%的哮喘患者,尤其是在輕、中度哮喘患者中,持續(xù)氣道嗜酸性粒細胞增多,表現(xiàn)為氣道內(nèi)以嗜酸性粒細胞浸潤為主的變態(tài)反應(yīng)性炎癥。嗜酸性粒細胞增多被認為與CD4+Th2細胞釋放IL-5有關(guān),IL-5募集嗜酸性粒細胞到氣道并活化,促進其生成。嗜酸性粒細胞釋放半胱氨酸-1、白三烯、活性氧(reactive oxygen species, ROS),導(dǎo)致支氣管收縮、黏液分泌增加。在此類型中伴有Th2細胞相關(guān)細胞因子表達增加,如IL-4、IL-13,誘導(dǎo)B細胞合成分泌IgE,發(fā)生一系列IgE介導(dǎo)的免疫-炎癥反應(yīng)[23]。然而在成人遲發(fā)性嗜酸性粒細胞增多的重癥哮喘患者中,使用激素治療后效果不佳,提示對激素反應(yīng)不敏感,但使用抗IL-5單克隆抗體(mepolizumab)后有效,可能與嗜酸粒細胞凋亡功能缺陷,以及大量前炎性介質(zhì)干擾激素抗炎作用有關(guān)[25];②中性粒細胞增多型:表現(xiàn)為氣道內(nèi)以中性粒細胞浸潤為主,在重癥哮喘患者中多見。AL-Ramli 等[26]發(fā)現(xiàn)重度哮喘患者氣道內(nèi)IL-17 表達水平增加, 而Zhao等[27]也發(fā)現(xiàn)在重度哮喘患者外周血中Thl7細胞水平增加,由此可見Th17細胞及其相關(guān)細胞因子IL-17參與了重癥哮喘慢性炎癥的病理過程。Th17細胞活化后產(chǎn)生IL-17,聯(lián)合粒細胞刺激因子,誘導(dǎo)骨髓CD34+粒細胞,刺激中性粒細胞活化增生,募集至氣道;同時,通過作用于氣道上皮細胞,釋放IL-8,抑制中性粒細胞凋亡、促進分化,使中性粒細胞數(shù)量增多。活化的中性粒細胞還可以產(chǎn)生多種細胞因子,如MMP-9、氧自由基、白三烯B4等產(chǎn)物,參與氣道及肺組織的損傷過程。體外實驗發(fā)現(xiàn),IL-17能促進GR-β表達增加,競爭性抑制正常GR-α的抗炎作用,這或許可以解釋此類型哮喘患者對激素不敏感的原因;③少炎癥細胞型:表現(xiàn)為痰液內(nèi)上述細胞均不增多,而以氣道平滑肌的異常增生肥大為主要特征,其發(fā)生機制尚不清楚,可能與氣道重塑導(dǎo)致的氣道狹窄有關(guān)。值得肯定的是,無論患者氣道內(nèi)以何種類型細胞浸潤為主,重癥哮喘患者都存在著持續(xù)嚴重的、未被控制的氣道炎癥,這是導(dǎo)致哮喘難治的重要原因之一。
2.氣道結(jié)構(gòu)改變:傳統(tǒng)上哮喘定義中包括可逆性氣道受限,在實際中常發(fā)現(xiàn)哮喘患者氣道并不完全可逆。通過胸部高分辨CT檢查發(fā)現(xiàn)重癥哮喘患者的氣道壁厚度、氣道壁面積與氣道總截面積之比明顯高于健康對照者,說明重癥哮喘患者氣道結(jié)構(gòu)發(fā)生了不可逆的改變。氣道長期慢性炎癥反復(fù)發(fā)作,伴隨各種炎癥因子的釋放,氣道炎性“損傷-修復(fù)-再損傷-再修復(fù)”循環(huán)導(dǎo)致氣道組織結(jié)構(gòu)發(fā)生不可逆改變,進而形成重塑。氣道重塑涉及多個方面,目前研究較多的特征性病理改變主要包括:上皮細胞的損傷與脫落,基底膜增厚,呼吸道平滑肌細胞增生和肥大,杯狀細胞化生,黏液分泌增加,血管生成等。長期慢性炎癥,導(dǎo)致氣道上皮損傷,啟動修復(fù)機制,釋放活性生長因子,如表皮生長因子、血小板衍生生長因子、胰島素樣生長因子、成纖維生長因子等。這些生長因子可活化上皮下成纖維細胞,同時促進成纖維細胞增殖,膠原纖維大量增生,進而引起基底膜的增厚。TGF-β被認為是重癥氣道重塑發(fā)展過程中的關(guān)鍵細胞因子之一,參與上皮下纖維化及平滑肌細胞肥大的病理過程。研究發(fā)現(xiàn)重癥哮喘患者呼吸道中上皮下細胞增生,能分泌大量的TGF-β,提示TGF-β參與了哮喘患者的氣道重塑及肺功能損害。多種炎性細胞及結(jié)構(gòu)細胞也能分泌TGF-β,如嗜酸性粒細胞、中性粒細胞、肺泡巨噬細胞及活化的上皮細胞。TGF-β不僅能活化纖維組織母細胞,促進膠原纖維增生,引起上皮下基底膜的增厚,還能與多種促炎性因子共同作用,促進上皮細胞間質(zhì)轉(zhuǎn)化,導(dǎo)致上皮下纖維化。有學者認為,能區(qū)分輕、重癥哮喘最有價值的病理特征是在大氣道標本中平滑肌細胞的數(shù)量和每個平滑肌細胞體積的改變。氣道平滑肌細胞增生肥大,導(dǎo)致氣道不可逆阻塞,F(xiàn)EV1不可逆下降,支氣管擴張藥物治療的有效性也下降。
3. 激素反應(yīng)性低:在吸入激素治療效果不佳時,常需要使用口服激素治療,但在重癥哮喘治療中,大劑量激素治療并不能降低患者嗜酸性粒細胞數(shù)量,提高FEV1,提示這部分人群對激素反應(yīng)性降低,而不是完全的激素抵抗。原發(fā)性激素反應(yīng)性低為遺傳因素所致,可能與激素受體基因或調(diào)控激素受體功能基因突變有關(guān),從而導(dǎo)致某些細胞因子產(chǎn)生過多,如IL-4。過多產(chǎn)生的IL-4可通過降低低GR與配體的結(jié)合力而保持對激素的抵抗。此類型還伴有原發(fā)性糖皮質(zhì)激素抵抗綜合征的臨床表現(xiàn);繼發(fā)性激素反應(yīng)性低則是重癥哮喘的機制之一。糖皮質(zhì)激素(glucocorticoids, GCS)發(fā)揮抗炎作用的機制是(見圖2):在分子水平上,GCS與其受體(GR)結(jié)合,受體構(gòu)象改變,釋放hsp90,形成GCS-GR復(fù)合體,與細胞核內(nèi)靶基因啟動子序列的GRE單元結(jié)合,促進抗炎細胞因子基因的轉(zhuǎn)錄,發(fā)揮抗炎作用。另一方面,GCS-GR復(fù)合體形成后,促進組蛋白去乙酰化酶2(histone deacetylase 2, HDAC2)對GR的脫乙酰作用,使之與NF-κB、AP-1結(jié)合,使這些炎癥轉(zhuǎn)錄因子失去活性,抑制前炎性細胞因子的基因轉(zhuǎn)錄,通過減少炎性細胞因子而發(fā)揮抗炎作用。但在重癥哮喘中,GCS與GR結(jié)合后核轉(zhuǎn)運能力降低,與DNA親和力降低。其可能的機制有:①GR-α活性降低。糖皮質(zhì)激素受體有2種亞型:正常的GR-α和變異片段GR-β。當某些激酶活性改變,如 p38絲裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)α、γ,c-Jun N-末端激酶1(JNK-1),導(dǎo)致正常的GR-α磷酸化,結(jié)構(gòu)改變,形成的復(fù)合物核轉(zhuǎn)運能力下降,與DNA親和力降低;②GR-β受體過量表達,競爭性抑制正常的α受體活性。促炎因子如P38MAPK可增加激素β受體的表達;③HDAC2表達下降。HDAC2被認為參與GCS抑制介導(dǎo)炎癥的細胞因子的基因轉(zhuǎn)錄過程。當HDAC2表達下降時,此過程受抑制,促炎性細胞因子基因轉(zhuǎn)錄增加,導(dǎo)致激素反應(yīng)性下降。

圖2 糖皮質(zhì)激素抗炎作用機制[26]
四、重癥哮喘的治療
對于上述臨床診斷確診為哮喘,采用規(guī)范長期治療,同時去除誘發(fā)因素,合理控制并存疾病后,仍不能達到理想控制目標的患者,應(yīng)考慮采取進一步治療措施[6]。
1. 藥物治療
(1)傳統(tǒng)藥物治療:以上重癥哮喘的定義揭示了這部分人群可能對傳統(tǒng)的藥物治療不敏感。通常采取GINA推薦4~5級藥物治療方案,即成人吸入氟替卡松量>500 μg/d(或其等價劑量),聯(lián)合吸入長效β2受體激動劑等兩種或兩種以上緩解藥物(如白三烯受體拮抗劑、抗膽堿能藥物、茶堿等)。但在成人重癥哮喘患者中,約有30%患者應(yīng)用上述方案不能完全控制癥狀,甚至需要采取口服或肌肉注射糖皮質(zhì)激素治療。需要口服激素治療的最佳時機尚無統(tǒng)一標準。至于是多次間隔給予激素負荷量,還是持續(xù)小劑量口服激素治療,以上哪種給藥方式更有利于控制重癥哮喘的急性發(fā)作,尚無臨床比較結(jié)果。對于這類患者,獲得有效的哮喘控制狀態(tài),常要以骨質(zhì)疏松、糖尿病、高血壓、胃腸道出血、易合并感染等嚴重的副作用為代價。2013年ERS/ATS關(guān)于重癥哮喘指南中推薦,在成人重癥哮喘中,可結(jié)合臨床癥狀和痰嗜酸性粒細胞計數(shù)來調(diào)整用藥,但痰嗜酸性粒細胞計數(shù)對大部分臨床醫(yī)生并不適用。同時,該指南不推薦根據(jù)FeNO水平調(diào)整藥物用量[4]。
(2)抗感染治療:上呼吸道感染,尤其是鼻病毒感染,容易誘發(fā)重癥哮喘急性加重。研究發(fā)現(xiàn),預(yù)防性使用大環(huán)內(nèi)酯類抗生素如克拉霉素能減少氣道內(nèi)細胞因子釋放,減輕氣道非嗜酸粒細胞炎癥,特別是中性粒細胞炎癥。但2013年ERS/ATS重癥哮喘指南中不推薦預(yù)防性使用大環(huán)內(nèi)酯類抗生素,僅用于支氣管炎、鼻竇炎或其他有指征的細菌感染。同時建議在合并過敏性支氣管肺曲霉病(allergic bronchopulmonary aspergillosis, ABPA)時使用抗真菌藥,而對于不伴ABPA的重度哮喘患者,無論其是否存在真菌致敏(如皮膚挑刺試驗或血清真菌特異性IgE陽性),均建議不采用抗真菌藥治療[4]。
(3)不同哮喘表型的生物制劑治療:重癥哮喘是一種異質(zhì)性疾病,具有不同的表型特點。針對不同的氣道炎癥表型特點,可進行相應(yīng)的生物靶向治療。這種治療方式旨在通過抑制Th2或Th17介導(dǎo)的炎癥反應(yīng)環(huán)節(jié)中的某些細胞因子或趨化因子,發(fā)揮抗炎作用。表3總結(jié)了目前正在臨床研究的靶向制劑。
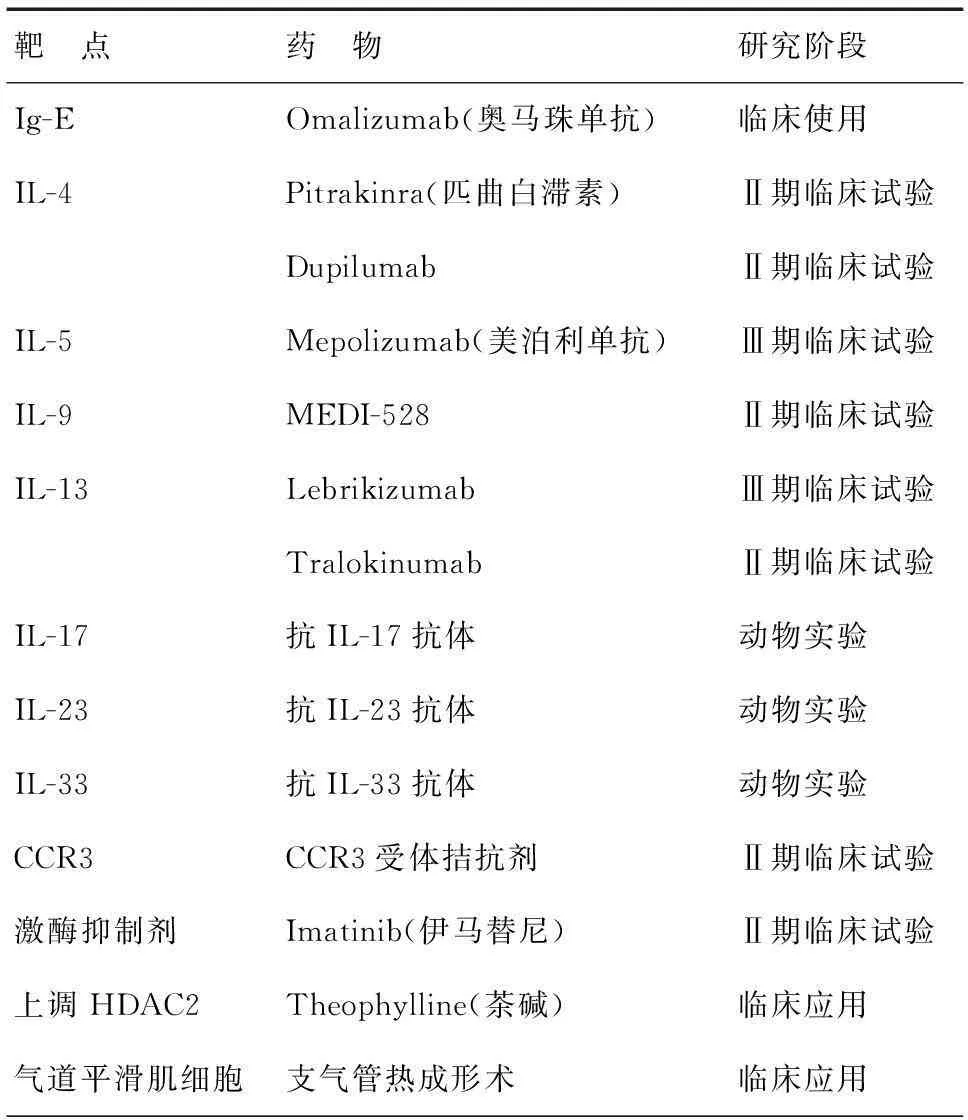
表3 重癥哮喘靶向制劑[30]
(a)抗IgE單克隆抗體:Omalizumab 是自 2006 年起GINA 推薦作為治療重癥哮喘的靶向藥物之一。通過阻斷游離的IgE 與其效應(yīng)細胞( 肥大細胞、嗜堿性粒細胞) 表面受體結(jié)合,但不會誘導(dǎo)相應(yīng)效應(yīng)細胞的脫顆粒反應(yīng),可以顯著地改善哮喘急性發(fā)作癥狀,減少糖皮質(zhì)激素使用量,減少哮喘急性加重和住院率。研究發(fā)現(xiàn),在特應(yīng)性、早發(fā)性、Th2細胞介導(dǎo)的重癥哮喘患者中,氣道中肥大細胞、嗜堿性粒細胞表面IgE受體高表達。當血清總IgE水平在30~700 IU/ml時,抗IgE單抗(omalizumab)能降低血清游離IgE水平,調(diào)節(jié)周圍血嗜堿細胞的IgE受體,顯著降低鼻部和支氣管的嗜酸細胞、肥大細胞及T細胞和B細胞的數(shù)目,有效減少嚴重過敏性哮喘急性發(fā)作次數(shù)。2013年ERS/ATS對于重癥哮喘治療指南中推薦,變應(yīng)性重癥哮喘患者血清總IgE水平在30~700 IU/ml時可考慮試驗性使用抗IgE單抗。但由于目前該藥物價格較高,限制了其廣泛應(yīng)用[4]。
(b)抗IL-5單克隆抗體:IL-5 是由Th2 細胞分泌的細胞因子,參與調(diào)控嗜酸性粒細胞的分化、成熟、黏附、浸潤、凋亡,并能夠為嗜酸性粒細胞從骨髓遷移至肺部及其他器官提供重要的信號。Mepolizumab是一種實驗性全人源化單克隆抗體,特異性靶向結(jié)合IL-5。其作用機制是:阻斷IL-5與嗜酸性粒細胞表面受體的結(jié)合,抑制IL-5對受體的結(jié)合作用,降低血液、組織、痰液中的嗜酸性粒細胞水平,從而降低嗜酸性粒細胞所介導(dǎo)的炎癥。近期的兩項Ⅱ期臨床試驗觀察結(jié)果顯示,IL-5單克隆抗體可明顯減少難治性嗜酸性粒細胞增多性哮喘患者的惡化頻率。通過抑制IL-5可以阻止嗜酸性粒細胞成熟、分化及遷移到肺組織從而治療哮喘 。目前mepolizumab還未獲任何監(jiān)管批準。
其他新型生物制劑,如抗TNFα單抗(Golimumab,Etanercept),抗IL2R單抗(Daclizumab),抗CXCR2單抗(SCH527123),抗IL-13單抗(Lebrikizumab,Tralokinumab),都是針對不同表型重癥哮喘炎癥反應(yīng)機制,抑制相應(yīng)的細胞因子釋放,阻斷炎癥反應(yīng)發(fā)生,達到有效減少哮喘急性發(fā)作。
2. 支氣管熱成型術(shù)(bronchial thermoplasty, BT): 是一種通過直接作用于氣道平滑肌來治療重癥哮喘的新型治療技術(shù)。該療法使非急性發(fā)作期患者處于全麻或局麻狀態(tài)下,通過支氣管鏡,向支氣管壁釋放能夠消融平滑肌的射頻熱能,作用范圍從主支氣管到直徑3~10 mm的遠端支氣管,通過促進細胞凋亡、壞死及自我吞噬作用,選擇性地降低支氣管平滑肌細胞數(shù)量,同時改變支氣管上皮細胞、黏液腺、神經(jīng)和微血管的特性來修飾氣道炎癥,從而降低支氣管平滑肌收縮能力,降低氣道高反應(yīng)性。多項臨床隨機對照試驗證實,使用支氣管熱成型術(shù),能提高重癥哮喘患者生活質(zhì)量,降低急性發(fā)作次數(shù)和就診率。2010年Castro等在美國哮喘干預(yù)研究(AIR)第 2 階段臨床試驗中,進行了一項多中心、隨機、雙盲對照實驗。參與研究的共有288例重癥哮喘患者(吸入支氣管擴張劑前FEV160%~85%預(yù)計值),其中190名在服用藥物治療同時接受了支氣管熱成型術(shù)治療(BT組),對照組98例單純使用大劑量吸入激素聯(lián)合LABA治療。BT組中 181 例,對照組中97例,完成了治療后1年隨訪。在術(shù)后第 1年的時間里,BT組發(fā)生嚴重急性發(fā)作、急診率、年不良事件等,較術(shù)前基線值及對照組有所下降,AQLQ評分,BT組增加1.35,對照組增加1.16。該研究說明,對于中重度持續(xù)性哮喘患者,加用BT介入治療比單純使用吸入激素聯(lián)合LABA的安全性更好,并能明顯緩解哮喘癥狀,改善氣道高反應(yīng)性,減少急性發(fā)作次數(shù),改善生活質(zhì)量。
3. 支氣管肺泡灌洗術(shù)(bronchoavleolar lavage, BAL): 有研究者將常規(guī)治療無效的61例支氣管哮喘患者隨機分成兩組,對照組繼續(xù)采用支氣管舒張劑等常規(guī)治療,支氣管鏡肺灌洗組在常規(guī)治療基礎(chǔ)上加用支氣管肺泡灌洗術(shù)。治療前及治療后48 h觀察兩組患者的臨床表現(xiàn),檢測FEV1、呼氣峰流速(peak expiratory flow, PEF)等,選用改良英國 MRC呼吸困難指數(shù)(mMRC)進行病情評估。并對兩組患者住院天數(shù)進行比較。結(jié)果顯示,經(jīng)支氣管鏡肺灌洗組顯著優(yōu)于對照組,且住院天數(shù)縮短。哮喘患者進行BAL,一方面可解除痰栓阻塞氣道,清除氣道內(nèi)炎癥細胞、炎性介質(zhì)及過敏源,從而使氣道的炎癥反應(yīng)得到改善,通暢氣道;另一方面可以通過細胞分類了解氣道炎癥表型,有助于評估治療反應(yīng)和未來疾病風險,指導(dǎo)個體化治療。但其長期有效性及安全性還有待于進一步研究。
總之,重癥哮喘越來越被證明是一種異質(zhì)性疾病,其發(fā)病機制是復(fù)雜的,在眾多危險因素作用下,由多種細胞-細胞因子交織構(gòu)成復(fù)雜的網(wǎng)絡(luò)。重癥哮喘的表型還需要更多的臨床試驗進一步證實。新的治療手段,大多仍在研發(fā)和進一步臨床驗證中。確定其分類,明確潛在發(fā)病機制,開發(fā)出新型、有效的治療方法,能改善預(yù)后、降低醫(yī)療成本,也成為目前研究的重點。
參考文獻
1王長征. 改善支氣管哮喘控制現(xiàn)狀,需要重視患者的長期管理[J/CD]. 中華肺部疾病雜志: 電子版, 2013, 6(4): 296-298.
2李喆, 莫琳芳, 任成山. 支氣管哮喘藥物治療現(xiàn)狀及進展[J/CD]. 中華肺部疾病雜志: 電子版, 2014, 7(5): 571-573.
3Global strategy for asthma management and prevention. Global Initiative for Asthma (GINA) 2011. Available from www.ginasathma.org.
4Bousquet J, Mantzouranis E, Cruz AA, et al. Uniform definition of asthma severity,control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma[J]. J Allergy Clin. Immunol, 2010, 126(5): 926-938.
5Mishra A, Yao X, Levine SJ. From bedside to bench to clinic trials: identifying new treatments for severe asthma[J]. Dis Models Mech, 2013, 6(4): 877-888.
6Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma[J]. Eur Respir J, 2014, 43(2): 343-373.
7Bel EH, Sousa A, Fleming L, et al. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI)[J]. Thorax, 2011, 66(10): 910-917.
8中華醫(yī)學會呼吸病學分會哮喘學組. 難治性哮喘診斷與處理專家共識[J]. 中華結(jié)核和呼吸雜志,2010, 33(8): 572-577.
9Guerra S, Graves PE, Morgan WJ, et al. Relation of beta2-adrenoceptor polymorphisms at codons 16 and 27 to persistence of asthma symptoms after the onset of puberty[J]. Chest, 2005, 128(2): 609-617.
10de Paiva AC, Marson FA, Ribeiro JD, et al. Asthma: Gln27Glu and Arg16Gly polymorphisms of the beta2-adrenergic receptor gene as risk factors[J]. Allergy Asthma Clin Immunol, 2014, 10(1): 8.
11Chanez P, Wenzel SE, Anderson GP, et al. Severe asthma in adults:what are the important questions[J]. J Allergy Clin Immunol, 2007, 119(6): 1337-1348.
12Kiljander TO, Junghard O, Beckman O, et al. Effect of esomeprazole 40 mg once or twice daily on asthma: a randomized, placebo-controlled study[J]. Am J Respir Crit Care Med, 2010, 181(10): 1042-1048.
13L?tvall J, Ekerljung L, Lundb?ck B. Multi-symptom asthma is closely related to nasal blockage, rhinorrhea and symptoms of chronic rhinosinusitis-evidence from the West Sweden Asthma Study[J]. Respir Res, 2010, 11: 163.
14Ekerljung L, Bossios A, L tvall J, et al. Multi-symptom asthma as an indication of disease severity in epidemiology[J]. Eur Respir J, 2011, 38(4): 825-832.
15Forno E, Lescher R, Strunk R, et al. Decreased response to inhaled steroids in overweight and obese asthmatic children[J]. J Allergy Clin Immunol, 2011, 127(3): 741-749.
16Bruno A, Pace E, Cibella F, et al. Body mass index and comorbidities in adult severe asthmatics[J]. Biomed Res Int, 2014, ID: 607192.
17林江濤. 難治性哮喘的臨床特征及發(fā)生的危險因素[J]. 實用臨床醫(yī)藥雜志, 2009, 13(23): 11-14.
18Sandrock CE, Norris A. Infection in severe asthma exacerbations and critical asthma syndrome[J]. Clinic Rev Allerg Immunol, 2015, 48(1): 104-113.
19Willemse BW, ten Hacken NH, Rutgers B, et al. Smoking cessation improves both direct and indirect airway hyperresponsiveness in COPD[J] . Eur Respir J, 2004, 24 (3): 391-396 .
20Kobayashi Y, Bossley C, Gupta A, et al. Passive smoking impairs histone deacetylase-2 in children with severe asthma[J]. Chest, 2014, 145(2): 305-312.
21郭志宏, 杜永成, 許建英. 吸煙對支氣管哮喘大鼠氣道轉(zhuǎn)化生長因子β1 mRNA和Ⅲ型膠原表達的影響[J]. 中華結(jié)核和呼吸雜志, 2008, 31(1): 42-45.
22王銳英, 杜永成, 許建英. 吸煙對致敏大鼠肺組織基質(zhì)金屬蛋白酶9及其抑制劑1表達的影響[J]. 國際呼吸雜志,2008, 28(16): 975-980.
23Porsbjerg CM, Gibson PG, Pretto JJ, et al. Relationship between airway pathophysiology and airway inflammation in older asthmatics[J]. Respirology, 2013, 18(7): 1128-1134.
24Gibson PG. Inflammatory phenotypes in adult asthma: clinical applications [J].Clin Respir J, 2009, 3(4): 198-206.
25Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial[J]. Lancet, 2012, 380(9842): 651-659.
26Al-Ramli W, Préfontaine D, Chouiali F, et al . T ( H ) 17-associated cytokinase ( IL-17A and IL-17F) in severe asthma[J]. J Al lergy Clin Immunol, 2009, 123(5): 1185-1187.
27Zhao Y, Yang J, Gao YD, et al . Th17 immunity in patients with allergic asthma[J]. Int Arch Allergy Immunol, 2010, 151(4): 297-307.
(本文編輯:黃紅稷)
馮維,宋旸,李滿祥. 成人重癥哮喘發(fā)病機制及治療的進展[J/CD]. 中華肺部疾病雜志: 電子版, 2015, 8(4): 489-494.
·綜述·
收稿日期:(2014-10-21)
文獻標識碼:中圖法分類號: R562 A
通訊作者:李滿祥,Email: manxiangli@hotmail.com
DOI:10.3877/cma.j.issn.1674-6902.2015.04.023

