烏司他丁預處理對新肝期親體肝移植術患兒心肌損傷的影響及機制探討
翁亦齊,喻文立,杜洪印,賈莉莉,王菲,王永旺,盛明薇,于泳浩(天津醫科大學一中心臨床學院,天津3009;天津醫科大學總醫院)
烏司他丁預處理對新肝期親體肝移植術患兒心肌損傷的影響及機制探討
翁亦齊1,喻文立1,杜洪印1,賈莉莉1,王菲1,王永旺1,盛明薇1,于泳浩2
(1天津醫科大學一中心臨床學院,天津300192;2天津醫科大學總醫院)
摘要:目的觀察烏司他丁預處理對新肝期親體肝移植術患兒心肌損傷的影響,并探討其可能機制。方法擇期行親體肝移植術患兒30例,隨機分為觀察組和對照組各15例。觀察組將2萬U/kg烏司他丁用生理鹽水稀釋至1萬U/mL,分別于切皮前即刻和門靜脈開放前5min各使用1/2劑量;對照組以等容量生理鹽水代替。分別于切皮前即刻(T0)、無肝期30min(T1)、新肝期3 h(T2)和術畢(T3)采集中心靜脈血,采用Access2電化學發光儀檢測血清心肌肌鈣蛋白I(cTnI)、肌酸激酶同工酶(CK-MB),LX-20型全自動生化分析儀檢測乳酸脫氫酶(LDH)活性,ELISA法檢測血清腫瘤壞死因子α(TNF-α)、IL-6、IL-18。結果觀察組T0~T3時點cTnI水平分別為(0.043± 0.023)、(0.048±0.025)、(0.205±0.055)、(0.195±0.057)μg/L,CK-MB水平分別為(1.4±0.4)、(1.7±0.6)、(3.4±1.1)、(4.1±1.5)μg/L,LDH活性分別為(225±78)、(267±53)、(280±45)、(446±135)IU/L;對照組T0~T3時點cTnI水平分別為(0.046±0.027)、(0.051±0.027)、(0.378±0.084)、(0.326±0.082)μg/L,CK-MB水平分別為(1.6±0.5)、(1.9±0.5)、(4.2±0.8)、(5.3±1.7)μg/L,LDH活性分別為(254±85)、(275±75)、(339± 87)、(577±156)IU/L;兩組T2、T3時點分別與同組T0時點比較,P<0.05或0.01;觀察組T2、T3時點cTnI、CK-MB水平及LDH活性與對照組比較,P<0.05或0.01。觀察組T0~T3時點TNF-α水平分別為(34±10)、(38±11)、(142±45)、(121±41)pg/mL,IL-6水平分別為(65±21)、(70±24)、(85±23)、(102±33)pg/mL,IL-18水平分別為(16±4)、(18±6)、(60±21)、(114±43)pg/mL;對照組T0~T3時點TNF-α水平分別為(35±11)、(43±12)、(186±62)、(163±57)pg/mL,IL-6水平分別為(72±15)、(82±23)、(113±42)、(171±56)pg/mL,IL-18水平分別為(17±5)、(20±7)、(78±23)、(153±51)pg/mL;兩組T2、T3時點分別與同組T0時點比較,P<0.05或0.01;觀察組T2、T3時點TNF-α、IL-6、IL-18水平與對照組比較,P<0.05或0.01。結論烏司他丁預處理可在一定程度上減輕新肝期親體肝移植術患兒心肌損傷,其機制可能與抑制炎癥因子的過度釋放有關。
關鍵詞:烏司他丁;肝移植術;炎癥因子;心肌損傷
Effect of ulinastatin preconditioning onmyocardial injury of pediatric patients undergoing living related liver transplantationduring neohepatic stage and itsmechanism
WENG Yi-qi1,YU Wen-li,DU Hong-yin,JIA Li-li,WANG Fei,WANG Yong-wang,
SHENGming-wei,YU Yong-hao
(1 First Center Clinical College of Tianjinmedical University,Tianjin 300192,China)
Abstract:Objective To investigate the effect of ulinastatin preconditioning onmyocardial injury of pediatric patients undergoing living related liver transplantation(LRLT)during neohepatic stage and itsmechanism.MethodsThirty children,scheduled for LRLT,were randomlydivided into two groups(n =15): the observation group and the control group.Ulinastatin 20 000 U/kg wasdiluted into 10 000 U/mL with normal saline and it was then injected intravenously in 2 parts(1/2 was injected before skin incision; 1/2 at 5min before portal veindeclamping)in the observation group.In the control group,the equal volume of normal saline was given instead of ulinastatin.Blood samples were taken from the central vein before skin incision(T0,baseline),at 30min after anhepatic phase(T1),3 h of neohepatic stage(T2)and the end
of surgery(T3)for thedetermination.The Access2 electrochemiluminescence instrument was used todetect serum cardiac troponin I(cTnI)and creatine kinase isoenzyme(CK-MB)concentrations.LX-20 type full automatic biochemical analyzer was used tomeasure the lactatedehydrogenase(LDH)activity.ELISAmethod was used todetect the levels of serum TNF-α,IL-6 and IL-18.Results The serum concentrations of cTnI were(0.043±0.023),(0.048±0.025),(0.205± 0.055)and(0.195±0.057)μg/L,the serum CK-MB concentrations were(1.4±0.4),(1.7±0.6),(3.4±1.1)and(4.1±1.5)μg/L,and the LDH activities were(225±78),(267±53),(280±45)and(446±135)IU/L at T0-3in the observation group.The serum cTnI concentrations were(0.046±0.027),(0.051±0.027),(0.378± 0.084),(0.326±0.082)μg/L,the serum CK-MB concentrations were(1.6±0.5),(1.9±0.5),(4.2±0.8)and(5.3±1.7)μg/L,and the LDH activities were(254±85),(275±75),(339±87)and(577±156)IU/L at T0-3in the control group.The serum cTnI,CK-MB concentrations and LDH activities were higher at T2-3than at T0in the two groups(P<0.05 or P<0.01).Compared with the control group,the serum cTnI,CK-MB concentrations and LDH activities at T2-3were significantlydecreased in the observation group(P<0.05 or P<0.01).The serum TNF-α levels were(34±10),(38±11),(142±45)and(121±41)pg/mL,the serum IL-6 levels were(65±21),(70±24),(85± 23)and(102±33)pg/mL,and the serum IL-18 levels were(16±4),(18±6),(60±21)and(114±43)pg/mL at T0-3in the observation group.The serum TNF-α levels were(35±11),(43±12),(186±62)and(163±57)pg/mL,the serum IL-6 levels were(72±15),(82±23),(113±42)and(171±56)pg/mL,and the serum IL-18 levels were(17±5),(20±7),(78±23)and(153±51)pg/mL at T0-3in the control group.The serum levels of TNF-α,IL-6 and IL-18 were higher at T2-3than at T0in the two groups(P<0.05 or P<0.01).Compared with the control group,the serum levels of TNF-α,IL-6 and IL-18 at T2-3were significantlydecreased in the observation group(P<0.05 or P<0.01).ConclusionUlinastatin preconditioning can alleviate cardiac injury in pediatric patients undergoing LRLT in a certain extent,whosemechanismmay be related to inhibiting the excessive release of inflammatory factors.
Key words:ulinastatin; liver transplantation; inflammatory factors;myocardial injury
肝移植術中門靜脈血流開放是新肝期開始的標志,肝臟的缺血再灌注不僅導致肝損傷,還可引起心、肺等器官損傷[1]。肝移植患者心臟并發癥發生率可達11.7%,是術后患者死亡的主要原因之一[2]。烏司他丁是一種蛋白酶抑制劑,可有效減輕心臟手術患者的全身炎癥反應和心肌損傷,但其對親體肝移植患兒的心肌保護作用有待進一步探討[3]。本研究觀察了烏司他丁預處理對新肝期親體肝移植術患兒心肌損傷的影響,并探討其可能機制。
1 資料與方法
1.1臨床資料選擇2014年3月~2015年2月天津醫科大學一中心臨床學院收治的先天膽道閉鎖患兒30例。納入標準:術前未合并先天性心臟病,心、肺、腎功能未見異常。所有患兒隨機分為兩組,觀察組15例,男8例,女7例;年齡(9.1±3.2)個月;體質量(7.7±1.2)kg。對照組15例,男8例,女7例;年齡(8.2±2.3)個月;體質量(7.5±1.4)kg。本研究已獲醫院倫理委員會批準,并與患者家屬簽署知情同意書。
1.2麻醉方法術前常規禁食、禁飲。入室前已建立外周靜脈通道,入室后常規監測ECG和SpO2。麻醉誘導:靜脈注射咪達唑侖0.15mg/kg、芬太尼2~5 μg/kg和苯磺順阿曲庫銨0.15mg/kg。氣管插管后行機械通氣,吸入氧濃度為50%~60%,潮氣量8~10mL/kg,呼吸頻率20~28次/min,吸呼比1.0∶1.5~2.0,維持PETCO230~35mmHg。于超聲引導下行右頸內靜脈、橈動脈穿刺術監測中心靜脈壓(CVP)和上肢有創動脈壓。麻醉維持:吸入1%~2%七氟醚,間斷靜注芬太尼1~3 μg/kg,靜注苯磺順阿曲庫銨1~2 μg/(kg·min)維持肌松。觀察組將2萬U/kg烏司他丁用生理鹽水稀釋至1萬U/mL,分別于切皮前即刻和門靜脈開放前5min各使用1/2劑量;對照組于相同時間點給予等容量生理鹽水代替。所有患兒行非轉流背馱式肝移植術,術中維持平均動脈壓>60mmHg,CVP 6~8mmHg,Hb>80g/L,尿量>1mL/(kg·h),根據凝血功能情況輸注血漿。
1.3心肌損傷標志物及炎癥因子檢測分別于切皮前即刻(T0)、無肝期30min(T1)、新肝期3 h(T2)和術畢(T3)采集中心靜脈血,室溫下以3 000 r/min離心15min,取血清,置于-80℃冰箱保存。心肌損傷標志物檢測:采用Access2電化學發光儀(Beckman Coulter公司,美國)檢測血清心肌肌鈣蛋白I(cTnI)和肌酸激酶同工酶(CK-MB),LX-20型全自動生化分析儀(Beckman Coulter公司,美國)檢測乳酸脫氫酶(LDH)活性。炎癥因子檢測:采用ELISA法檢測血清腫瘤壞死因子α(TNF-α)、IL-6、
IL-18。
1.4統計學方法采用SPSS19.0統計軟件。計量資料以珋x±s表示,組內比較采用重復測量設計的方差分析,組間比較采用成組t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1兩組cTnI、CK-MB水平及LDH活性比較結果見表1。
表1 兩組cTnI、CK-MB水平及LDH活性比較()
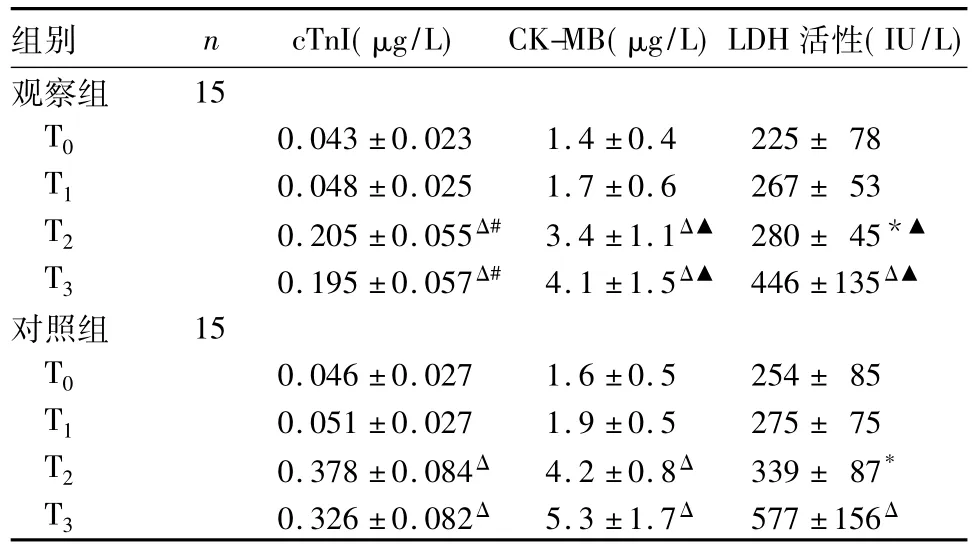
表1 兩組cTnI、CK-MB水平及LDH活性比較()
注:與同組T0時點比較,*P<0.05,ΔP<0.01;與對照組比較,▲P<0.05,#P<0.01。
組別 n cTnI(μg/L) CK-MB(μg/L)LDH活性(IU/L)觀察組15 T0 0.043±0.023 1.4±0.4 225±78 T1 0.048±0.025 1.7±0.6 267±53 T2 0.205±0.055Δ# 3.4±1.1Δ▲ 280±45*▲T3 0.195±0.057Δ# 4.1±1.5Δ▲ 446±135Δ▲對照組 15 T0 0.046±0.027 1.6±0.5 254±85 T1 0.051±0.027 1.9±0.5 275±75 T2 0.378±0.084Δ 4.2±0.8Δ 339±87*T3 0.326±0.082Δ 5.3±1.7Δ 577±156Δ
2.2兩組血清TNF-α、IL-6、IL-18水平比較結果見表2。
表2 兩組血清TNF-α、IL-6、IL-18水平比較(pg/mL,)
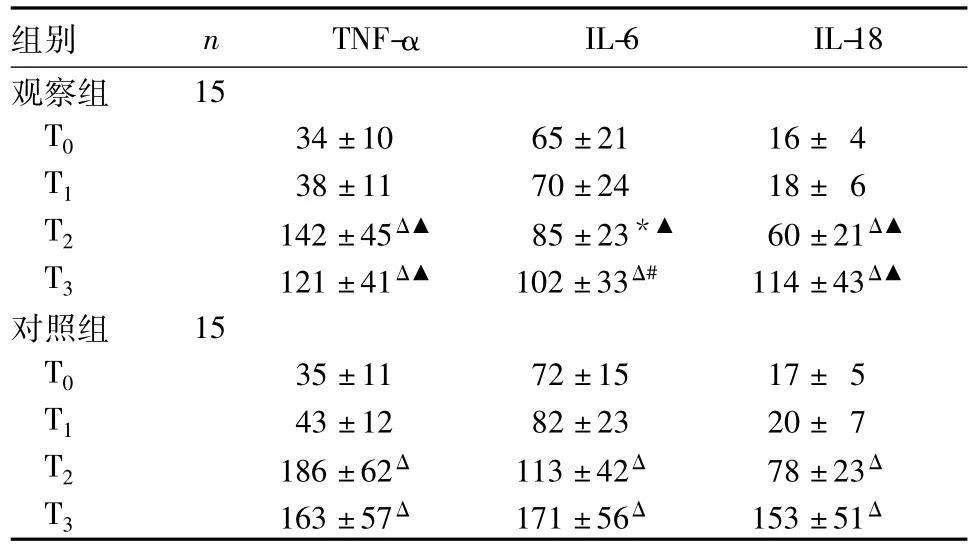
表2 兩組血清TNF-α、IL-6、IL-18水平比較(pg/mL,)
注:與同組T0時點比較,*P<0.05,ΔP<0.01;與對照組比較,▲P<0.05,#P<0.01。
組別 n TNF-αIL-6 IL-18觀察組15 T0 34±10 65±21 16±4 T1 38±11 70±24 18±6 T2 142±45Δ▲ 85±23*▲ 60±21Δ▲T3 121±41Δ▲ 102±33Δ# 114±43Δ▲對照組 15 T0 35±11 72±15 17±5 T1 43±12 82±23 20±7 T2 186±62Δ 113±42Δ 78±23ΔT3 163±57Δ 171±56Δ 153±51Δ
3 討論
肝移植術中當受體的肝上下腔靜脈、肝下下腔靜脈、門靜脈分別與供體相應血管吻合完畢后,血管開放進入新肝期,這一過程必然存在肝臟缺血再灌注。研究[4]表明,肝缺血再灌注可刺激TNF-α和IL-6產生,而產生的這些促炎細胞因子又可加重肝損傷。TNF-α是一種強效多功能性細胞因子,主要由激活的巨噬細胞、中性粒細胞、內皮細胞及淋巴細胞分泌,通過與靶細胞膜上的特異性受體結合發揮作用,在炎癥反應過程中起重要作用[5,6]。IL-6也是一種多功能細胞因子,主要由單核巨噬細胞、活化的T細胞、成纖維細胞和血管內皮細胞等產生,被認為是機體應激反應中最敏感的一種介導物和標志物,在誘導肝臟合成急性期反應蛋白中起重要作用[7]。IL-18是一種由活化的單核細胞、巨噬細胞和樹突細胞產生的細胞因子,肝臟缺血再灌注可激活炎癥通路,導致IL-18水平升高[8]。動物實驗表明,IL-18可引起肝缺血再灌注之后的遠隔器官損傷,其機制可能與抑制抗炎細胞因子的生成有關[9]。
cTnI和CK-MB有助于心肌損傷的早期診斷,均是心肌損傷的重要標志物[10,11]。當心肌細胞損傷后,cTnI和CK-MB釋放進入血液循環,血清cTnI 和CK-MB水平于心肌損傷后4~6 h升高,12~24 h達到峰值。LDH活性是反映缺血再灌注損傷的重要指標[12]。炎癥因子的過度釋放與心肌損傷具有密切關系。Marfella等[13]發現,TNF-α可通過誘導血管內皮細胞和心肌細胞內一氧化氮合酶過度表達,導致NO大量生成,細胞膜發生脂質過氧化反應,膜完整性被破壞,造成組織細胞損傷。一些臨床試驗也證實,通過抑制TNF-α和IL-6水平升高,可使心衰患者左室結構和功能得到明顯改善[14,15]。IL-18能強烈誘導T細胞和自然殺傷細胞產生IFN-γ,后者可直接影響心肌收縮力,使左室射血分數下降,引起心動過速及低血壓,導致心功能不全[16,17]。IL-18可促進IL-1及TNF-α等促炎因子的產生,這些促炎因子可抑制心肌收縮力、促進心肌細胞凋亡,最終導致心力衰竭的發生[18]。
烏司他丁可抑制炎癥介質的過度釋放,改善微循環、組織灌注,抑制全身炎癥反應,具有較強的臟器功能保護作用[3,19]。王焰斌等[3]研究表明,烏司他丁后處理可下調TNF-α及其受體表達,抑制體外循環下心臟瓣膜置換術患者心肌細胞凋亡。彭娜等[20]研究表明,大劑量的烏司他丁可以使膿毒癥大鼠血清cTnI水平下降,并能減少心肌組織內TNF-α和內皮素1水平,從而減輕炎癥因子對心肌的損傷。動物實驗證實,烏司他丁有下調IL-6、IL-8、TNF-αmRNA表達的作用[21]。烏司他丁對肝缺血再灌注損傷具有明顯的保護作用,并能夠抑制大鼠肝缺血再灌注對IL-18的過度表達[22]。本研究顯示,觀察組T2、T3時點cTnI、CK-MB水平及LDH活性較同組T0時點升高,但較對照組降低,說明親體肝移植術患兒新肝期存在一定程度的心肌損傷。本研究還顯示,觀察組T2、T3時點TNF-α、IL-6、IL-18水平較同組T0時點升高,但較對照組降低,表明烏司他丁預處理可明顯抑制炎癥因子的釋放,減輕全身炎癥反應。
總之,烏司他丁預處理可在一定程度上減輕新肝期親體肝移植術患兒心肌損傷,其機理可能與抑
制炎癥細胞因子的過度釋放、減輕全身炎癥反應有關。
參考文獻:
[1]翁亦齊,杜洪印,劉偉華,等.七氟醚和異丙酚復合麻醉下活體肝移植術病人圍術期心肌損傷的比較[J].中華麻醉學雜志,2010,30(4): 392-395.
[2]Fouad TR,Abdel-Razek WM,Burak KW,et al.Prediction of cardiac complications after liver transplantation[J].Transplantation,2009,87(5): 763-770.
[3]王焰斌,楊建安,景桂霞,等.烏司他丁后處理及其聯合預處理對體外循環下心臟瓣膜置換術患者心肌細胞凋亡的影響[J].中華麻醉學雜,2011,31(9): 1068-1072.
[4]Fang H,Liu A,Dirsch O,et al.Liver transplantation and inflammation: is lipopolysaccharide binding protein the link[J].Cytokine,2013,64(1): 71-78.
[5]zer Yücel,Berker E,Mesci L,et al.Analysis of TNF-α(-308)polymorphism and gingival crevicular fluid TNF-α levels in aggressive and chronic periodontitis: a preliminary report[J].Cytokine,2015,72(2): 173-177.
[6]Fahrner R,Trochslerm,Corazza N,et al.Tumor necrosis factorrelated apoptosis-inducing ligand on NK cells protects from hepatic ischemia-reperfusion injury[J].Transplantation,2014,97(11): 1102-1109.
[7]Tsai YF,Liu FC,Sung WC,et al.Ischemic reperfusion injury-induced oxidative stress and pro-inflammatorymediators in liver transplantation recipients[J].Transplant Proc,2014,46(4): 1082-1086.
[8]Zhu P,Duan L,Chen J,et al.Gene silencing of NALP3 protects against liver ischemia-reperfusion injury inmice[J].Hum Gene T-her,2011,22(7): 853-864.
[9]Takeuchid,Yoshidome H,Kurosawa H,et al.Interleukin-18 exacerbates pulmonary injury after hepatic ischemia/reperfusion inmice[J].J Surg Res,2010,158(1): 87-93.
[10]Ylldlz K,Ince AT,Sarbay Kemik A,et al.Role of serummyeloperoxidase,CPK,CK-MB,and cTnI tests in earlydiagnosis ofmyocardial ischemiaduring ERCP[J].Turk J Gastroenterol,2014,25(3): 291-297.
[11]Wu AH,Lu QA,Todd J,et al.Short and long-term biological variation in cardiac troponin Imeasured with a high-sensitivity assay: implications for clinical practice[J].Clinical Chemistry,2009,55(1): 52-58.
[12]Vekemans K,van Pelt J,Komutam,et al.Attempt to rescuediscarded human liver grafts by end ischemic hypothermic oxygenatedmachine perfusion[J].Transplant Proc,2011,43(9):3455-3459.
[13]Marfella R,Di Filippo C,Portoghesem,et al.Tight glycemic control reduces heart inflammation and remodelingduring acutemyocardial infarction in hyperglycemic patients[J].J Am Coll Cardiol,2009,53(16): 1425-1436.
[14]Lianza AC,Aikawa NE,Moraes JC,et al.Long-term evaluation of cardiac function in juvenile idiopathic arthritis under anti-TNF therapy[J].Clin Exp Rheumatol,2014,32(5): 754-759.
[15]Weil BR,ManukyanmC,Herrmann JL,et al.Mesenchymal stem cells attenuatemyocardial functionaldepression and reduce systemic andmyocardial inflammationduring endotoxemia[J].Surgery,2010,148(2): 444-452.
[16]Novickd,Kim S,Kaplanski G,et al.Interleukin-18,more than a Th1 cytokine[J].Semin Immunol,2013,25(6): 439-448.
[17]Toldo S,Mezzaroma E,Mauro AG,et al.The inflammasome inmyocardial injury and cardiac remodeling[J].Antioxid Redox Signal,2015,22(13): 1146-1161.
[18]Venkatachalam K,Prabhu SD,Reddy VS,et al.Neutralization of interleukin-18 ameliorates ischemia/reperfusion-inducedmyocardial injury[J].J Biol Chem,2009,284(12): 7853-7865.
[19]吳鐵軍,張麗娜,亢翠翠.烏司他丁對嚴重膿毒癥患者炎癥免疫失衡的調理作用[J].中華危重病急救醫學,2013,25(4): 219-223.
[20]彭娜,向定成,蘇磊.烏司他丁對膿毒癥大鼠血清肌鈣蛋白Ⅰ及心肌腫瘤壞死因子-α、內皮素-1的影響[J].中國危重病急救醫學,2010,22(6): 364-366.
[21]Zhao X,Sun X,Gao F,et al.Effects of ulinastatin anddocataxel on breast tumor growth and expression of IL-6,IL-8,and TNF-α [J].J Exp Clin Cancer Res,2011,30(1): 22.
[22]崔龍海,偰光華,李浩,等.烏司他丁對大鼠肝缺血-再灌注損傷的保護作用及白介素-18的影響[J].現代預防醫學,2014,41(19): 3559-3561,3571.
收稿日期:( 2015-04-17)
通信作者簡介:喻文立(1972-),男,博士,主任醫師,主要研究方向為器官保護。E-mail: yzxyuwenli@163.com
作者簡介:第一翁亦齊(1976-),男,博士,副主任醫師,主要研究方向為心臟保護。E-mail: wyqhyd@126.com
基金項目:天津市科委應用基礎研究計劃面上項目(05YFJMJC14800);天津市衛生局科技基金資助項目(2011KY12,12KG101,13KG105)。
文章編號:1002-266X(2015)35-0001-04
文獻標志碼:A
中圖分類號:R575
doi:10.3969/j.issn.1002-266X.2015.35.001

