重組人紅細胞生成素對癲癇持續狀態大鼠海馬線粒體凋亡途徑相關調控因子的影響及作用機制
史志勤,卞紅磊,魏艷靜,尹曉琳,張 榮,梁文杰,劉瑞春,王維平,于江華
?
·論著·
重組人紅細胞生成素對癲癇持續狀態大鼠海馬線粒體凋亡途徑相關調控因子的影響及作用機制
史志勤,卞紅磊,魏艷靜,尹曉琳,張 榮,梁文杰,劉瑞春,王維平,于江華
目的 觀察重組人紅細胞生成素(rHuEPO)對戊四氮(PTZ)點燃的癲癇持續狀態(SE)的成年雄性(SD)大鼠海馬神經元磷酸化蛋白激酶B(p-PKB/p-Akt)、Bcl-2相關X蛋白(Bax)和X-連鎖凋亡抑制蛋白(XIAP)表達的影響,并進一步探討rHuEPO作用的可能機制。方法 于2010年3月,由河北省實驗動物中心提供的健康清潔級成年SD大鼠。采用PTZ點燃大鼠SE模型,將大鼠隨機分為B組(PTZ+0.9%氯化鈉溶液)、C組(PTZ+rHuEPO)、D組(PTZ+LY294002+rHuEPO)、E組(PTZ+二甲基亞砜+rHuEPO),同時另選取不進行SE制模的SD大鼠作為A組(0.9%氯化鈉溶液),檢測大鼠行為學和腦電圖的改變;用原位末端轉移酶標記技術(TUNEL)檢測海馬神經元的凋亡情況;免疫組織化學法觀察p-Akt、Bax、XIAP的陽性細胞數;反轉錄多聚酶鏈反應(RT-PCR)方法檢測各組大鼠海馬Bax信使RNA(BaxmRNA)的表達;Western blot方法檢測各組大鼠海馬蛋白激酶B(Akt)、p-Akt、XIAP蛋白的表達。結果 與B組比較,C組p-Akt、XIAP陽性細胞數和p-Akt、XIAP蛋白表達水平均增多,Bax陽性細胞數及BaxmRNA表達水平均減少,差異有統計學意義(P<0.05);與C組比較,D組p-Akt、XIAP陽性細胞數和p-Akt、XIAP蛋白表達水平均減少,Bax陽性細胞數及BaxmRNA表達水平均增多,差異有統計學意義(P<0.05)。結論 rHuEPO可以提高p-Akt、XIAP陽性細胞數及蛋白表達水平,降低Bax陽性細胞數及BaxmRNA表達水平,減少海馬神經元的凋亡,發揮神經保護作用;加入磷脂酰肌醇3激酶(PI3K)抑制劑LY294002后,海馬p-Akt、XIAP陽性細胞數及蛋白表達減少、Bax陽性細胞數及BaxmRNA表達增加,海馬神經元的凋亡增加,減弱了rHuEPO的保護作用。因此,PI3K/Akt信號通路是rHuEPO發揮神經保護作用的通路之一,其作用機制可能是rHuEPO活化PI3K/Akt后,提高p-Akt蛋白及線粒體凋亡途徑相關調控因子XIAP的表達,下調了Bax的表達,從而介導線粒體凋亡途經,發揮抗凋亡、促存活的神經保護作用。
癲癇持續狀態;重組人紅細胞生成素;磷酸肌醇3-激酶類;蛋白激酶類;Bcl-2相關X蛋白質;X連鎖凋亡抑制蛋白質
史志勤,卞紅磊,魏艷靜,等.重組人紅細胞生成素對癲癇持續狀態大鼠海馬線粒體凋亡途徑相關調控因子的影響及作用機制[J].中國全科醫學,2015,18(19):2310-2316.[www.chinagp.net]
Shi ZQ,Bian HL,Wei YJ,et al.Effects and possible mechanism of rHuEPO for the regulatory factors of the mitochondrial-dependent apoptotic pathway in the hippocampus region of statural epilepticus rats[J].Chinese General Practice,2015,18(19):2310-2316.
Kondratyev等[1]、Covolan等[2]研究證實,壞死和凋亡是癲癇所致神經元死亡的兩種主要形式。大量的動物實驗已經揭示,線粒體依賴途徑、內質網依賴途徑、死亡受體依賴途徑是凋亡發生時的重要路徑,其中較為主要的是線粒體依賴途徑。Bcl-2家族蛋白、Caspase家族蛋白、凋亡抑制蛋白家族(IAPs)都是重要的線粒體依賴凋亡途徑的相關調控因子。促凋亡成員Bcl-2相關X蛋白(Bax)、Bad等,和抗凋亡成員Bcl-2、Bcl-xl等都是Bcl-2蛋白家族中非常重要的成員。IAPs家族包括X-連鎖凋亡抑制蛋白(X-linked inhibtor of apoptosis protein,XIAP)、Survivin、Hiap-1、Livin等。近些年在中樞神經系統的研究中,促紅細胞生成素(EPO)的保護機制正在逐漸被挖掘,已得到充分肯定的是它的抗凋亡功能。但EPO在癲癇中是怎樣發揮保護作用的知之甚少,因此本研究使用戊四氮(pentylenetetrazol,PTZ)點燃成年雄性(Sprague-Dawley,SD)大鼠癲癇持續狀態(status epilepticus,SE)模型用以研究重組人紅細胞生成素(recombinant human EPO,rHuEPO)的抗凋亡作用,并通過抑制磷脂酰肌醇3激酶(phosphatidyl inositol 3 kinase,PI3K)/ 蛋白激酶B(Akt)途徑探討rHuEPO可能的作用機制。
1 材料與方法
1.1 實驗動物 于2010年3月,由河北省實驗動物中心提供的健康清潔級成年SD大鼠。實驗起始體質量為(220±20)g,環境溫度為22~25 ℃,12 h光亮/黑暗條件,各組動物混合飼養。
1.2 主要實驗試劑及器材 PTZ、LY294002(美國Sigma公司);rHuEPO(濟脈欣華北制藥金坦生物技術股份有限公司);原位細胞凋亡檢測試劑盒(美國ROCHE公司);二甲基亞砜(DMSO)、兔抗Akt多克隆抗體、兔抗p-Akt(Thr-308)多克隆抗體、兔抗Bax多克隆抗體(美國Santa Cruz公司);兔抗XIAP多克隆抗體(英國Abcam公司);BCA蛋白定量試劑盒(Novagen公司);TRIzol試劑(Invitrogen公司);反轉錄多聚酶鏈反應(RT-PCR)反轉錄及擴增試劑(Promega公司),引物(上海生工生物技術有限公司)。病理圖像分析儀系統(Olympus顯微鏡,病理圖像分析軟件由北京航空航天大學圖像中心制造);腦電圖機(日本Neu-rofax 7314F);立體定向儀(日本Narishige SR-6N);PCR儀(Eppendorf);Western blot遠紅外熒光掃描成像系統(Odyssey);凝膠掃描分析系統(Syngene公司)。
1.3 方法
1.3.1 SE模型制備及實驗分組 健康成年SD大鼠228只,參照文獻[3]的方法建立動物模型:PTZ 20 mg/kg大鼠腹腔注射,然后每10 min注射10 mg/kg,直至達到足夠強度和SE。大鼠驚厥的行為表現采用Racine 6級評價標準,Ⅳ、Ⅴ級發作即為全身性驚厥大發作,持續30 min及以上者為SE。制模過程中因長時間持續的強直驚厥而死亡或不符合模型要求的大鼠,予以剔除并隨機補充。篩選補充后獲得合格動物140只,隨機分為4組:B組(PTZ+0.9%氯化鈉溶液)、C組(PTZ+rHuEPO)、D組(PTZ+LY294002+rHuEPO)、E組(PTZ+DMSO+rHuEPO),每組動物35只。同時另選取35只不進行SE制模的健康成年SD大鼠作為A組(0.9%氯化鈉溶液)。
1.3.2 給藥情況 B組:腹腔注射PTZ點燃SE發作后30 min腹腔注射0.9%氯化鈉溶液;C組:腹腔注射PTZ點燃SE發作后30 min腹腔注射rHuEPO 5 000 U/kg[4];D組:LY294002溶于DMSO中,濃度為10 μg/5 μl,給藥體積5 μl,腹腔注射PTZ點燃SE發作后10 min腦室注射給予5 μl LY294002,SE發作后30 min腹腔注射rHuEPO 5 000 U/kg;E組:腹腔注射PTZ點燃SE發作后10 min腦室注射給予5 μl DMSO,SE發作后30 min腹腔注射rHuEPO 5 000 U/kg;A組:腹腔注射相同體積、次數的0.9%氯化鈉溶液。
1.3.3 大鼠側腦室立體定位及注射給藥 根據George Paxions的圖譜定位,即坐標為矢狀縫旁開1.5 mm,硬腦膜下3.8 mm,前囟后0.8 mm。PTZ點燃SE發作后10 min,E組注射5 μl DMSO,D組注射LY294002 5 μl,注射完畢后均留針5 min,拔針緩慢,而后觀察動物行為學表現。
1.3.4 大鼠行為學觀察及腦電圖(EEG)描記
1.3.4.1 大鼠癲癇發作情況 于腹腔注射藥物后觀察2 h,記錄各組大鼠癲癇發作情況。
1.3.4.2 EEG描記 每組大鼠選取5只進行EEG描記。用10%水合氯醛35 mg/kg腹腔注射麻醉大鼠,然后固定于立體定位儀上,暴露顱骨。采取左右皮質,左右海馬4個電極建立8個導聯。皮質電極:前囟中點向前2 mm,中線旁開2 mm,深2 mm;海馬電極:前囟中點向后3.8 mm,中線旁開2.4 mm,深3.8 mm。牙鉆鉆孔,插入電極,用立體定位儀上的電極夾固定,鼻尖為參考電極。設定紙速30 mm/s,靈敏度20 μV/mm,時間常數0.1,濾波15 Hz。待大鼠清醒后開始根據不同的分組進行相應的EEG描記。
1.3.5 海馬組織學觀察
1.3.5.1 標本制作 每組大鼠選取10只進行標本制作。大鼠在SE后24 h用10%水合氯醛麻醉,開胸后主動脈插管,連接自制灌注系統,將右心耳剪開后,作為灌注液的流出口。用0.9%氯化鈉溶液約500 ml和4%多聚甲醛500 ml先后灌流固定,開顱后取出腦組織,在乳頭體與視交叉處分別垂直橫斷腦組織,把含有海馬的中段腦組織(含腦室注射部位在內)放置于4%多聚甲醛溶液中,4 ℃ 24 h。常規脫水、透明、石蠟包埋。冠狀位連續切片,直至切出海馬組織,每片的厚度約為5 μm,分別進行原位末端轉移酶標記技術(TUNEL)染色和免疫組化染色。
1.3.5.2 海馬組織病理學觀察 (1)TUNEL染色:使用原位凋亡檢測試劑盒進行測定,將海馬區凋亡細胞進行計數。每一標本取3張切片,每張切片在海馬區取10個位置不同的視野,將3張切片的平均值作為該標本的結果,將該組10例樣本均值作為該組的實驗結果。(2)免疫組化染色:采用過氧化物酶標記的鏈霉卵白素(SP)法。在切片中分別加p-Akt(Thr-308)、Bax、XIAP等一抗,4 ℃過夜,然后依次加入生物素標記的二抗、辣根過氧化酶標記的鏈霉卵白素工作液,二氨基聯苯胺(DAB)顯色,蘇木精復染。用磷酸鹽緩沖液(PBS)代替一抗作為陰性對照。檢測海馬區神經元p-Akt、Bax、XIAP蛋白表達。每一標本取3張切片,每張切片在海馬區隨機取10個位置不重復的視野,分別計數染色陽性細胞數(以斷面上有細胞核者為準),取3張切片的均值作為該標本結果,以該組10例樣本均值作為該組實驗結果。
1.3.6 RT-PCR檢測 每組大鼠各取10只,迅速分離海馬,TRIzol提取海馬總RNA,測定其濃度及純度。每個樣品取2 μg RNA反轉錄合成cDNA,再各取1 μl cDNA進行PCR擴增。引物序列,Bax上游:5′-CATCTCCTTCATCCTTGCTG-3′,下游:5′-CCAGCCACAAAGATGGTCACT-3′,擴增長度為500 bp;β-actin上游:5′-GCCATGTACGTAGCCATCCA-3′,下游:5′-GAACCGCTCATTGCCGATAG-3′,擴增長度為375 bp。引物由上海生工生物工程技術公司合成。PCR反應條件為:Bax 95 ℃預變性5 min,94 ℃變性45 s,59 ℃退火45 s,72 ℃ 延伸1 min,循環30次,最后72 ℃延伸10 min。取RT-PCR產物5 μl行瓊脂糖凝膠電泳,UVP凝膠成像系統掃描定量電泳條帶的灰度,以Bax/β-actin表示產物的相對含量,凝膠圖像分析系統分析結果。半定量結果重復分析5次,取平均值進行統計分析。
1.3.7 Western blot檢測 每組大鼠各取10只,迅速剝離海馬,提取總蛋白。BCA法測定蛋白濃度。取50 μg蛋白95~98 ℃變性5 min,以非連續的Tris-SDS聚丙烯酰凝膠垂直平板電泳電轉印到硝酸纖維素膜,5%脫脂奶粉室溫封閉1 h,加入多克隆兔抗Akt、p-Akt抗體(1∶300,封閉液稀釋),多克隆兔抗XIAP抗體(1∶200,封閉液稀釋),4 ℃孵育過夜。四聚丙烯(烷基)苯磺酸鹽(TPBS)漂洗5次×5 min,加入羊抗兔IgG熒光抗體(1∶3 000)室溫孵育1 h,TPBS漂洗4次×10 min,PBS漂洗1次×10 min,熒光掃描成像系統掃描并測定目標帶單位密度,與β-actin(1∶800)單位密度值相比后行統計分析。結果重復分析5次,取平均值進行統計分析。
2 結果
2.1 大鼠癲癇發作情況 接受PTZ注射的大鼠共228只,86只應用30 mg/kg、88只應用40 mg/kg、54只應用50 mg/kg即開始出現驚厥,主要表現為肌陣攣。大鼠SE持續時間大約為30 min以上。制模過程中84只因長時間持續的強直驚厥而死亡,死亡率為31.9%,4只不符合模型要求,均予以剔除并隨機補充。
2.2 EEG變化情況 A組大鼠腦電圖以α、β波為主,散在θ波,無異常放電表現;B組大鼠陣發出現大量高幅尖波、棘波、棘慢復合波、尖慢復合波;C、D、E組大鼠癇性放電明顯受到抑制,棘波、尖波、棘-慢復合波、尖-慢復合波等癇性發作減少或波幅降低;C、E組較D組癲癇樣放電明顯減少。
2.3 TUNEL染色結果 光鏡下胞核呈棕黃色表現者為TUNEL染色陽性細胞,即凋亡細胞。A組可以見到少量的凋亡細胞出現,其余4組海馬區亦均有不同程度的凋亡細胞分布。其中B、C、D、E組凋亡細胞數與A組比較,差異均有統計學意義(P<0.05);C、D、E組凋亡細胞數與B組比較,差異亦有統計學意義(P<0.05);D組凋亡細胞數與C組比較,差異有統計學意義(P<0.05),而E組凋亡細胞數與C組比較,差異無統計學意義(P>0.05);E組凋亡細胞數與D組比較,差異有統計學意義(P<0.05,見表1)。
2.4 免疫組化染色結果 海馬區p-Akt、Bax、XIAP蛋白的表達,即陽性細胞為有棕黃色著色的神經元,除了胞核和胞膜有少量陽性信號外,陽性信號主要位于胞質中(見圖1、2)。A組神經元核膜周圍的胞質中,偶然可以見到棕黃色散在顆粒分布;其中B、C、D、E組p-Akt、Bax、XIAP陽性細胞數與A組比較,差異均有統計學意義(P<0.05),并且有陽性信號也開始出現在胞核中;C、D、E組p-Akt、Bax、XIAP陽性細胞數與B組比較,差異亦有統計學意義(P<0.05);D組p-Akt、Bax、XIAP陽性細胞數與C組比較,差異有統計學意義(P<0.05),而E組p-Akt、Bax、XIAP陽性細胞數與C組比較,差異無統計學意義(P>0.05);E組p-Akt、Bax、XIAP陽性細胞數與D組比較,差異有統計學意義(P<0.05,見表1)。
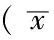
Table 1 Comparison of the number of cells with positive p-Akt,Bax and XIAP and the number of apoptotic cells in the hippocampal area among the five groups
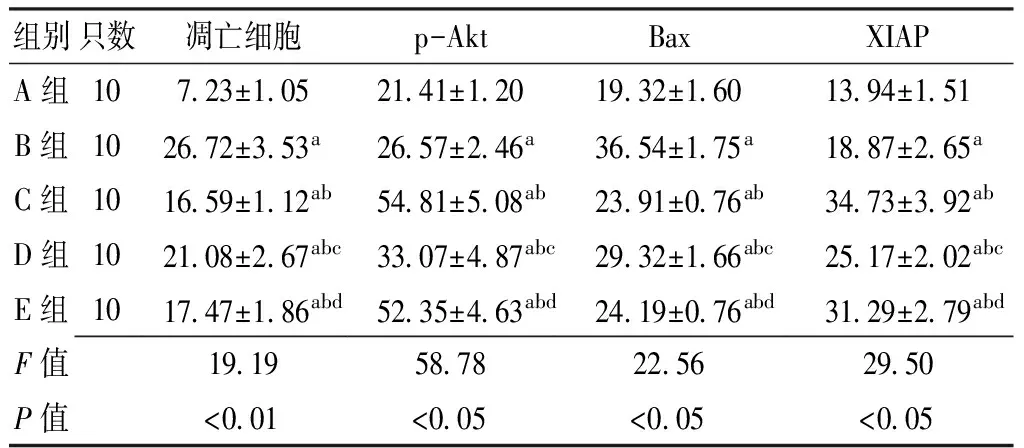
組別只數凋亡細胞p-AktBaxXIAPA組10723±1052141±1201932±1601394±151B組102672±353a2657±246a3654±175a1887±265aC組101659±112ab5481±508ab2391±076ab3473±392abD組102108±267abc3307±487abc2932±166abc2517±202abcE組101747±186abd5235±463abd2419±076abd3129±279abdF值1919587822562950P值<001<005<005<005
注:與A組比較,aP<0.05;與B組比較,bP<0.05;與C組比較,cP<0.05;與D組比較,dP<0.05;p-Akt=磷酸化蛋白激酶B;Bax=Bcl-2相關X蛋白,XIAP=X-連鎖凋亡抑制蛋白
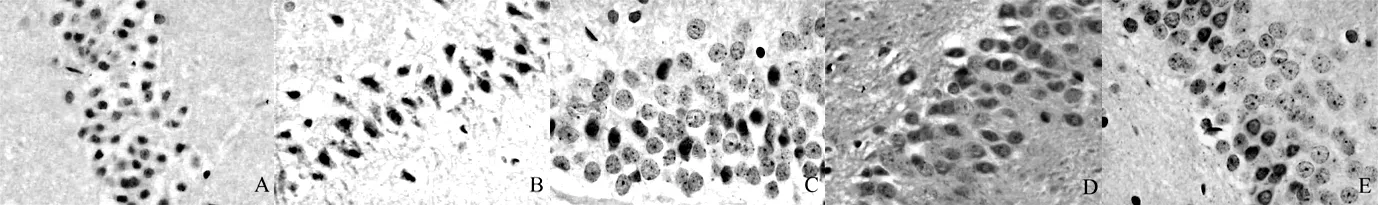
注:A、B、C、D、E分別為A、B、C、D、E組
圖1 5組大鼠海馬區Bax陽性細胞表達情況(SP×400)
Figure 1 Expression of the cells with positive Bax in the hippocampal area of the five groups
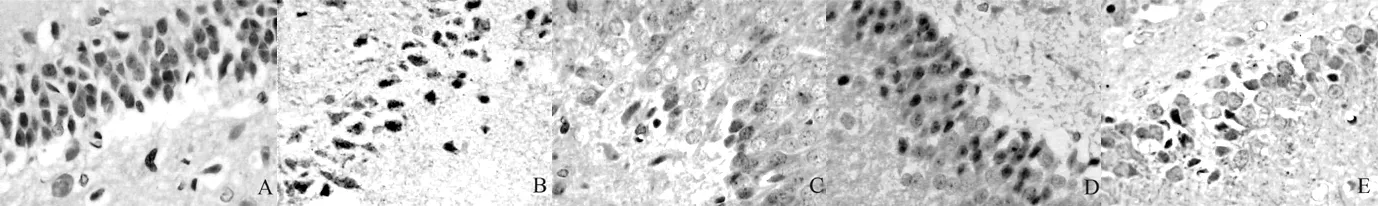
圖2 5組大鼠海馬區XIAP陽性細胞表達(SP×400)
2.5 RT-PCR測定結果 大鼠海馬Bax信使RNA(BaxmRNA)表達情況,A組BaxmRNA有微弱表達;B、C、D、E組BaxmRNA表達水平與A組比較,差異均有統計學意義(P<0.05);C、D、E組BaxmRNA表達水平與B組比較,差異亦有統計學意義(P<0.05);D組BaxmRNA表達水平與C組比較,差異有統計學意義(P<0.05),而E組BaxmRNA表達水平與C組比較,差異無統計學意義(P>0.05);E組BaxmRNA表達水平與D組比較差異有統計學意義(P<0.05,見表2)。
2.6 Western blot結果 采用Western blot檢測大鼠海馬組織p-Akt、Akt及XIAP蛋白表達情況。結果顯示,B、C、D、E組p-Akt、XIAP蛋白表達水平與A組比較,差異有統計學意義(P<0.01);C、D、E組p-Akt、XIAP蛋白表達水平與B組比較,差異亦有統計學意義(P<0.05);D組p-Akt、XIAP蛋白表達水平與C組比較,差異有統計學意義(P<0.05),而E組p-Akt、XIAP蛋白表達水平與C組比較,差異無統計學意義(P>0.05);E組p-Akt、XIAP蛋白表達水平與D組比較,差異有統計學意義(P<0.05)。5組Akt蛋白表達水平間差異無統計學意義(P>0.05,見表2)。
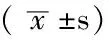
Table 2 Comparison of expression levels of BaxmRNA,p-Akt,Akt and XIAP in the hippocampal area among the five groups
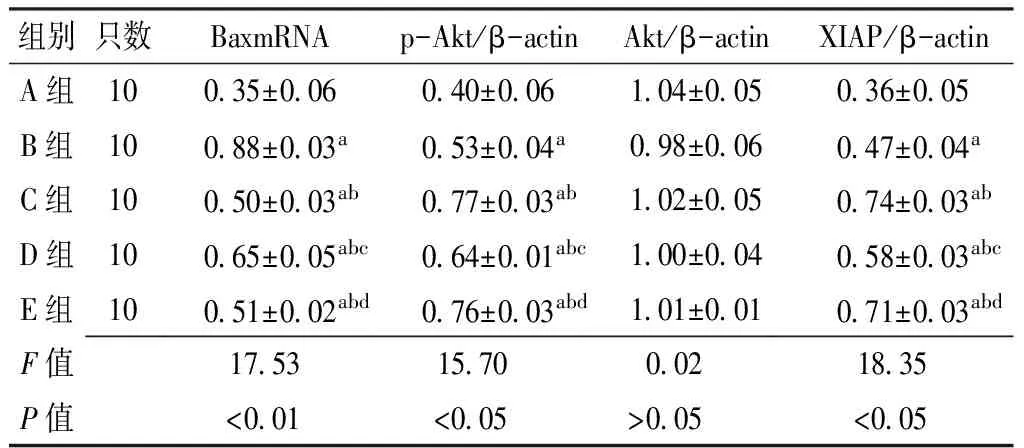
組別只數BaxmRNAp-Akt/β-actinAkt/β-actinXIAP/β-actinA組10035±006040±006104±005036±005B組10088±003a053±004a098±006047±004aC組10050±003ab077±003ab102±005074±003abD組10065±005abc064±001abc100±004058±003abcE組10051±002abd076±003abd101±001071±003abdF值175315700021835P值<001<005>005<005
注:與A組比較,aP<0.05;與B組比較,bP<0.05;與C組比較,cP<0.05;與D組比較,dP<0.05;BaxmRNA=Bax信使RNA,Akt=蛋白激酶B
3 討論
PTZ是中樞神經系統興奮劑中的一種,無神經毒性等副作用,引起的行為及神經病理的改變與人類極為相似[5],本實驗制作的SE模型也采用PTZ點燃的方法,實驗結果所呈現出的成功率和發作形式與國外的報道基本相同[6]。
EPO根本無法透過血-腦脊液屏障(BBB)是以前一些研究者的觀點,他們認為EPO是一種巨大的糖蛋白,在中樞神經系統中很難產生效果[7]。但是現在的許多實驗結果證實,EPO是可以透過BBB的,它是通過一種特殊的可飽和轉運機制來實現此功能[8-9]。EPO和它的特異性受體在神經元、內皮細胞和神經膠質細胞均有一定數量的表達。EPO是否能通過BBB也是本實驗在設計之初重點考慮的問題之一。
有許多實驗結果顯示,EPO是通過對PI3K和酪氨酸激酶2(jauns kinase 2,Jak 2)的激活來引發Akt的磷酸化,當PI3K的85 kd的調節亞單位與EPO受體結合后,110 kd的催化亞單位激活,引起Akt的磷酸化。激活后的Akt通過對底物中的絲氨酸、蘇氨酸殘基磷酸化的調節來實現它的抗凋亡的神經保護作用[10]。近年來發現PI3K/Akt通路是一條經典的通路,PI3K和Akt是該通路的中心環節。該通路在細胞的轉錄、凋亡、分化、血管形成等方面起著重要作用。PI3K是一種胞內磷脂酰肌醇激酶,其產物可直接或間接激活Akt,PI3K途徑通過激活Akt來實現抵抗凋亡、促進神經元存活的作用。凋亡蛋白Caspase-9Ser196和BadSer136是被Akt磷酸化的多種分子中的較為重要的成員,Akt主要也是通過此機制對它們誘導凋亡的作用來進行調控,從而發揮作用[11]。對PI3K進行標準的量化測量是有一定難度的,因此許多研究,通過構建PI3K某些亞基缺失、基因敲除的動物模型或者其抑制劑LY294002和wortmannin來觀察PI3K的效能。雖然LY294002和wortmannin都是靶向PI3K的催化亞基p110的選擇性、高競爭性抑制劑,LY294002比wortmannin更加穩定,可信度更高[12]。所以本研究中也將LY294002應用其中,這樣就能進一步驗證rHuEPO是否通過PI3K/Akt途徑實現抵抗神經元凋亡的保護作用。
EPO在缺血低氧性腦損傷[13]、脊髓損傷[14]、閉合性腦創傷[15]等不同的體內外神經損傷模型中都具有抗神經元凋亡的作用,但在PTZ點燃的大鼠SE中是否有抗凋亡作用,以及是否通過了較為主要的PI3K/Akt通路還知之甚少,鑒于此,本研究建立PTZ點燃SE大鼠模型,觀察大鼠海馬區神經元的凋亡和p-Akt表達的變化及rHuEPO的影響,以及應用PI3K抑制劑LY294002,用以觀察rHuEPO是否通過PI3K/Akt途徑發揮抗凋亡的神經保護作用。
本研究結果顯示,PTZ致SE大鼠EEG中,呈現出癲癇樣放電的表現。海馬神經元凋亡陽性細胞的出現,使海馬神經元內p-Akt的表達升高;使用rHuEPO可明顯降低癲癇樣放電的發生、減少神經元凋亡陽性細胞的數量、p-Akt在海馬神經元內的表達也被明顯提升,充分顯示了rHuEPO抵抗凋亡的效用。rHuEPO使用前給予LY294002對PI3K進行干預,p-Akt的表達呈現減少的狀態,海馬神經元的凋亡陽性細胞增加,更加有力地說明rHuEPO能夠激活重要的PI3K/Akt路徑,這與Akt的活性被其提高密切相關,從而發揮抵抗凋亡,促進神經元存活的保護作用。與Kilic等[16]在局灶性腦缺血的研究中所呈現的結果相一致。
Bax大多數存在于胞質中,當凋亡信號傳達到細胞后,Bax的N末端在結構上發生突變現象,這樣使得它無法定位于線粒體外膜,從而失去其凋亡調控功能。Bax從胞質轉位到線粒體膜上從而啟動了線粒體介導的凋亡路徑[17]。在哺乳動物身上被克隆出來的IAPs家族成員中,XIAP是最早被發現的,抗凋亡能力最強的成員之一[18-19]。Dan等[20]研究發現,Akt可以磷酸化XIAP的Ser87位點,Akt磷酸化XIAP后,一方面可以保護XIAP不被泛素化和降解,另一方面XIAP的自動泛素化也可以被Akt抑制,這樣就能增強XIAP的穩定性和它的細胞內水平,從而達到幫助細胞生存,抵制凋亡發生的功效。在線粒體凋亡途徑中,IAPs有3種方式來實現抑制凋亡的作用,分別為:直接與pro-Caspase-9作用干擾其加工過程;IAPs的CARD區與Apaf-1競爭性結合,阻斷Caspase活化;直接抑制活化的Caspase[21],通過以上方式來調節Bax/細胞色素C介導的線粒體凋亡途徑[22-23]。因此Bax、XIAP都是線粒體凋亡途徑的重要相關調控因子。所以,本研究把Bax、XIAP作為重要的觀察指標,借以來了解大鼠海馬Bax及XIAP表達的變化以及rHuEPO對它們的影響,更深入地去研究rHuEPO對線粒體相關調控因子Bax和XIAP進行調控所顯現的抵抗神經元凋亡的作用是否通過了PI3K/Akt途徑。本研究發現,在PTZ點燃SE后激活了海馬神經元中促凋亡蛋白Bax、BaxmRNA的表達以及抗凋亡蛋白XIAP的表達,給予rHuEPO干預后,Bax及BaxmRNA的表達下降,XIAP蛋白的表達增加。提示rHuEPO對Bax以及XIAP的表達有一定的調控作用。
因為 EPO 也能夠通過其他的信號路徑來實現其功能,因此該實驗應用PI3K抑制劑LY294002更深入地去研究rHuEPO對Bax和XIAP進行調控所顯現的抵抗神經元凋亡的作用是否通過了PI3K/Akt途徑。實驗結果為加入LY294002后,海馬神經元內Bax及BaxmRNA的表達明顯增加,XIAP蛋白的表達明顯下降。這些都更有力地驗證了rHuEPO通過PI3K/Akt途徑對線粒體凋亡途經的相關調控因子進行調控,進而介導線粒體凋亡途經,發揮抗凋亡的神經保護作用。rHuEPO對Bax和XIAP進行調控所顯現的抵抗神經元凋亡的作用通過了PI3K/Akt途徑,介入到線粒體凋亡途徑中來才得以實現的。
而且,在本實驗結果中也發現B組與D組進行比較也有統計學差異,揭示rHuEPO在給予LY294002干預后,仍有部分保護作用,這其中的機制也許是EPO通過PI3K/Akt途徑之外的其他途徑,如JAK/ STAT[24]信號途徑、NF-κB[25]途徑、PKC途徑來發揮神經保護作用,同時Akt活化后是通過Akt-IIK-NFκB-XIAP途徑還是通過直接磷酸化XIAP的Ser87位點,又或是通過Caspase-9和第二個線粒體源性caspase激活劑(second mitochondrial derived activator of caspase,Smac/DIABLO)在XIAP顯現效能時起到了重要的調整作用,這些問題在本實驗中尚未闡述。信號轉導途徑的“cross-talk(交談)”效應紛繁復雜,這就需要進一步的擴大樣本量,尋求多位點觀察,以便掌握其更精細的調控機制,這些都需要在進一步實驗研究中逐步完善,以期為神經系統乃至各個系統的臨床應用提供重要的實驗依據。
[1]Kondratyev A,Gale K.Temporal and spatial patterns of DNA fragmentation following focally or systemically-evoked status epilepticus in rats[J].Neurosci Lett,2001,310(1):13-16.
[2]Covolan L,Smith RL,Mello LE.Ultrastructural identification of dentate granule cell death from pilocarpine-induced seizures[J].Epilepsy Res,2000,41(1):9-21.
[3]Motte JE,da Silva Fernandes MJ,Marescaux C,et al.Effects of pentylenetetrazol induced status epilepticus on c-Fos and HSP72 immunoreactivity in the immature rat brain [J].Brain Res Mol Brain Res,1997,50(1/2):79-84.
[4]Nadam J,Navarro F,Sanchez P,et al.Neuroprotective effects of erythropoietin in the rat hippocampus after pilocarpine-induced status epilepticus [J].Neurobiol Dis,2007,25(2):412-426.
[5]Qu H,Eloqayli H,Sonnewald U.Pentylenetetrazole affects metabolism of astrocytes in culture [J].J Neurosci Res,2005,79(1/2):48-54.
[6]Biggan SL,Beninger RJ,Cockhill J,et al.Quisqualate lesions of rat NBM:selective effects on working memory in a double Y-maze[J].Brain Res Bull,1991,26(4):613-616
[7]Meng XD,Chen JP.Neuroprotective role of erythropoietin in central nervous system hypoxia/ischemia[J].Chinese Journal of Neuroscience,2003,19(1):63-67.(in Chinese) 孟憲棟,陳俊拋.促紅細胞生成素在中樞神經系統缺氧/缺血時的保護作用[J].中國神經科學雜志,2003,19(1):63-67.
[8]Brines ML,Ghezzi P,Keenan S,et al.Erythropoietin crosses the blood-brain barrier to protect against experimental brain injury[J].Proc Natl Acad Sci USA,2000,97(19):10526-10531.
[9]Siren AL,Knerlich F,Poser W,et al.Erythropoietin and erythropoietin receptor in human ischemic/hypoxic brain[J].Acta Neuropathol,2001,101(3):271-276.
[10]Sun ZK,Chen SD.Erythropoietin and neuron apoptosis:signal pathway[J].Chinese Pharmacological Bulletin,2006,22(12):1429-1432.(in Chinese) 孫志坤,陳生弟.促紅細胞生成素抗神經元凋亡的信號傳導系統[J].中國藥理學通報,2006,22(12):1429-1432.
[11]Datta SR,Dudek H,Tao X,et al.Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery[J].Cell,1997,91(2):231-241.
[12]Harris CJ,Brater DC.Renal effects of cyclooxygenase-2 selective inhibitors[J].Curr Opin Nephrol Hypertens,2001,10(5):603-610.
[13]郁俊德.神經生長因子對新生大鼠缺血缺氧性腦損傷的保護作用研究[J].實用心腦肺血管病雜志,2010,18(10):1392.
[14]Racine RJ.Modification of seizure activity by electrical stimulation:II Motor seizure[J].Electroencephaloqr Clin Neurophysiol,1972,32(3):281-294.
[15]Conrad CD,Lupien SJ,Thanasoulis LC,et al.The effects of type I and type II corticosteroid receptor agonists on exploratory behavior and spatial memory in the Y-maze[J].Brain Res,1997,759(1):76-83.
[16]Kilic E,Kilic U,Soliz J,et al.Brain-derived erythropoietin protects from focal cerebral ischemia by dual activation of ERK-1 /-2 and Akt pathways[J].FASEB J,2005,19(14):2026-2028.
[17]Antonsson B.Bax and other pro-apoptotic Bcl-2 family"killer-proteins" and their victim the mitochondrion[J].Cell Tissue Res,2001,306(3):341-361.
[18]Vaux DL,Silke J.Mammalian mitochondrial IAP binding proteins[J].Biochem Biophys Res Commun,2003,304(3):499-504.
[19]Salvesen GS,Duckett CS.IAP proteins:blocking the road to death′s door[J].Nat Rev Mol Cell Biol,2002,3(6):401-410.
[20]Dan HC,Sun M,Kaneko S,et al.Akt phosphorylation and stabilization of X-linked inhibitor of apoptosis protein(XIAP) [J].J Biol Chem,2004,279(7):5405-5412.
[21]Deveraux QL,Roy N,Stennicke HR,et al.IAPs block apoptotic events induced by caspase-8 and cytochrome c by direct inhibition of distinct caspase[J].EMBO J,1998,17(8):2215-2223.
[22]Sun C,Cai M,Meadows RP,et al.NMR structure and mutagenesis of the third Bir domain of the inhibitor of apoptosis protein XIAP[J].J Biol Chem,2000,275(43):33777-33781.
[23]Holcik M,Korneluk RG.XIAP,the guardian angel[J].Nat Rev Mol Cell Biol,2001,2(7):550-556.
[24]Rafiee P,Shi Y,Su J,et al.Erythropoietin protects the infant heart against ischemia-reperfusion injury by triggering multiple signaling pathways[J].Basic Res Cardiol,2005,100(3):187-197.
[25]Xu B,Dong GH,Liu H,et al.Recombinant human erythropoietin pretreatment attenuates myocardial infarct size:a possible mechanism involves heat shock protein 70 and attenuation of nuclear factor-kappa B[J].Ann Clin Lab Sci,2005,35(2):161-168.
(本文編輯:崔沙沙)
·全科醫生知識窗·
標準·方案·指南
——《CVD合并糖尿病OAD應用專家共識》解讀
共識建議,成人具有下列任何一項及以上危險因素,可被定義為糖尿病高危人群,應進行糖尿病篩查:有糖調節受損史;年齡≥40歲;超重(BMI≥24 kg/m2)或肥胖(BMI≥28 kg/m2)和/或向心性肥胖(男性腰圍≥90 cm,女性腰圍≥85 cm);2型糖尿病患者的一級親屬;高血壓〔血壓≥140/90 mm Hg(1 mm Hg=0.133 kPa)〕或正在接受降壓治療;血脂異常或正接受調脂治療;動脈粥樣硬化性心血管疾病患者及其他因素等。篩查措施包括空腹血糖(FPG)、口服葡萄糖耐量試驗(OGTT)和糖化血紅蛋白(HbA1c)檢測等。
共識建議,糖尿病血糖控制可根據自我血糖監測(SMBG)的結果和HbA1c綜合判斷。血糖控制目標為:HbA1c<7.0%,FPG<7.0 mmol/L,餐后2 h血糖(2 hPG)<10 mmol/L;糖尿病病史較短、預期壽命較長、無并發癥的患者,在不發生低血糖的情況下可考慮將HbA1c控制在<6.5%,否則可放寬血糖目標值至<7.5%~8.0%;慢性疾病終末期患者的HbA1c可放寬至<8.5%。
共識列出了目前常見的心內科臨床應用的各種口服降糖藥物(OAD)包括:雙胍類、磺脲類胰島素促泌劑、格列奈類胰島素促泌劑、α-糖苷酶抑制劑、二肽基肽酶-4(DPP-4)抑制劑和噻唑烷二酮類等。除一線用藥外,共識還推薦了聯合用藥方案。指出如果起始HbA1c≥9.0%或生活方式干預聯合一線OAD單藥治療3個月不能使血糖達標,需聯合OAD治療;若兩種OAD聯合治療3個月不能使患者血糖達標,可考慮聯合第3種OAD,或者聯合胰島素或胰高血糖素樣肽-1(GLP-1)受體激動劑治療。共識強調,選擇聯合用藥方案應根據患者的情況。歐洲心臟病學會(ESC)/歐洲糖尿病研究學會(EASD)糖尿病、糖尿病前期和心血管疾病指南也指出,應根據糖代謝異常的特點選擇降糖藥物。
(摘自《中國醫學論壇報》)
Effects of rHuEPO on the Regulatory Factors Related With the Apoptosis Pathway of Hippocampal Mitochondria in Rats With Status Epilepticus and the Possible Mechanism
SHIZhi-qin,BIANHong-lei,WEIYan-jing,etal.
HebeiMedicalUniversity,Shijiazhuang050000,China
Objective To observe the effect of recombinant human erythropoietin(rHuEPO) on the expression levels of p-PKB/p-Akt,Bax and XIAP in hippocampal neurons of male mature SD rats with pentylenetetrazol(PTZ) induced status epilepticus(SE),and to further investigate the possible mechanism.Methods The included male mature rats of clean grade were provided by Laboratory Animal Center of Hebei Province in March 2010.By using the PTZ kindling epileptic rat SE model,the SD rats were divided into four groups:group B(PTZ+0.9% sodium chloride solution),group C (PTZ+rHuEPO),group D (PTZ+LY294002+rHuEPO)and group E(PTZ+dimethyl sulfoxide+rHuEPO).Meanwhile, we assigned SD rats without SE model building into group A(0.9% sodium chloride solution).The behavioral and EEG changes were detected;TUNEL was used to check the apoptosis status of hippocampal neurons;immunohistochemistry was used to observe the number of cells with positive p-Akt,Bax and XIAP;the RT-PCR method was used to detect the expression level of BaxmRNA in hippocampus;Western blot method was employed to detect the protein expression levels of Akt,p-Akt and XIAP.Results Compared with group B,group C was higher(P<0.05) in the number of cells with positive p-Akt and XIAP,the protein expression levels of p-Akt and XIAP and was lower in the number of cells with positive Bax and the protein expression level of BaxmRNA.Compared with group C,group D was lower in the number of cells with positive p-Akt and XIAP and the protein expression levels of p-Akta and XIAP and was higher(P<0.05) in the number of positive cells with positive Bax and the expression level of BaxmRNA.Conclusion rHuEPO can increase the number of cells with positive p-Akt and XIAP and the protein expression of p-Akt and XIAP.It can also decrease the number of cells with positive Bax and the expression level of BaxmRNA,reduce the apoptosis of hippocampal neurons,and has a neuroprotective effect.When PI3K inhibitor LY294002 is added,the number of cells with positive p-Akt and XIAP and the protein expression of p-Akt and XIAP decrease,the number of cells with positive Bax and the expression of BaxmRNA increase,the apoptosis of hippocampal neurons increases,and the neuroprotective effect of rHuEPO is weakened.Therefore,the signal path of PI3K/Akt may be one of the neuroprotective ways of rHuEPO.The possible mechanism may be that rHuEPO activating the PI3K/Akt increases the expression levels of p-Akt and XIAP,decreases the expression level of Bax,thus mediating the path of mitochondrial apoptosis and playing a neuroprotective role of anti-apoptosis and survival promotion.
Status epilepticus;Recombinant human erythropoietin;Phosphatidylinositol 3-kinases;Protein kinases;Bcl-2-associated X protein;X-linked inhibitor of apoptosis protein
河北省自然科學基金資助項目(C2007000852)
050000河北省石家莊市,河北醫科大學(史志勤,魏艷靜,尹曉琳,張榮);河北醫科大學第三醫院肛腸科(卞紅磊);河北省中醫院(梁文杰);河北醫科大學第二醫院神經內科(劉瑞春,王維平,于江華)
于江華,050000河北省石家莊市,河北醫科大學第二醫院神經內科;E-mail:1668834810@qq.com
R 349.53
A
10.3969/j.issn.1007-9572.2015.19.016
2015-03-02;
2015-05-25)

