含Cr6+電鍍廢槽液的處理
舒 剛 劉定富 李 雨
(貴州大學, 貴陽 550025)
含Cr6+電鍍廢槽液的處理
舒 剛 劉定富 李 雨
(貴州大學, 貴陽 550025)
本文提出了詳細的處理含Cr6+電鍍廢水處理工藝,采用了化學還原沉淀處理法,確定了焦亞硫酸鈉作為還原劑,當溶液pH保持在2.0,焦亞硫酸鈉的用量為14.95 g/L時,Cr6+能夠被完全還原為Cr3+;當溶液pH值為8.0,沉淀效果最好,Cr3+去除率可達到99.8 %。這對實際的工程操作具有指導意義。
電鍍含Cr6+廢水;化學還原沉淀;焦亞硫酸鈉
我國的電鍍行業發展很快。據統計[1],我國大約有7萬多家電鍍廠,廢水排放總量每年達到40億m3,其中含Cr6+的廢水排放量最多,對環境污染嚴重。含Cr6+的電鍍廢水主要來源于:(1)溶液過濾和廢液;(2)電鍍件清洗廢水;(3)化學分析用水[2]。
鉻在溶液中的存在形式主要是Cr3+和Cr6+兩種。實驗證明,Cr6+的毒性比Cr3+高100倍,可在人、植物和動物體內積累,可引起人體腸道疾病、貧血等[3]。根據GB 21900—2008《電鍍污染物排放標準》表3,工廠排出的廢水中總鉻的最高濃度不能超過1.0 mg/L,Cr6+的最高濃度不能超過0.2 mg/L。
含鉻廢水的處理方法主要有化學法、電解法和離子交換法[4-6]。用化學法處理電鍍含鉻廢水主要是選用不同的還原劑,主要包括二氧化硫法、鐵氧體法、亞硫酸鹽法和鋇鹽法等[7-8]。本文采用焦亞硫酸鈉鹽作為還原劑的化學法來處理含Cr6+電鍍廢水。
1 處理方法
1.1 主要廢槽液統計
貴陽某電機廠電鍍車間,老廠搬遷后,在電鍍車間遺留了大量含Cr6+電鍍廢槽液和含Cr6+廢水,尚未得到有效處理。據統計需要處理含鉻酐電鍍廢液一共有:4個含Cr6+電鍍槽、1個鈍化槽、3個水洗槽,詳見表1所示。

表1 含Cr6+廢槽液及廢水
1.2 還原劑的選取
處理含Cr6+電鍍廢水的工藝已經十分成熟,尤以化學法處理廢水的應用容易實現[9],只要化學還原藥劑的選擇正確,就可以通過計算得出應投加量。化學還原法的優點是投資小,操作簡單。常用的還原藥劑主要有亞硫酸鈉、二氧化硫、硫酸亞鐵和焦亞硫酸鈉等[10-11]。本研究還原Cr6+的藥劑選擇價格便宜、污泥產生量少的工業級焦亞硫酸鈉。
化學還原法是在酸性條件下,在含鉻廢水中按一定比例投入焦亞硫酸鈉,將廢水中Cr6+離子還原成Cr3+離子,反應方程式為:
Cr2O72-+3HSO32-+5H+→ 2Cr3++3SO42-+4H2O
(1)
Cr6+的質量濃度應控制在10 g/L以下,Cr6+量與焦亞硫酸鈉的理論投加比為1:3.5[12],實際投加量為1:4.5,溶液pH應控制在2.0左右,反應的時間為5 h,能夠充分反應。
1.3 分析方法
本次實驗中,含鉻廢槽液中Cr6+的測定采用GB 7467—87《二苯碳酰二肼分光光度法》;含鉻廢槽液中總鉻的測定采用GB 7466—87《高錳酸鉀氧化-二苯碳酰二肼分光光度法》。
1.4 處理工藝流程
采用化學還原沉淀法處理工藝流程,即先將含鉻電鍍廢槽液轉移至含鉻處理池,用水稀釋至Cr6+含量為10 g/L以下,再把槽液的pH控制在2.0左右;然后加入少量焦亞硫酸鈉進行反應,一段時間后,再加入適量濃鹽酸,嚴格控制溶液pH在2.0左右,反應直到溶液的顏色變為暗綠色,即反應終點,處理完畢。經過檢測合格后,將處理完的廢水調至污水處理池,在空氣壓縮機的攪拌下,加入適量20%的NaOH和聚丙烯酰胺絮凝劑,控制污水處理池中溶液pH在8.0~9.0,使溶液中Cr3+沉淀下來;然后將上清液調至逐級沉淀池,加入適量Na2S,使Cr3+進一步沉淀,最后加入適量酸或堿將溶液pH調至8.0左右,再轉入排放池,詳見圖1。
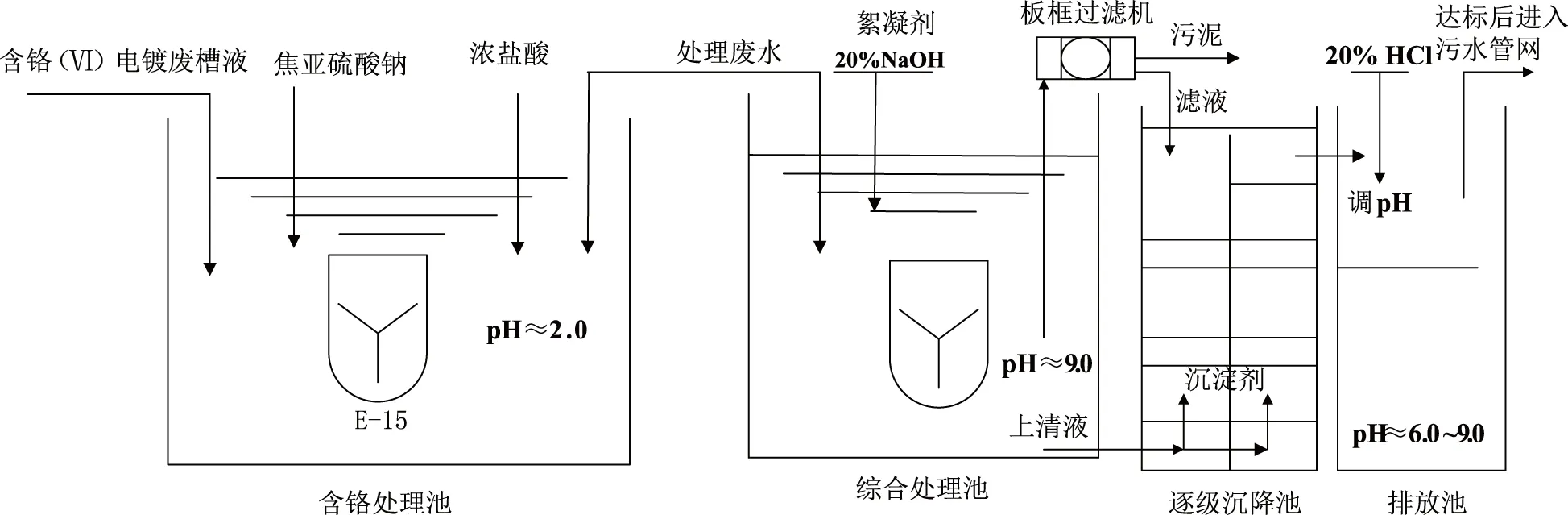
圖1 工藝流程
1.5 注意事項
(1) 現場處理過程中和轉運的區域應設警戒線和危險品標識,專人值班。
(2) 由于廢槽液中含劇毒Cr6+,因此在處理過程中和轉運時要避免直接接觸,以免發生危險。
(3) 現場工作人員安全防護措施要做好,如出現含鉻廢液泄漏到地面,應及時用焦亞硫酸鈉等藥品進行局部處理,然后再轉移到廢水池處理。
2 實驗結果討論
2.1 含Cr6+廢槽液最佳還原pH的確定
分別取1 000 ml廢槽液水樣至6個燒杯中,以1:19比例加水稀釋,攪拌均勻。用濃鹽酸分別調節水樣pH至1.0、1.5、2.0、2.5、3.0、3.5,攪拌均勻后,再分別向廢槽液水樣中加入11.63 g焦亞硫酸鈉(理論值),反應0.5 h后,記錄相關數據,并計算出Cr6+的濃度和去除率。
實驗中發現,在pH越小時,廢槽液水樣的顏色是綠色。在pH越大時,廢槽液水樣的顏色是橙黃色。這是由于在廢槽液水樣中,在pH越大時,Cr6+的含量越高,而Cr3+是綠色的,Cr6+是橙黃色的。在圖2中可以看出,當pH為1.0時,Cr6+的濃度最小,當pH為3.5時Cr6+的濃度最大。在pH值為1.5時Cr6+的濃度為0.045 mg/L,pH值為2.0時Cr6+的濃度為0.049 mg/L,兩者相差不大,從經濟成本的角度考慮,Cr6+的最佳還原pH為2.0。
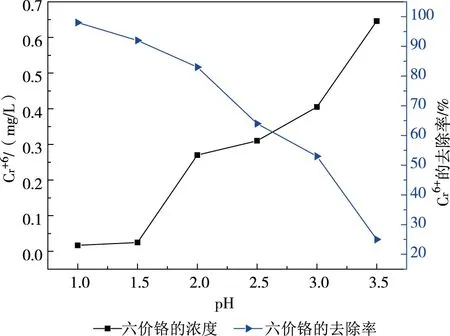
圖2 不同pH值對Cr6+的影響
而當焦亞硫酸鈉的使用量為11.63 g時,Cr6+的去除率為80%,在最佳pH時,Cr6+的濃度為0.27 mg/L,高于GB 21900—2008《電鍍污染物排放標準》中Cr6+的最高排放標準。由此可以得出焦亞硫酸鈉的投入量應該大于理論值。
2.2 含Cr6+廢槽液還原劑用量的確定
分別取1 000 ml廢槽液水樣至5個燒杯中,攪拌均勻。用濃鹽酸分別調節水樣的pH至2.0,攪拌均勻,再分別向水樣中投加12.294、12.958、13.622、14.286、14.95、15.614 g焦亞硫酸鈉,反應0.5 h后,記錄相關數據,并計算出Cr6+的濃度和去除率(圖3)。
從圖3可以看出,當焦亞硫酸鈉濃度逐漸增加時,Cr6+的濃度逐漸減小,焦亞硫酸鈉的濃度在14.286 g/L時,Cr6+的濃度為0.2 mg/L。隨著焦亞硫酸鈉濃度的增加,Cr6+的還原率最初增加較快,后來增加幅度減小。考慮到環境中的其他具有氧化性的物質能夠重新將Cr3+氧化成Cr6+,這會影響到Cr6+的還原,因此在實際操作時,應該使用過量焦亞硫酸鈉,本次實驗取焦亞硫酸鈉量為14.95 g/L作為最佳用量。
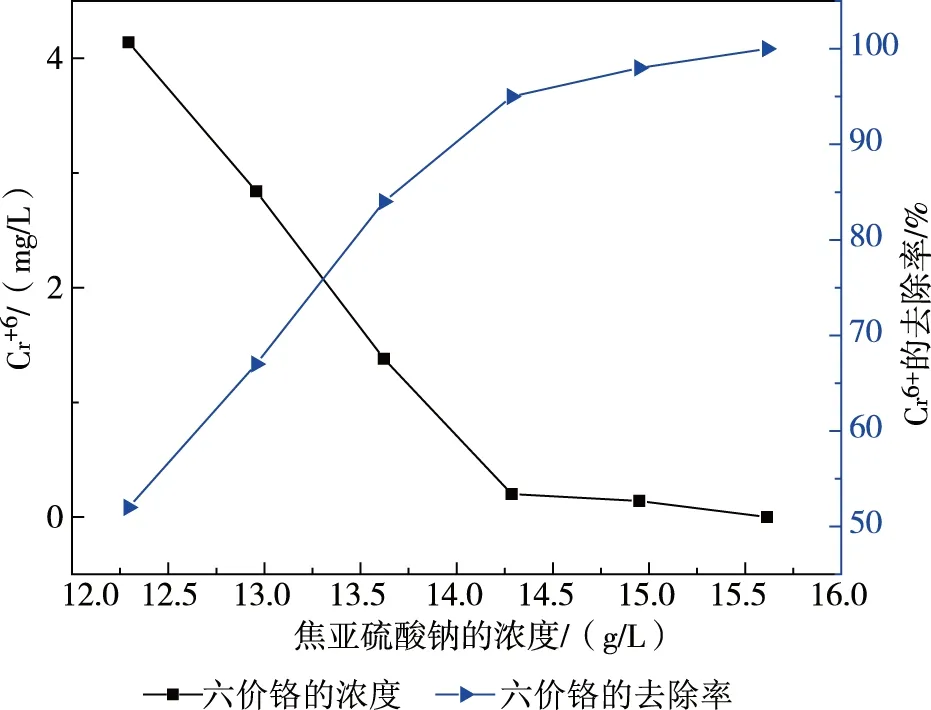
圖3 不同濃度的焦亞硫酸鈉對Cr6+的影響
因此,當廢槽液水樣中的Cr6+的濃度為8.615 g/L時,焦亞硫酸鈉的濃度14.95 g/L,Cr6+可以被完全還原,此時焦亞硫酸鈉與Cr6+的質量濃度比為14.95/3.322=4.5。可見,要將Cr6+完全還原,實際加入還原劑焦亞硫酸鈉的量應遠大于理論值。
2.3 含Cr3+廢槽液沉淀pH的確定
分別取1 000 ml廢槽液水樣至6個燒杯中,用水以1:19稀釋。將廢水樣的pH用濃鹽酸調至2.0,攪拌均勻后,再分別加入14.95 g焦亞硫酸鈉,反應0.5 h后,分別用20%NaOH調節pH至6.0、7.0、8.0、9.0和10.0,攪拌15 min后,靜置沉淀6 h,記錄相關數據,并計算出總鉻的濃度和去除率(圖4)。
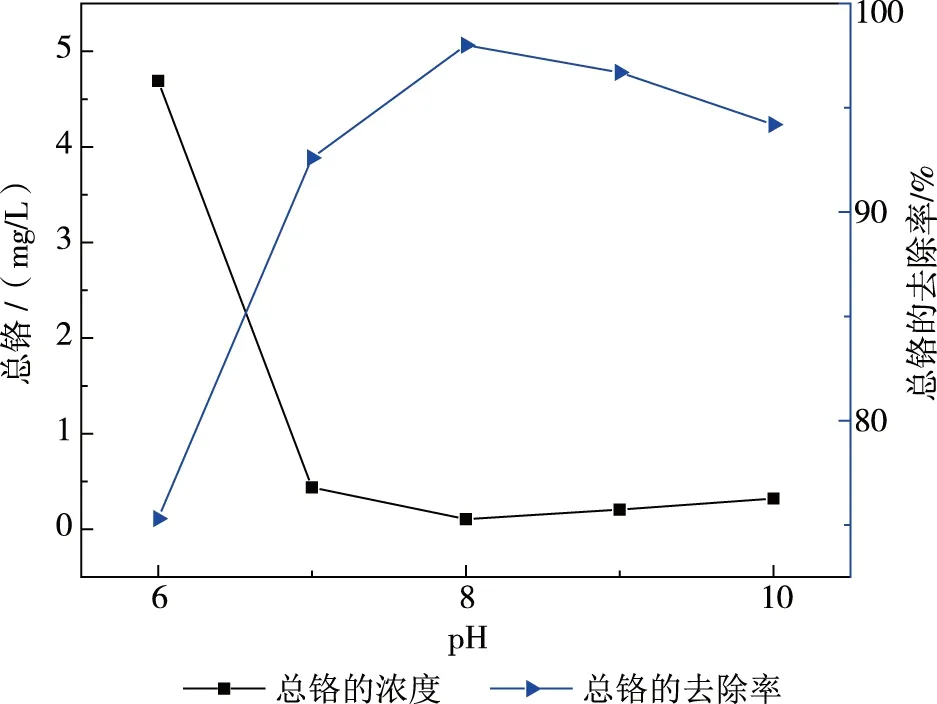
圖4 不同沉淀pH值對總鉻的影響
實驗中發現,在加入20%NaOH時,在廢槽液水樣中有白色沉淀生成,溶液在pH值為6.0時的顏色是綠色,有大量白色沉淀生成;溶液在pH值為7.0~8.0時的顏色逐漸變淡,同時有白色沉淀產生;溶液在pH值為9.0~10.0時的顏色和pH值為7.0~8.0一樣,而且溶液呈現渾濁,從圖4中可以看出,總鉻的去除率在pH值為8.0時,最大為99.8%;總鉻的去除率在pH值為6.0時,最小為75%;總鉻的去除率當pH值為10.0時,比pH值為8.0時低。這是因為,pH為6.0時,沒有足夠的OH-來沉淀廢槽液水樣中的Cr3+。而且氫氧化鉻是兩性的,過量的OH-會重新溶解沉淀,因此,總鉻的去除率在pH值為10.0時會降低。所以Cr3+最佳沉淀pH為8.0。
3 結論
(1) Cr6+的還原必須控制在酸性環境下進行,當酸性增加時,有利于Cr3+生成。等量的含鉻廢槽液當pH值為1.5或更低時,反應時間很短;當pH值為2.0左右時,反應時間為20~30 min;當pH大于3.0時,反應時間就會很長,甚至沒有反應。處理大量的含鉻電鍍廢槽液,一般控制pH在2.0左右,pH值過低則耗酸量太大,不經濟,pH過大則影響處置效果。
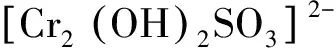
(3) 本次工程以焦亞硫酸鈉作還原劑,嚴格控制還原Cr6+的pH=2.0,沉淀Cr3+pH=8.0~9.0,能夠有效地將槽液中Cr6+完全還原,并能把Cr3+完全沉淀下來,總鉻的去除率達到了最好的效果,為99.8%。
(4) 經過具有相關資質的檢測單位檢測,最終檢測排放廢水中Cr6+的質量濃度為0.018 mg/L,總鉻的質量濃度為0.624 mg/L,達到我國GB 21900—2008《電鍍污染物排放標準》表3中規定的Cr6+和總鉻的排放標準,對實際工程操作具有指導意義。
[1] 李巖.電鍍廢水處理的新工藝[D].武漢:中南民族大學,2005.
[2] 安茂忠.電鍍理論與技術[M].哈爾濱:哈爾濱工業大學出版社,2004:1-380 .
[3] 張崇華.電鍍廢水治理技術綜述[M].北京:中國環境科學出版社,1992:1-98 .
[4] 趙濟強,林西華.電鍍涂裝綜合廢水處理工程實踐[J].工業水處理,2005,25(11):60-62.
[5] 湯榮年.電鍍廢水綜合治理新工藝研究[D].天津:天津大學,2003:1-8.
[6] 彭昌盛,孟洪,谷慶寶,等.化學法處理混合電鍍廢水的工藝流程及藥劑選擇[J].水處理技術,2003,29(6):363-366.
[7] 劉世德.綜合電鍍廢水化學處理方法的預處理工藝研究[D].天津:天津大學,2009:1-16 .
[8] Algarra M, Jimenez M V, Castellion E R, et al. Heavy metals removal from electroplating wastewater by aminopropyl-Si MCM-41[J]. Chemosphere,2005,59: 779-786.
[9] Gomathi P C, Basha A, Ramamurthi V, et al. Recovery and reuse of Ni(Ⅱ) from rinsewater of electroplating industries[J]. Journal of Hazardous Materials,2009,163: 899-909 .
[10] 趙彩玲,高風光.分光光度法快速測定水中Cr6+[J].化學分析計量,2006, 15(5):63-64.
[11] 屠振密,鄭劍,李寧,等.Cr3+電鍍鉻現狀及發展趨勢[J].表面技術,2007,36(5):59-64.
[12] 魏廣艷.重金屬捕集劑對電鍍廢水處理效果研究及應用[D].南京:河海大學,2006:11-14.
[13] 劉存海,王廷平,廖全義.鍍鉻廢水中鉻的回收及其應用[J].電鍍與精飾,2007,29(5):9-12.
Treatment of chromium (Ⅵ)-containing electroplate wastewater
Shu Gang,Liu Dingfu,Li Yu
(Guizhou University,Guiyang 550025,China)
In this paper, chemical reduction and precipitation method was used to treat the electroplate wastewater which contained high level of chromium (VI), and some parameters were determined through experiments. In this method, sodium metabisulfite was used as the reducing agent. When the pH of the solution was controlled at 2.0, and the dosage of sodium metabisulfite was 14.95 g/L, almost all the chromium (VI) could be reduced into chromium (Ⅲ); then when the pH was adjusted to 8.0, 99.8% of chromium (Ⅲ) could be precipitated and removed. The result of this study could be helpful reference for engineering practices.
electroplating wastewater containing chromium (Ⅵ); chemical reduction and precipitation; sodium metabisulfite
2014-10-30;2014-11-26修回
舒剛,男,1990年生,碩士研究生,研究方向:清潔生產工藝與綠色化工技術開發研究。 E-mail:85689820@qq.com
劉定富,男,1962年生,教授,研究方向:清潔生產工藝與綠色化工技術開發研究。 E-mail:liuxiao8989@163.com
X703
A

