流感病毒多表位核酸疫苗CTB-Eg的構(gòu)建與細(xì)胞轉(zhuǎn)染研究*
寇靜遠(yuǎn) 潘興 李婉宜 鄺玉 周琳琳 楊靖 石新麗 陸順順黃筱鈞 鄧昭敏 秦臻 王保寧 李明遠(yuǎn)
(1.四川大學(xué)華西基礎(chǔ)醫(yī)學(xué)與法醫(yī)學(xué)院微生物教研室, 四川 成都 610041;2.湖北醫(yī)藥學(xué)院微生物學(xué)教研室, 湖北 十堰 442000)
流感病毒多表位核酸疫苗CTB-Eg的構(gòu)建與細(xì)胞轉(zhuǎn)染研究*
寇靜遠(yuǎn)1潘興1李婉宜1鄺玉1周琳琳1楊靖2石新麗1陸順順1黃筱鈞1鄧昭敏1秦臻1王保寧1李明遠(yuǎn)1
(1.四川大學(xué)華西基礎(chǔ)醫(yī)學(xué)與法醫(yī)學(xué)院微生物教研室, 四川 成都 610041;2.湖北醫(yī)藥學(xué)院微生物學(xué)教研室, 湖北 十堰 442000)
目的 設(shè)計(jì)并構(gòu)建含分子內(nèi)佐劑的流感病毒多表位核酸疫苗CTB-Eg,初步研究其在HEK293T細(xì)胞中的轉(zhuǎn)染效率。方法 通過生物信息學(xué)軟件設(shè)計(jì)并合成了含分子內(nèi)佐劑的流感病毒多表位基因CTB-Eg,將其插入真核載體pEGFP-C2中,獲得了重組質(zhì)粒pEGFP-C2/CTB-Eg;用脂質(zhì)體法轉(zhuǎn)染HEK293T細(xì)胞,通過熒光顯微鏡觀察和PCR法檢測(cè)其轉(zhuǎn)染效率。結(jié)果 成功構(gòu)建了真核表達(dá)質(zhì)粒pEGFP-C2/CTB-Eg,且該重組質(zhì)粒能在HEK293T細(xì)胞中瞬時(shí)轉(zhuǎn)染, 轉(zhuǎn)染效率在50%~70%之間。結(jié)論 本研究成功設(shè)計(jì)、構(gòu)建了CTB-Eg融合基因,其在HEK293T細(xì)胞中轉(zhuǎn)染效率較高,為流感病毒多表位核酸疫苗CTB-Eg在小鼠體內(nèi)的抗病毒作用研究奠定了堅(jiān)實(shí)基礎(chǔ)。
流感病毒; 核酸疫苗; 多表位基因; 霍亂毒素B亞單位
季節(jié)性流感至少影響著全球15% 的人口,每年約有50 萬人死于流感[1~4]。同其他病毒性疾病一樣,流感的防治尚無特別有效的方法,接種疫苗被認(rèn)為是預(yù)防流感發(fā)生與傳播的最佳方法。目前使用的流感疫苗主要是以血凝素(Hem- agglutinin,HA)和神經(jīng)氨酸酶(Neuraminidase,NA)作為靶抗原。然而HA基因很容易發(fā)生變異,針對(duì)特定流感病毒株的疫苗不能對(duì)其他的病毒株產(chǎn)生相應(yīng)的保護(hù)性。因此,研發(fā)能夠誘導(dǎo)廣譜免疫反應(yīng)的通用流感疫苗已經(jīng)成為流感疫苗研究的重要趨勢(shì)[5、6]。本研究將前期設(shè)計(jì)合成的新型流感病毒多表位基因Eg[7]與分子內(nèi)佐劑CTB串聯(lián),連接至真核表達(dá)載體pEGFP-C2中,構(gòu)建了流感病毒多表位核酸疫苗CTB-Eg,并對(duì)其在真核細(xì)胞HEK293T中的轉(zhuǎn)染效率做了初步研究,為流感病毒多表位核酸疫苗CTB-Eg在小鼠體內(nèi)的抗病毒作用研究奠定了堅(jiān)實(shí)基礎(chǔ)。
1 材料與方法
1.1 實(shí)驗(yàn)材料 大腸桿菌DH5α菌株由本教研室保存;真核表達(dá)質(zhì)粒pEGFP-C2購自ATCC(America Type Culture Collection);人胚腎HEK293T(Human embryonic kidney 293)細(xì)胞源自美國ATCC;轉(zhuǎn)染試劑Lipofectamine TM 2000 、膠回收試劑盒和質(zhì)粒提取試劑盒均購自Invitrogen公司;PCR試劑盒(SinoBio 2× Taq Master Mix)、Trizol試劑、T4連接酶、限制性內(nèi)切酶EcoR I和Hind III購自TAKARA公司;青霉素和卡那霉素為北京百泰克生物技術(shù)有限公司;DMEM、RPMI-1640細(xì)胞培養(yǎng)基購自Gibco公司,新生小牛血清購自中美合資蘭州民海生物工程有限公司;96孔培養(yǎng)板、24孔培養(yǎng)板和6孔培養(yǎng)板為Corning 公司產(chǎn)品。
1.2 實(shí)驗(yàn)方法
1.2.1 CTB-Eg的設(shè)計(jì)與合成 為了增加流感病毒多表位核酸疫苗的抗原性及靶向性,選擇兼具神經(jīng)節(jié)苷脂結(jié)合活性及粘膜佐劑活性的霍亂腸毒素B亞單位(CTB)作為分子內(nèi)佐劑,重新設(shè)計(jì)并合成了分子內(nèi)佐劑-流感病毒多表位基因融合疫苗CTB-Eg,并通過ProPred、SWISS-MODEL等生物信息學(xué)軟件,對(duì)CTB-Eg蛋白進(jìn)行了3維建模。目的片段Eg、CTB及CTB-Eg 均由華大基因合成。合成的puc57/CTB、puc57/Eg、puc57/ CTB-Eg質(zhì)粒通過EcoR Ⅰ和Hind Ⅲ酶切位點(diǎn)分別進(jìn)行單、雙酶切鑒定,并回收雙酶切產(chǎn)物。
1.2.2 重組真核表達(dá)質(zhì)粒pEGFP-C2/CTB-Eg的構(gòu)建 pEGFP-C2質(zhì)粒經(jīng)EcoR Ⅰ和Hind Ⅲ雙酶切膠回收后,在T4 DNA連接酶的作用下,分別與目的片段CTB、Eg和CTB-Eg連接,載體與目的片段摩爾比為1∶10。連接產(chǎn)物轉(zhuǎn)化感受態(tài)大腸桿菌DH5α,在含有卡那霉素的LB平板上篩選克隆。挑取陽性克隆,搖菌擴(kuò)增,DNA抽提試劑盒提取質(zhì)粒,并進(jìn)行單、雙酶切鑒定和基因測(cè)序鑒定。
1.2.3 HEK293T細(xì)胞的培養(yǎng)和轉(zhuǎn)染 HEK293T細(xì)胞株于37℃、5%的CO2條件下, 在含10%胎牛血清、100 μg/ml青霉素及100 U/ml鏈霉素的DMEM高糖培養(yǎng)基中進(jìn)行培養(yǎng)。將生長良好的細(xì)胞用上述完全培養(yǎng)基調(diào)至2×105~5×105/ml后按2 ml/孔分裝至6孔板中,待細(xì)胞貼壁生長至大約70%覆蓋密度時(shí)進(jìn)行質(zhì)粒DNA轉(zhuǎn)染。轉(zhuǎn)染采用Lipofectamine TM 2000試劑,按pEGFP-C2、pEGFP-C2/CTB、pEGFP-C2/Eg、pEGFP-C2/CTB-Eg質(zhì)粒DNA 0.2 g/孔、轉(zhuǎn)染試劑1 μl/孔對(duì)細(xì)胞進(jìn)行轉(zhuǎn)染,同時(shí)設(shè)立不進(jìn)行轉(zhuǎn)染的細(xì)胞對(duì)照孔。轉(zhuǎn)染細(xì)胞培養(yǎng)48 h后,在倒置熒光顯微鏡下,利用pEGFP-C2質(zhì)粒自帶的EGFP標(biāo)簽檢測(cè)重組質(zhì)粒的轉(zhuǎn)染效率。
1.2.4 PCR法檢測(cè)重組質(zhì)粒在HEK293T細(xì)胞中的轉(zhuǎn)染情況 分別設(shè)計(jì)CTB、Eg、CTB-Eg引物各一對(duì),引物序列見表1。轉(zhuǎn)染細(xì)胞培養(yǎng)48小時(shí)后,利用普通PCR法檢測(cè)重組質(zhì)粒在HEK293T細(xì)胞中的轉(zhuǎn)染情況。

表1 PCR擴(kuò)增CTB、Eg、CTB-Eg 3者的引物序列
2 結(jié)果
2.1 CTB-Eg結(jié)構(gòu)示意圖及其3級(jí)結(jié)構(gòu) 在前期構(gòu)建的流感病毒多表位基因Eg[7]的N末端添加已去除信號(hào)肽的CTB序列,GGGGS為二者的連接序列,進(jìn)而構(gòu)建了流感病毒多表位核酸疫苗CTB-Eg,見圖1。CTB-Eg三級(jí)結(jié)構(gòu)顯示Linker序列GGGGS、AAY有效地維持了各個(gè)抗原的空間結(jié)構(gòu),避免了抗原表位間的相互干擾,見圖2。
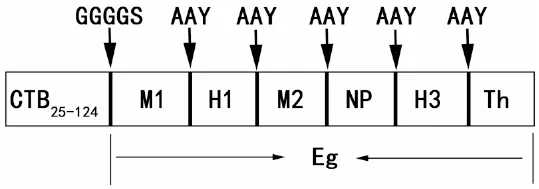
圖1 CTB-Eg構(gòu)建示意圖
Fig. 1 Schematic representation of the designed multi-epitope vaccine CTB-Eg
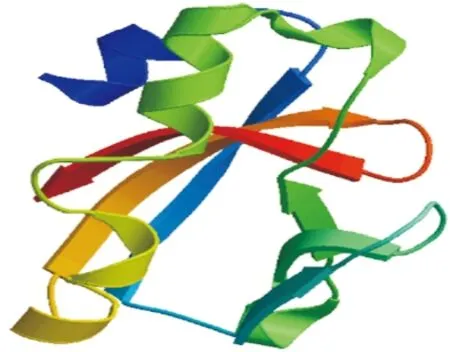
圖2 SWISS-MODEL預(yù)測(cè)CTB-Eg的3級(jí)結(jié)構(gòu)
Fig. 2 Three dimensional (3D) structure information of CTB-Eg.
2.2 CTB、Eg、CTB-Eg目的片段和真核載體pEGFP-C2的鑒定 puc57/CTB、puc57/Eg、puc57/ CTB-Eg及pEGFP-C2質(zhì)粒分別經(jīng)EcoR I和Hind III進(jìn)行單、雙酶切,經(jīng)1.5%的瓊脂糖凝膠電泳,可分別在312 bp、264 bp、579 bp和4700 bp處出現(xiàn)明顯條帶,見圖3,與目的片段及載體pEGFP-C2片段大小一致。
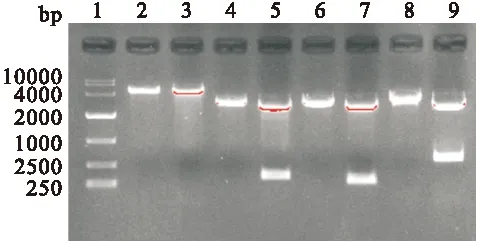
圖3 1.5%瓊脂糖凝膠電泳檢測(cè)目的基因片段大小
Fig.3 Restriction analysis of recombinant plasmids
1: DNA Maker;2、3:pEGFP-C2載體單、雙酶切 ;4、5:puc57/CTB單、雙酶切;6、7:puc57/Eg單、雙酶切;8、9:puc57/CTB-Eg單、雙酶切
2.3 重組質(zhì)粒的酶切鑒定及測(cè)序鑒定 重組質(zhì)粒pEGFP-C2/CTB、pEGFP-C2/Eg、 pEGFP-C2/CTB-Eg 分別進(jìn)行EcoR I、Hind III單、雙酶切鑒定,1.5%瓊脂糖凝膠電泳顯示獲得了312 bp、264 bp、579 bp的插入片段,見圖4。測(cè)序結(jié)果同樣證實(shí)所獲目的片段與設(shè)計(jì)的基因序列完全一致,無堿基突變。
2.4 熒光顯微鏡觀察重組質(zhì)粒轉(zhuǎn)染HEK293T細(xì)胞 重組質(zhì)粒pEGFP-C2/CTB、pEGFP-C2/Eg、 pEGFP-C2/CTB-Eg轉(zhuǎn)染HEK293T細(xì)胞48 h后,熒光顯微鏡觀察EGFP綠色熒光信號(hào)。結(jié)果可見重組質(zhì)粒轉(zhuǎn)染HEK293T細(xì)胞的轉(zhuǎn)染效率達(dá)50%~70%,對(duì)照孔未見熒光,見圖5。
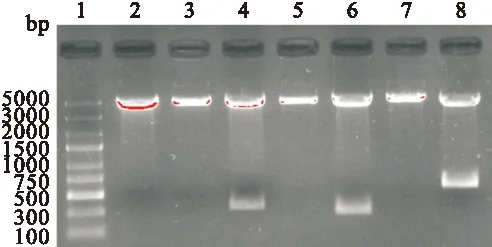
圖4 重組真核表達(dá)質(zhì)粒EcoR I和Hind III單、雙酶切分析
Fig. 4 Restriction analysis of recombinant plasmids.
1: DNA Maker;2:pEGFP-C2載體雙酶切 ;3、4:pEGFP-C2/CTB單、雙酶切;5、6: pEGFP-C2/Eg單、雙酶切;7、8:pEGFP-C2/ CTB-Eg單、雙酶切
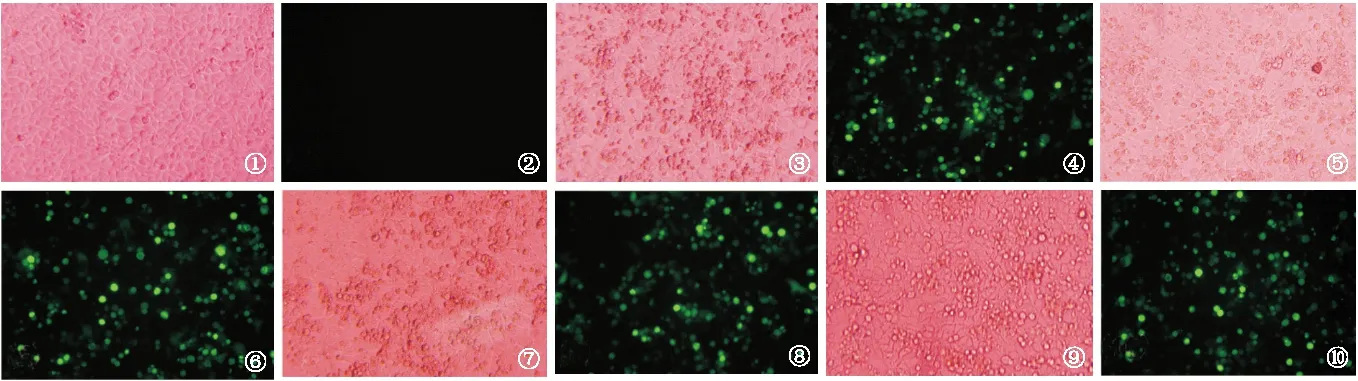
圖5 熒光顯微鏡檢測(cè)各組重組質(zhì)粒在HEK293T細(xì)胞中的轉(zhuǎn)染效率(×200)
Fig.5 Fluorescence microscope detection of the transfection effiencyof recombinant plasmids.
①、②:空白組;③、④:pEGFP-C2組;⑤、⑥:pEGFP-C2/CTB組;⑦、⑧:pEGFP-C2/Eg組;⑨、⑩:pEGFP-C2/CTB-Eg組
2.5 PCR法鑒定重組質(zhì)粒轉(zhuǎn)染HEK293T 重組質(zhì)粒轉(zhuǎn)染HEK293T細(xì)胞48小時(shí)后,利用普通PCR法檢測(cè)重組質(zhì)粒在293T細(xì)胞中的轉(zhuǎn)染情況。經(jīng)1.5%的瓊脂糖凝膠電泳,可分別在312 bp、264 bp和579 bp處出現(xiàn)條帶,與目的片段大小一致,見圖6。
3 討論
流感病毒獨(dú)特的基因結(jié)構(gòu)導(dǎo)致其極易發(fā)生變異,而新病毒株的出現(xiàn)意味著那些接種過傳統(tǒng)流感疫苗的人群對(duì)新出現(xiàn)的流行株同樣敏感。因此,流感疫苗的研究焦點(diǎn)是研發(fā)對(duì)不同亞型流感病毒都具有交叉保護(hù)作用的通用型長效疫苗,而多表位基因疫苗的構(gòu)想有望實(shí)現(xiàn)這一目標(biāo)。
多表位核酸疫苗可在宿主細(xì)胞系統(tǒng)中轉(zhuǎn)錄并表達(dá)多個(gè)不同的保護(hù)性抗原表位,從多個(gè)方面誘導(dǎo)機(jī)體
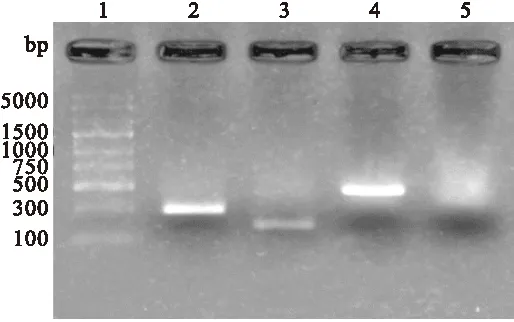
圖6 PCR檢測(cè)各組質(zhì)粒在HEK293T細(xì)胞中的轉(zhuǎn)染情況
Fig. 6 PCR analysis of the transfection of recombinant plasmids.
1:DNA Maker; 2: pEGFP-C2/CTB組;3: pEGFP-C2/Eg組;4: pEGFP-C2/CTB-Eg組; 5: pEGFP-C2載體組
的免疫應(yīng)答,是一種具有廣譜免疫反應(yīng)的通用疫苗。且DNA疫苗在體內(nèi)有長期持久的免疫原性,其表達(dá)蛋白的結(jié)構(gòu)類似于正常真核細(xì)胞的表達(dá)結(jié)構(gòu)[8]。DNA編碼的相關(guān)蛋白作為內(nèi)源性抗原經(jīng)由MHC-Ⅰ類途徑加工處理后,表達(dá)于抗原提成細(xì)胞(antigen presenting cell, APC)表面,進(jìn)一步刺激細(xì)胞毒性T細(xì)胞的活化。抗原肽也可作為分泌性蛋白,通過B細(xì)胞表面抗原受體直接識(shí)別結(jié)合進(jìn)而攝取抗原,并經(jīng)MHC-Ⅱ類途徑加工處理后形成的抗原肽,以抗原肽-MHC-Ⅱ類分子復(fù)合物的形式轉(zhuǎn)運(yùn)到細(xì)胞表面,供CD4+ Th細(xì)胞識(shí)別,從而啟動(dòng)特異性體液免疫應(yīng)答,同時(shí)產(chǎn)生記憶B細(xì)胞參與二次免疫,保護(hù)宿主免受相關(guān)微生物的攻擊[9]。
Graeme等研究表明NP和M2的表達(dá)可顯著降低流感病毒在小鼠之間的傳播[10]。Donnelly等構(gòu)建了含有不同流感病毒株HA、M1和NP的融合DNA疫苗,該疫苗可以有效的提高小鼠的免疫保護(hù)率[11]。還有研究證實(shí),含有HA基因的DNA疫苗加上NP或M基因,被免疫的小鼠可以抵抗不同亞型的流感病毒[12,13],其中M1或NP基因能提高疫苗的保護(hù)性并使免疫小鼠抵抗不同亞型流感病毒的攻擊,而M2基因?qū)γ庖咝∈笕狈τ行У谋Wo(hù)作用[14]。流感病毒感染人體后,只有1%~2%的人會(huì)產(chǎn)生抗M2e抗體,該抗體可能通過與感染細(xì)胞結(jié)合,介導(dǎo)CD+8 T細(xì)胞的殺細(xì)胞過程[15]。本研究從HA蛋白選擇了2個(gè)B細(xì)胞表位,分別在NP、M1、M2蛋白選擇了3個(gè)T細(xì)胞表位。既保留HA表位良好的抗原性及誘導(dǎo)中和抗體的能力,又可能通過高度保守的M、NP蛋白克服HA高度變異所導(dǎo)致的疫苗交叉保護(hù)性弱的問題。為防止DNA疫苗在體內(nèi)非特異性降解而導(dǎo)致的效率減弱及各表位間相互抑制的問題,課題中我們將所選取的5個(gè)表位通過不同排列方式串聯(lián)組合,通過生物信息學(xué)分析評(píng)估,選取最佳組合方式,加上適當(dāng)?shù)拈g隔序列設(shè)計(jì)成流感通用多表位基因疫苗Eg。
霍亂毒素(cholera toxin,CT)是最常用的免疫佐劑之一,由霍亂弧菌(Vibrio cholerae)分泌,分子量大小為84 kD,具有很強(qiáng)的免疫原性和粘膜免疫佐劑性。CT的結(jié)構(gòu)為一個(gè)A亞單位、五個(gè)B亞單位。CTB分子量大小為11.6 kD,五分子的CTB通過鹽鍵和氫建聚集成56 kD的大亞基,呈圓筒狀,與真核細(xì)胞表面的神經(jīng)節(jié)苷脂GM1結(jié)合,可使連接的抗原與粘膜作用,進(jìn)而引起一系列的生化反應(yīng),產(chǎn)生更強(qiáng)的免疫效果[16]。CTB可促進(jìn)抗原通過粘膜屏障,加強(qiáng)抗原被樹突狀細(xì)胞和其他抗原提呈細(xì)胞的提呈作用,增強(qiáng)抑制性T細(xì)胞分泌TGF-β。重組CTB去除了CTA的毒性,保留了霍亂毒素的免疫佐劑性,從而使機(jī)體產(chǎn)生較強(qiáng)的系統(tǒng)免疫應(yīng)答和局部黏膜免疫應(yīng)答[17,18]。因此,在多表位核酸疫苗的設(shè)計(jì)中,我們?cè)谄銷末端添加霍亂毒素B亞單位(cholera toxin B subunit, CTB)作為分子內(nèi)佐劑,期望能增強(qiáng)疫苗的免疫效果。
4 結(jié)論
本實(shí)驗(yàn)將流感多表位基因Eg與分子內(nèi)佐劑CTB串聯(lián),連接至真核表達(dá)載體pEGFP-C2中,構(gòu)建了流感病毒多表位核酸疫苗CTB-Eg,并對(duì)其在真核細(xì)胞HEK293T中的轉(zhuǎn)染情況做了初步研究,為下一步流感病毒多表位核酸疫苗CTB-Eg在小鼠體內(nèi)的抗流感作用研究奠定了實(shí)驗(yàn)基礎(chǔ)。
[1]Meng S, L.Z., Xu L,etal. Intranasal immunization with recombinant HA and mast cell activator C48/80 elicits protective immunity against 2009 pandemic H1N1 influenza in mice[J]. PLoS One, 2011, 6(5): e19863.
[2]Ferraris O, E.V., Bouscambert M,etal. H1N1 influenza A virus neuraminidase modulates infectivity in mice[J]. Antiviral Res, 2012, 93(3): 374-380.
[3]Imai M, Watanabe T, Hatta M,etal. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets[J]. Nature, 2012, 486(7403): 420-428.
[4]Seasonal influenza: World Health Organization, Copenhagen, Denmark (2009). (www.euro.who.int/influenza/2008618_1).
[5]Girard MP, Cherian T, Pervikov Y,etal. A review of vaccine research and development: human acute respiratory infections[J]. Vaccine, 2005, 23 (50): 5708-5724.
[6]陳則.通用流感疫苗進(jìn)展研究[J]. 湖南師范大學(xué)學(xué)報(bào)(醫(yī)學(xué)版),2012, 9 (3):1-5.
[7]邵京京,豐鋒,張強(qiáng),等.流感病毒多表位基因盒的設(shè)計(jì)與預(yù)測(cè)[J].華西藥學(xué)雜志,2012,27(005):486-489.
[8]Alarcon JB, Waine GW, McManus DP. DNA vaccines: technology and application as anti-parasite and anti-microbial agents[J]. Adv Parasitol, 1999, 42: 343-410.
[9]Kishwar Hayat Khan. DNA vaccine: roles against diseases[J]. Germs, 2013, (3)1: 27-35.
[10] Graeme E. Price, Chia-Yun Lo,etal. Mucosal Immunization with a Candidate Universal Influenza Vaccine Reduces Virus Transmission in a Mouse Model[J]. Journal of Virology, 2014, 88(11): 6019-6030.
[11] Donnelly JJ, Friedman A, Ulmer JB,etal. Further protection against antigenic drift of influenza virus in a ferret model by DNA vaccination[J]. Vaccine, 1997, 15(8): 865-868.
[12] Chen Q, Kuang H, Wang H,etal. Comparing the ability of a series of viral proteinexpressing plasmid DNAs to protect against H5N1 influenza virus[J]. Virus Genes, 2009, 38(1): 30-38.
[13] Chen Z, Yoshikawa T, Kadowaki S,etal. Protection and antibody responses in different strains of mouse immunized with plasmid DNAs encoding influenza virus haemagglutinin, neura-minidase and nucleoprotein [J]. J Gen Virol, 1999, 80(10): 2559-2564.
[14] M. Zheng, J. Luo, Z. Chen. Development of universal influenza vaccines based on influenza virus M and NP genes[J]. Infection, 2014, 42(2): 251-262.
[15] Oxford JS. Towards a universal influenza vaccine: volunteer virus challenge studies in quarantine to speed the development and subsequent licensing[J]. Br J Clin Pharmacol, 2013, 76(2): 210-216.
[16] Hiramatsu Y, Yamamoto M, Satho T,etal. Recombinant fusion protein of cholera toxin B subunit with YVAD secreted by Lactobacillus casei inhibits lipopolysaccharide-induced caspase-1 activation and subsequent IL-1 beta secretion in Caco-2 cells[J]. BMC Biotechnol, 2014, 14(1): 38.
[17] Sun JB, Raghavan S, Sjoling A,etal. Oral tolerance induction with antigen conjugated to cholera toxin B subunit generates both Foxp3+ CD25+ and Foxp3+ CD25+ CD4+ regulatory T cells[J]. Immunol, 2006, 177(11): 7624-7644.
[18] Luci C, Hervouet C, Rousseau D,etal. Dendritic cell-mediated induction of mucosal cytotoxic responses following intravaginal immunization with the nontoxic B subunit of cholera toxin[J]. Immunol, 2006, 176(5): 2749-2757.
Construction and transfection of a multi-epitope DNA vaccine CTB-Eg of influenza
KOU Jing-yuan1, PAN Xing1, LI Wan-yi1,etal
(1.DepartmentofMicrobiology,WestChinaSchoolofPreclinicalandForensicMedicine,SichuanUniversity,Chengdu610041,China; 2.DepartmentofMicrobiology,HubeiUniversityofMedicine,Shiyan442000,China)
Objective To design and construct the eukaryotic expression vector of CTB-Eg fusion gene of influenza virus, and study the transfection efficiency of pEGFP-C2/CTB-Eg in HEK293T cells. Methods CTB-Eg fusion gene containing CTB (cholera toxin B subunit) as the molecule adjuvant was designed and synthesized. The eukaryotic expression vector of pEGFP-C2/CTB-Eg was constructed. The certified recombinant plasmid was transfected in HEK293T cells by Liposomal Transfection Reagent. The transfection efficiency of CTB-Eg gene was detected by fluorescence microscope and PCR. Results Expression vector pEGFP-C2/CTB-Eg was constructed successfully. The recombinant plasmid could be transfected in HEK293T cells and its transfection efficiency could reach to 50%-70%. Conclusion The eukaryotic expression vector of pEGFP-C2/CTB-Eg was constructed successfully and transfected in HEK293T cells.
Influenza virus; DNA vaccine; multi-epitope genes; Cholera toxin B subunit
四川省科技廳支撐計(jì)劃項(xiàng)目(2014SZ0036)
李婉宜,教授,E-mail:hxliwanyi@126.com
R 181.2+4
A
10.3969/j.issn.1672-3511.2015.02.007
2014-07-11; 編輯: 張文秀)

