綠色熒光蛋白標記兔BMSCs體外成骨的定量能譜分析
寧寅寬,李 強,蔡偉良,武成聰,陳佳濱,石正松
綠色熒光蛋白標記兔BMSCs體外成骨的定量能譜分析
寧寅寬,李 強,蔡偉良,武成聰,陳佳濱,石正松
摘要目的 觀察綠色熒光蛋白(GFP)標記的兔骨髓間充質干細胞(BMSCs)成骨誘導后形態學改變和體外骨生成中礦化鈣結節的形成,并結合掃描電鏡和X射線能譜分析技術(SEM/EDS)對礦化鈣結節元素進行定量能譜分析。方法用攜帶GFP基因的腺病毒轉染兔BMSCs進行示蹤標記,并誘導細胞向成骨方向分化,通過倒置熒光顯微鏡、鈣結節茜素紅染色觀察成骨誘導后細胞形態改變和礦化鈣結節的形成,結合SEM/EDS技術觀測礦化鈣結節的表面微觀結構及其元素構成。結果 腺病毒介導GFP基因(Ad-GFP)轉染兔BMSCs后在熒光顯微鏡下觀察到綠色熒光,經成骨誘導后細胞形態向成骨方向分化,并形成不透光的礦化鈣結節,鈣結節茜素紅染色見紅色礦化結節,SEM下見礦化鈣結節散布于細胞中,細胞重疊生長,分泌基質旺盛。EDS分析顯示礦化鈣結節主要組成元素與正常骨組織相同,其鈣磷比(Ca/P)為1.55,接近正常骨組織鈣磷比1.49。結論 Ad-GFP能成功轉染并標記兔BMSCs,成骨誘導后BMSCs向成骨方向分化,具備較好的骨生成能力,BMSCs體外礦質化成骨過程與體內基本相同。
關鍵詞重組腺病毒;綠色熒光蛋白;骨髓間充質干細胞;掃描電鏡;能譜分析
2014-12-31接收
作者單位:桂林醫學院附屬醫院四肢創傷手外科,桂林 541001
在觀察骨髓間充質干細胞(bone-marrow mesenchymal stem cells,BMSCs)體外誘導成骨時,一般通過生物化學檢測方法檢測所培養BMSCs內堿性磷酸酶活性,Ⅰ型膠原、成骨特異性蛋白和成骨分化調控因子的表達等,但這些生物化學檢測方法僅能間接地反映BMSCs體外成骨分化的生物特性,而對BMSCs體外骨生成的直接觀測方法較少[1]。綠色熒光蛋白(green fluorescent protein,GFP)基因標記是一種細胞示蹤技術,用GFP標記BMSCs可直接觀察細胞的形態改變和空間分布[2]。該實驗以腺病毒為表達載體,介導GFP基因標記兔BMSCs,在即時動態觀察成骨誘導后細胞形態學改變的同時,并結合掃描電鏡和X射線能譜分析(scanning electron microscope and energy dispersive spectrometer,SEM/EDS)技術直接觀測BMSCs成骨分化中礦化鈣結節的表面微觀結構及其鈣、磷元素含量,定量研究BMSCs體外骨生成中礦化鈣結節元素組成。
1 材料與方法
1.1 實驗材料
1.1.1 腺病毒載體 Ad-GFP表達載體由美國英濰捷基(上海)貿易有限公司構建、鑒定和提供。采用免疫法檢測腺病毒滴度,病毒滴度為2×1010pfu/ml。
1.1.2 兔BMSCs 本課題組前期實驗已完成了兔
BMSCs的原代獲取、傳代培養及鑒定,并取第5代細胞液氮凍存備用[3]。本次實驗細胞為第5代凍存細胞復蘇后傳代至第10代的BMSCs。
1.1.3 實驗動物 健康雄性成年新西蘭大白兔1只,7月齡,3.5 kg,清潔級,購于桂林醫學院動物實驗中心,實驗過程中對動物的處置符合醫學倫理學標準。
1.1.4 主要試劑和儀器 低糖DMEM、胰蛋白酶、胎牛血清(美國Hyclone公司);維生素C、β-磷酸甘油、地塞米松(韓國Biosharp公司);茜素、戊二醛(美國Sigma公司);CO2細胞培養箱(美國Thermo Scientifc公司);生物安全柜(中國蘇凈安泰公司);倒置熒光顯微鏡(日本Olympus公司);場發射SEM(荷蘭飛利浦公司);EDS儀(英國牛津公司)。
1.2 實驗方法
1.2.1 兔BMSCs的復蘇和傳代培養 將待復蘇的兔BMSCs凍存管迅速解凍,轉移至含有3倍于凍存保護液體積的L-DMEM離心管中離心,棄上清液,細胞沉淀中加入5 ml完全培養基,充分吹打細胞懸液至細胞分布均勻,以含15%血清的L-DMEM完全培養基(含100 IU/ml青霉素、100 IU/ml鏈霉素)接種于25 cm2塑料培養瓶,置于37℃、5%CO2飽和濕度環境中培養,細胞復蘇24 h后換液。各代BMSCs體外培養至單層細胞匯合約80%,用0.25%胰蛋白酶消化,行1∶2~3傳代培養,細胞傳至第10代進行實驗。
1.2.2 兔BMSCs的轉染和成骨誘導 設置轉染復數(MOI=100),用重組腺病毒Ad-GFP轉染細胞,轉染24 h后換液。轉染后第3天,更換成骨誘導液(含10 nmol/L地塞米松、15 mmol/L維生素C、10 mmol/L β-磷酸甘油、pH 7.3、含15%血清的LDMEM)培養細胞,以后每3 d更換1次成骨誘導液,培養1周后,更換完全培養基培養。在倒置熒光顯微鏡下逐日觀察轉染及誘導后細胞形態及生長情況。
1.2.3 鈣結節茜素紅染色觀察鈣化斑的形成 兔BMSCs以1×105個/孔接種6孔板進行細胞爬片處理,接種前每孔預先放置已消毒的20 mm蓋玻片。經轉染及成骨誘導液培養后,在倒置顯微鏡下觀察礦化鈣結節的形成,并于第21天隨機細胞爬片,用PBS漂洗3次,95%乙醇固定10 min,蒸餾水沖洗3次,滴加0.1%茜素紅染液,常溫染色1 h,蒸餾水沖洗,干燥,直接鏡下觀察。
1.2.4 SEM觀察和EDS分析 第21天隨機取細胞爬片,用2.5%戊二醛固定,梯度丙酮脫水,真空干燥,噴金鍍膜,在Quanta 200 FEG場發射環境SEM和EDS儀上進行測試。在SEM下觀察細胞及鈣結節微表面微觀形貌。然后獲取檢測微區,用EDS儀測定微區主要元素(C、O、Ca、P)的重量百分比和原子百分比百分含量,重復3次。能譜儀技術指標:電壓10 kV、電子束6.0、工作距離10.0 mm。取成年新西蘭大白兔髂骨骨皮質,經同樣方法處理后在相同條件下進行觀測。
2 結果
2.1 轉染及成骨誘導后兔BMSCs形態學觀察和鈣結節茜素紅染色 腺病毒介導GFP基因轉染兔BMSCs(MOI=100)后,未見細胞明顯死亡,轉染后24 h后即可看到細胞表達綠色熒光,隨著時間推移熒光表達漸強,48 h達到頂峰,轉染效率約90%。成骨誘導液培養后做不傳代培養,第7天,細胞增殖較前緩慢,細胞形態為長梭形或立方狀;第14天,細胞熒光表達較前減弱,細胞形態為短梭形、三角形或多角形,旋渦狀排列,胞質豐富,內有高折射性空泡和深色顆粒,細胞分泌基質。見圖1。隨時間延長,細胞逐漸變為多層,重疊生長,無接觸抑制現象,并形成結節狀,最終形成不透光的礦化結節;第21天細胞爬片鈣結節茜素紅染色后為紅色鈣結節。見圖2。
2.2 SEM觀察和EDS分析 SEM下見鈣化灶點狀散布于細胞中,相互連接成小片狀,稍凸出于重疊細胞層之上,分泌基質旺盛,鈣化斑結構疏松、粗糙,呈水泥狀。用EDS分析儀檢測SEM掃描微區得出分析圖譜,同時計算機由譜峰強度自動換算為所測主要元素(C、O、Ca、P)的相對含量。見表1。數據顯示鈣化斑區鈣磷比(Ca/P)為1.55,接近羥基磷灰石鈣磷比1.67,說明鈣化斑塊表面有鈣、磷沉積物產生,可能為磷酸鈣鹽。數據顯示正常骨組織鈣磷比1.49,且正常骨組織與鈣化斑內主要組成元素相同,均為鈣和磷元素。但是鈣化斑內鈣、磷元素含量較正常骨組織低,表現為能譜圖中元素峰覆蓋面積積分值比正常骨組織偏低。鈣化斑區和正常骨組織分析圖見圖3。
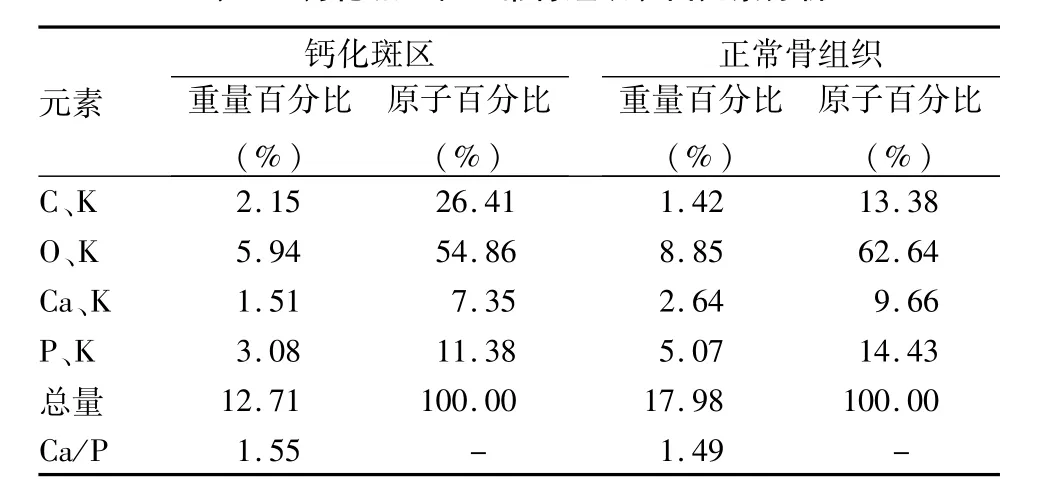
表1 鈣化斑區和正常骨組織表面元素分析
3 討論
BMSCs能較穩定地保持干細胞特性,有多向分化潛能,能在特定的環境下分化為成骨細胞,是骨組織工程中首選種子細胞。同時,其體外高增殖能力為多種載體攜帶目的基因的轉染奠定了基礎[4]。GFP已成為示蹤目的基因表達、細胞蛋白定位和完整活細胞形態和空間分布的重要報告基因,在生物醫學領域的應用日益廣泛[2]。重組腺病毒是一種安全、高效的基因載體,能夠高水平瞬時表達外源基因,克隆的細胞不表達目的基因[4]。本實驗以腺病毒為表達載體,介導GFP基因標記兔BMSCs,在倒置熒光顯微鏡下直接動態即時觀察BMSCs的成骨分化過程中的細胞形態改變和空間分布。顯示兔BMSCs經成骨誘導液培養后,細胞增殖速度開始減慢,細胞形態向成骨方向分化,細胞形態由旋渦狀單層排列的長梭形、立方狀逐漸變為短梭形、三角形或多角形。細胞逐漸變為多層并重疊生長,不出現接觸抑制現象,形成細胞團塊并逐漸增大,最終形成不透光的礦化鈣結節。培養至14 d過程中觀察到綠色熒光表達較前逐漸減弱,可能是GFP表達減弱和細胞大量克隆增殖、重疊生長的共同結果。
BMSCs在特定的化學物質誘導下向成骨方向分化,主要包括地塞米松、β-磷酸甘油、維生素C等。其發生機制可能為地塞米松促進BMSCs早期調節成骨分化基因的表達,并增強堿性磷酸酶的活性,增加細胞外膠原基質合成,最終在成骨分化后期形成礦化鈣結節。β-磷酸甘油為細胞提供足夠的堿性磷酸酶作用的底物,使生長環境中有機磷轉變為無機磷,并加速鈣鹽沉積使細胞及基質骨化,生成礦化鈣結節。維生素C誘導BMSCs合成膠原蛋白,使堿性磷酸酶保持較高活性。細胞外基質鈣化及無機鈣、磷沉積是BMSCs終末期成骨分化的表現[5-6]。本實驗以地塞米松、β-磷酸甘油、維生素C作為成骨誘導培養液體外培養BMSCs,表明BMSCs能形成礦化的細胞外基質,并形成礦化鈣結節,經茜素紅染色后呈紅色。提示細胞已經向終末期成骨分化。礦化鈣結節在SEM下散布于細胞中,相互連接成片,結構疏松、粗糙。EDS分析數據顯示礦化鈣結節可能為鈣、磷沉積所形成的磷酸鈣鹽,為類羥基磷灰石。鈣化斑內主要組成元素與正常骨組織相同,其鈣磷比接近正常骨組織鈣磷比,可以從鈣磷比變化初步說明BMSCs體外礦質化成骨過程與體內基本相同。隨著礦化鈣結節的改建和骨基質中有機膠原成分的增加,體外所生成骨組織將逐漸趨向成熟,鈣磷比值將恢復到正常骨組織比值水平[7]。
骨的鈣化是指無機鹽有序沉積于有機質內的過程。在骨的鈣化過程中,細胞和基質發揮著重要的作用,是成核作用的核心部位,是骨形成的基礎。細
胞和基質成分與羥基磷灰石混合在一起,形成礦化鈣結節[7-8]。骨基質中有機質90%為Ⅰ型膠原蛋白,無機質主要為磷酸鈣鹽,以結晶狀態沉積于膠原上[9]。實驗[10]證實BMSCs經成骨誘導液體外培養后,檢測有Ⅰ型膠原蛋白生成。本實驗在SEM下觀察見細胞重疊生長,分泌基質旺盛,礦化鈣結節散布于細胞中,相互連接成片。說明細胞通過分裂增殖后,大量分泌細胞基質,隨后被自身分泌的基質所包繞,磷酸鈣鹽沉積在細胞基質局部,最終形成礦化鈣結節。再一次證實成骨誘導BMSCs體外礦質化成骨過程與體內基本相同。
參考文獻
[1] 程 谷,李祖兵.骨組織工程中的檢測方法及其效果評估展望[J].國際口腔醫學雜志,2010,35(5):593-6.
[2] Nojima T,Kaneda S,Kimura H,et al.Application of cell-free expression of GFP for evaluation of microsystems[J].Front Biosci,2012,17(1):1931-9.
[3] 武成聰,李 強,陳佳濱,等.短期凍存兔骨髓間充質干細胞對其生物特性的影響[J].重慶醫學,2014,43(4):459-61+64.
[4] Evans C H.Gene therapy for bone healing[J].Expert Rev Mol Med,2010,12(18):1010-7.
[5] Harris N L,Huffer W E,von Stade E,et al.The effect of plateletrich plasma on normal soft tissues in the rabbit[J].J Bone Joint Surg Am,2012,94(9):786-93.
[6] 裴雪濤.再生醫學:理論與技術[M].北京:科學出版社.2010:36-7.
[7] Bonucci E.Bone mineralization[J].Front Biosci,2012,17(1):100-28.
[8] Fukumoto S.Ectopic calcification[J].Clin Calcium,2014,24 (2):185-9.
[9] Price P A,Toroian D,Chan W S.Tissue-nonspecific alkaline phosphatase is required for the calcification of collagen in serum:a possible mechanism for biomineralization[J].J Biol Chem,2009,284(7):4594-604.
[10]陳佳濱,李 強,茹 嘉,等.BMP-2和EGFP重組腺病毒體外轉染兔骨髓間充質干細胞的研究[J].重慶醫學,2014,43(2):193-5+9.
Quantitative energy spectrum analysis on osteogenesis of rabbit bone-marrow mesenchymal stem cells labeled by green fluorescent protein in vitro
Ning Yinkuan,Li Qiang,Cai Weiliang,et al
(Dept of Limb Trauma Surgery,The Affilated Hospital of Guilin Medical University,Guilin 541001)
AbstractObjective To observe the morphological changes of rabbit bone-marrow mesenchymal stem cells(BMSCs)after osteogenic induction and calcified plaque formation of osteogenesis of rabbit BMSCs labeled by green fluorescent protein(GFP)in vitro and quantitatively analyze the elements of calcified plaque by scanning electron microscope and energy dispersive spectrometer(SEM/EDS).Methods The rabbit BMSCs were traced by adenovirus with GFP(Ad-GFP)gene,and then cells were induced differentiation to osteogenesis.Inverted fluorescence microscope and alizarin red staining were applied to observe morphological changes of cells after transfection and calcified plaque formation and SEM/EDS were employed to study the surface microstructure and element composition of calcified plaque.Results Fluorescence microscope showed rabbit BMSCs after Ad-GFP transfection gave green light and the cell morphology differentiated to osteogenic accompanied with opaque mineralized calcium nodule.Alizarin red staining exhibited red mineralized nodules.From SEM,punctate mineralization calcium nodules scattered among cells and cells grew overlapply strongly secreted matrix.EDS confirmed that the main elements of mineralized calcium nodules were analogous to normal bone tissue and ratio of calcium to phosphorus(Ca/P)was 1.55,close to normal ratio 1.49.Conclusion Rabbit BMSCs can be successfully transfected and labeled by Ad-GFP and trend to osteogenic differentiation after osteogenesis induction.BMSCs have a preferable osteogenic capability and the process of biological mineralization in vitro is the same with in vivo.
Key wordsadenovirus;green fluorescent protein;bone-marrow mesenchymal stem cells;scanning electron microscopy;spectrum analysis
作者簡介:寧寅寬,男,碩士研究生;李 強,男,教授,主任醫師,碩士生導師,責任作者,E-mail:li.q12251970@163.com
基金項目:國家自然科學基金資助項目(編號:31160199)
文獻標志碼A
文章編號1000-1492(2015)04-0415-04
中圖分類號R 687.34

