荔枝核總黃酮對活化大鼠肝星狀細胞的增殖抑制作用及TLR4表達的影響
董 勇,趙永忠,肖緒華,劉燕秀,李 彩,成秋宸
荔枝核總黃酮對活化大鼠肝星狀細胞的增殖抑制作用及TLR4表達的影響
董 勇,趙永忠,肖緒華,劉燕秀,李 彩,成秋宸
摘要目的 研究荔枝核總黃酮(TFL)在體外對活化的大鼠肝星狀細胞(HSC-T6)的增殖抑制作用及Toll樣受體4 (TLR4)表達的影響。方法 使用轉化生長因子β1(TGF-β1)(5 ng/ml)激活HSC-T6,顯微鏡下觀察HSC-T6和激活的HSC-T6形態變化;CCK8試劑盒(CCK8)法觀察TFL作用24、48、72 h后活化的HSC-T6的增殖情況;逆轉錄聚合酶鏈反應(RT-PCR)檢測HSC-T6中TLR4的表達;流式細胞術檢測細胞周期和細胞凋亡。結果 顯微鏡下觀察HSC-T6和激活的HSC-T6形態有明顯變化;CCK8結果顯示TFL可以抑制HSC-T6的增殖(P<0.05),并且隨著TFL濃度和作用時間增加,HSC-T6增殖明顯下降,呈濃度依賴性;RT-PCR結果顯示隨著TFL濃度增加,HSC-T6中TLR4表達下降,與實驗對照組比較差異有統計學意義(P<0.05);流式細胞儀檢測結果表明TFL阻滯細胞于S期,G0/G1期細胞減少(P<0.05),S期細胞增加(P<0.05),促進細胞的凋亡(P<0.05),呈濃度依賴性。結論 TFL可以抑制HSC-T6的增殖,其作用機制可能是通過降低TLR4在HSC-T6中的表達,阻滯其細胞增殖和誘導細胞凋亡,達到抗肝纖維化效果。
關鍵詞荔枝核總黃酮;肝星狀細胞;TLR4;細胞凋亡;流式細胞術
2015-01-12接收
作者單位:桂林醫學院附屬醫院消化內科,桂林 541001
肝星狀細胞(hepatic stellate cells,HSCs)是細胞外基質的主要來源,在肝纖維化形成中起關鍵性作用,HSCs通過分泌多種細胞因子影響并加速肝纖維化的進程[1]。近年來國內外圍繞以促進HSCs凋亡和膠原降解為靶標的抗肝纖維化研究成為熱點,為肝纖維化的防治尋找突破口。研究[2]表明Toll樣受體4(Toll-like receptors4,TLR4)/核因子-κB (nuclear factor-kappaB,NF-κB)信號通路為肝損傷時重要的肝細胞凋亡途徑之一。該實驗探討荔枝核總黃酮(total flavone of litchi chinensis sonn,TFL)在體外對活化的大鼠肝星狀細胞(HSC-T6)的增殖抑制作用及其機制,進一步探討肝纖維化的發生機制,同時為TFL應用于臨床治療肝纖維化提供實驗依據和理論基礎。
1 材料與方法
1.1 實驗材料和儀器 HSC-T6(中國科學院昆明動物研究細胞庫);TFL濃度為60%(南京澤郎生物有限公司);高糖型的DMEM液體培養基;含有EDTA的胰蛋白酶和無EDTA的胰蛋白酶(美國Gibco公司);胎牛血清(fetal bovine serum,FBS)(美國Hyclone公司);轉化生長因子β1(transforming growth factor-beta1,TGF-β1)(美國Peprotech公司);CCK8 (cell cunting Kit-8)購自中國碧云天生物技術研究所;逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)反應體系:總RNA提取試劑盒、cDNA第一鏈合成試劑盒及擴增試劑盒(中國天根生物有限公司);Markers(北京康為生物科技有限公司);流式凋亡試劑盒(北京四正柏生物科技有限公司);流式周期試劑盒(碘化吡啶、RNA酶);梯度PCR儀(德國Sigma公司);倒置相差顯微鏡(德國蔡司)酶標儀;MLDEL680(美國伯樂公司);流式細胞儀(美國BD公司產品);TLR4及β-actin引物由美國Invitrogen公司設計合成。
1.2 實驗分組 2 μgTGF-β1溶解于10 μl pH=3.0濃度為10 mmol/L的檸檬酸,配成0.2 mg/ml的TGF-β1母液;稱取60 mgTFL溶解于1 ml(100 μl DMSO+900 μl 10%FBS的培養基)溶液中,配成1 ml的80 mg/ml的TFL母液,然后稀釋成實驗需要的不同濃度的藥物樣品的培養基,將細胞分為7組:①空白對照組:10%FBS的DMEM培養基;②實驗對照組:10%FBS的DMEM培養基+5 ng/ml TGF-β1;③TFL80組:10%FBS的DMEM培養基+5 ng/ml TGF-β1+80 μg/ml TFL;④TFL160組:10%FBS 的DMEM培養基+5 ng/ml TGF-β1+160 μg/ml TFL;⑤TFL320組:10%FBS的DMEM培養基+5 ng/ml TGF-β1+320 μg/ml TFL;⑥TFL640組:10% FBS的DMEM培養基+5 ng/ml TGF-β1+640 μg/
ml TFL;⑦TFL800組:10%FBS的DMEM培養基+5 ng/ml TGF-β1+800 μg/ml TFL。
1.3 細胞培養 HSC-T6在5%CO2、37℃恒溫培養箱中培養,常規貼壁細胞培養,用體積分數為10%的FBS、質量濃度均為100 μg/ml的青霉素、鏈霉素的高糖培養基,2 d傳代1次。
1.4 CCK-8法檢測TFL對活化的HSC-T6增殖抑制率 將處于對數生長期的HSC-T6消化傳代,計數并調整細胞數為2.5×104/ml密度接種于3塊96孔板,每孔100 μl。細胞貼壁后換無血清培養基培養,24 h后換成含有不同濃度TFL的培養基繼續培養,每個濃度5個復孔,分別培養24、48、72 h后每孔加10 μl的CCK-8溶液。恒溫箱培養45 min,酶標儀于450 nm處檢測吸光度(absorbance,A),計算細胞相對增殖抑制率,分析不同時間不同濃度的TFL對細胞增殖的影響程度。
1.5 RT-PCR檢測HSC-T6中TLR4的表達 按照前述方法不同濃度樣品干預培養細胞分組,培養細胞48 h。TLR4(上游引物:5′-TGCCTGAGACCAGGAAGCTTG-3′,下游引物:5′-CTTAAGATCTTCAGG GGGTTG-3′),擴增片段長度為152 bp;β-actin(上游引物:5′-AGGTGACAGCAGTCGGTTGG-3′,下游引物:5′-CGAAGGCTCATCATTCAAAA-3′),擴增片段長度為300 bp。TLR4及β-actin引物的退火溫度均為55℃,34個循環。總RNA的提取、逆轉錄、PCR均按說明書操作。取5 μl的PCR產物,1.5%的瓊脂糖凝膠進行電泳鈍化分離,凝膠成像分析儀下觀察拍照,并應用SensiAnsys凝膠圖像分析系統進行分析。
1.6 AnneXin V-7AAD/PE雙染色法檢測細胞凋亡 按照前述方法不同濃度樣品干預培養細胞分組,培養細胞48 h,用不含EDTA的胰酶消化細胞,1 500 r/min離心10 min,收集細胞,棄上清液;PBS沖洗1次,1 500 r/min離心10 min,棄上清液,加入200 μl的緩沖液重選細胞;避光加入10 μl的AnneXin V-7AAD,室溫避光孵育15 min,上機前加5 μl 的PE,補加300 μl的PBS緩沖液,混勻,流式細胞儀檢測,MAfit LT3.3分析軟件分析細胞凋亡率。
1.7 流式細胞儀檢測細胞周期 細胞藥物處理方法如上,用0.02%的胰酶消化細胞,制備細胞懸液,2 000 r/min離心10 min,棄上清液,PBS沖洗2次,棄上清液,加1 ml PBS懸浮細胞,在振蕩器上緩慢加入3 ml的冰無水乙醇,4℃冰箱過夜保存固定細胞。次日,2 000 r/min離心10 min,PBS沖洗1次,每個樣本加入500 μl體積分數為50 μg/ml的PI,100 μg/ml RNAse,重懸細胞,37℃避光孵育30 min,上機檢測分析。
1.8 統計學處理 采用SPSS 13.0軟件進行統計學分析,計量資料以±s表示。多樣本間比較用單因素方差分析,兩組間比較采用LSD t檢驗,檢驗水準以α=0.05。
2 結果
2.1 HSC-T6與其形態學變化 正常HSC-T6與被TGF-β1誘導后活化的HSC-T6常規培養,顯微鏡下觀察,形態有明顯差異。HSC-T6分散生長,而被TGF-β1激活的HSC-T6島狀聚簇生長。見圖1。
2.2 TFL抑制HSC-T6的增殖 隨著TFL濃度和作用時間增加,HSC-T6增殖明顯下降且具有量效關系。TFL組A值與實驗對照組比較差異有統計學意義(P<0.05),見表1。
表1 各組HSC-T6的A值(±s)
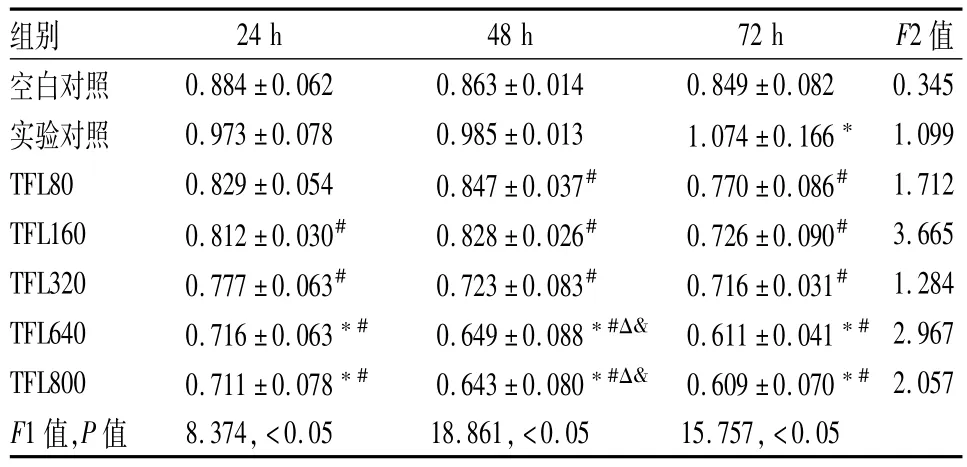
表1 各組HSC-T6的A值(±s)
F1:同一時間點組間A值比較;F2:組內不同時間點A值比較;與空白對照組比較:*P<0.05;與實驗對照組比較:#P<0.05;與TFL80組比較:ΔP<0.05;與TFL160組比較:&P<0.05
組別 24 h 48 h 72 h F2值空白對照<0.05 0.884±0.062 0.863±0.014 0.849±0.082 0.345實驗對照 0.973±0.078 0.985±0.013 1.074±0.166* 1.099 TFL80 0.829±0.054 0.847±0.037# 0.770±0.086# 1.712 TFL160 0.812±0.030# 0.828±0.026# 0.726±0.090# 3.665 TFL320 0.777±0.063# 0.723±0.083# 0.716±0.031# 1.284 TFL640 0.716±0.063*# 0.649±0.088*#Δ& 0.611±0.041*#2.967 TFL800 0.711±0.078*# 0.643±0.080*#Δ& 0.609±0.070*#2.057 F1值,P值 8.374,<0.05 18.861,<0.05 15.757,
2.3 TFL抑制HSC-T6中TLR4的表達 RT-PCR檢測結果顯示與實驗對照組相比,空白對照組中TLR4的表達有明顯差別,TLR4/β-actin比值差異有統計學意義(P=0.000);TFL組隨著培養液中TFL濃度增加,HSC-T6中TLR4的表達有明顯趨勢,
TLR4/β-actin比值差異有統計學意義(F=146.081,P=0.000)。見圖2、3。
2.4 TFL對HSC-T6凋亡和周期的影響 流式細胞儀檢測結果顯示TFL阻滯細胞于S期,G0/G1期細胞減少(P<0.05),S期細胞增加(P<0.05),促進細胞的凋亡(P<0.05),具有濃度依賴性。見表2、3,圖4、5。
表2 各組細胞的凋亡率(%,±s)

表2 各組細胞的凋亡率(%,±s)
F:同一時間點組間細胞總凋亡率比較;與空白對照組比較:*P<0.05;與實驗對照組比較:#P<0.05;與TFL80組比較:ΔP<0.05;與TFL160組比較:&P<0.05;與TFL320組比較:οP<0.05;與TFL640組比較:¤P<0.05
組別 早期凋亡率 晚期凋亡率 細胞總凋亡率空白對照4.13±0.31 4.17±0.40 8.30±0.70實驗對照 1.47±0.35 3.80±0.40 5.27±0.75 TFL80 9.30±0.35*# 5.50±0.50 14.80±0.61*#TFL160 14.80±0.26*#Δ 12.97±0.15*#Δ 27.77±0.31*#ΔTFL320 19.73±1.17*#Δ& 11.17±0.76*#Δ 30.90±1.01*#ΔTFL640 32.10±2.46*#Δ&ο 19.83±1.46*#Δ&ο 51.93±3.26*#Δ&οTFL800 36.23±1.62*#Δ&ο¤ 23.17±1.04*#Δ&ο¤ 59.40±2.65*#Δ&ο¤F值,P值 360.318,<0.05 284.748,<0.05 457.936,<0.05
表3 各組細胞的周期百分比(%,±s)
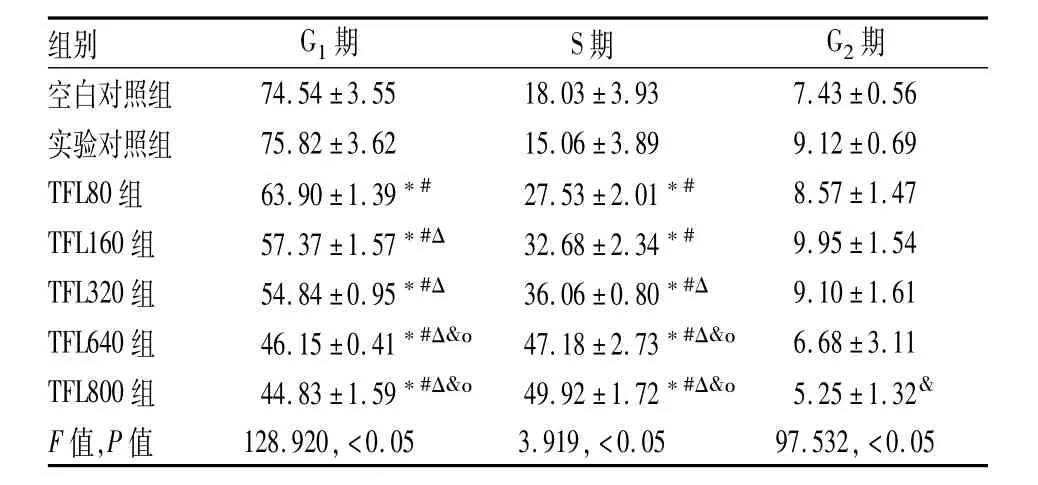
表3 各組細胞的周期百分比(%,±s)
F:同一時間點組間細胞作用時期比較;與空白對照組比較:*P<0.05;與實驗對照組比較:#P <0.05;與TFL80組比較:ΔP<0.05;與TFL160組比較:&P<0.05;與TFL320組比較:οP<0.05
組別 G1期 S期 G2期空白對照組74.54±3.55 18.03±3.93 7.43±0.56實驗對照組 75.82±3.62 15.06±3.89 9.12±0.69 TFL80組 63.90±1.39*# 27.53±2.01*# 8.57±1.47 TFL160組 57.37±1.57*#Δ 32.68±2.34*# 9.95±1.54 TFL320組 54.84±0.95*#Δ 36.06±0.80*#Δ 9.10±1.61 TFL640組 46.15±0.41*#Δ&ο 47.18±2.73*#Δ&ο 6.68±3.11 TFL800組 44.83±1.59*#Δ&ο 49.92±1.72*#Δ&ο 5.25±1.32&F值,P值 128.920,<0.05 3.919,<0.05 97.532,<0.05
3 討論
肝纖維化的形成是一個極為復雜的生理病理過程,牽涉到致病機體反應、細胞因子、反應靶細胞、細胞產物過量表達、抑制因素、降解酶等多種因素的作用。目前的研究[3-4]證實HSCs的激活,轉化為肌成纖維細胞并分泌細胞外基質是肝纖維化發生、發展的核心環節。而研究[5]表明HSCs的激活與內毒素有關,脂多糖可能直接激活HSCs,與其表面的TLR4結合并進而激活NF-κB和JNK信號通路,誘導炎性細胞因子和黏附分子的表達,從而促使了纖維化的形成[6]。Paik et al[7]發現活化的HSCs表達TLR4和其輔助受體髓樣分化蛋白2和CD14。研究[8-9]顯示,TLR4可上調各類趨化因子(單核趨化蛋白1、巨噬細胞炎癥蛋白1α、庫普弗細胞、巨噬細胞炎癥蛋白1β、調節正常T細胞表達和分泌因子、巨噬細胞炎癥蛋白2、干擾素誘導蛋白10)和TLR2的表達,而通過接頭蛋白髓樣細胞分化因子途徑和NF-κB途徑下調靜止的HSCs的TGF-β仿真受體Bambi (BMP and the activin memebrane-bound inhibitor)來增加TGF-β介導的HSC活化及其膠原的產生,促進肝纖維化。研究[10-11]證明TLR4和NF-κB可以在膽管阻塞型大鼠肝組織內高表達,大劑量TFL可以通過抑制大鼠組織TLR4和NF-κB的表達,改善膽管阻塞型肝大鼠纖維化程度。HSC-T6是否高表達TLR4以及TLR4對HSC-T6的生物學活性有什么影響尚需進一步研究。
研究[7]證明來活化的HSCs中TLR4表達水平很低,不表達髓樣分化蛋白2和CD14;活化的HSCs 中TLR4、髓樣分化蛋白2和CD14表達明顯增加。本實驗將活化的HSC-T6作為靶點,采用不同時間不同濃度的TFL作用于HSC-T6。RT-PCR結果顯示HSC-T6在mRNA水平上可以表達TLR4,隨著藥物濃度增加,TLR4的表達降低,呈濃度依賴性。進一步觀察TLR4與HSC-T6增殖和凋亡的關系,CCK8及流式細胞術檢測顯示TFL阻滯細胞于S期即DNA合成期,促進細胞的凋亡,降低TLR4的表達可以促進HSC-T6的凋亡[12-13]。實驗證明TFL通過降低TLR4在HSC-T6中的表達,阻滯細胞增殖和誘導細胞凋亡,達到抗肝纖維化效果。
從白樺樹中提取的BA通過抑制TLR4/MyD88/NF-κB信號通路,有顯著的抗纖維化作用[14]。MyD88抑制劑ST2825治療肝纖維化也有較好的療效[15]。隨著對TLR4更深入的研究,其通路將成為抗纖維化治療的新的突破點。TFL作為此信號傳導藥物研究的一個熱點,其抗肝纖維化具有顯著療效[10-11,16-18]。但是其對人類HSCs的增殖是否有抑制作用及具有抗纖維化效果,尚需進一步研究。
參考文獻
[1] Pinzani M.Unraveling the spider web of hepatic stellate cell apoptosis[J].Gastroenterology,2009,136(7):2061-3.
[2] Sahin H,Borkham-Kamphorst E,do O N T,et al.Proapoptotic effects of the chemokine CXCL10 are mediated by the noncognate receptor TLR4 in hepatocytes[J].Hepatology,2013,57(2):797 -805.
[3] Sato M,Suzuki S,Senoo H.Hepatic stellate cells:unique characteristics in cell biology and phenotype[J].Cell Struct Funct,2003,28(2):105-12.
[4] Hegazy S K,El-Bedewy M,Yagi A.Antifibrotic effect of aloe vera in viral infection-induced hepatic periportal fibrosis[J].World J Gastroenterol,2012,18(17):2026-34.
[5] Spruss A,Kanuri G,Wagnerberger S,et al.Toll-like receptor 4 is involved in the development of fructose-induced hepatic steatosis in mice[J].Hepatology,2009,50(4):1094-104.
[6] Connolly M K,Bedrosian A S,Mallen-St Clair J,et al.In liver fibrosis,dendritic cells govern hepatic inflammation in mice via TNF-alpha[J].J Clin Invest,2009,119(11):3213-25.
[7] Paik Y H,Schwabe R F,Bataller R,et al.Toll-like receptor 4 mediates inflammatory signaling by bacterial lipopolysaccharide in human hepatic stellate cells[J].Hepatology,2003,37(5):1043-55.
[8] Seki E,De Minicis S,Osterreicher C H,et al.TLR4 enhances TGF-beta signaling and hepatic fibrosis[J].Nat Med,2007,13 (11):1324-32.
[9] Teratani T,Tomita K,Suzuki T,et al.A high-cholesterol diet exacerbates liver fibrosis in mice via accumulation of free cholesterol in hepatic stellate cells[J].Gastroenterology,2012,142(1):152 -64.
[10]何志國,趙永忠,盧 青,等.荔枝核總黃酮對肝纖維化大鼠肝組織TLR4/NF-κB信號通路的影響[J].醫藥導報,2014,33(3):286-90.
[11]何志國,趙永忠,盧 青,等.荔枝核總黃酮對肝纖維化大鼠肝組織Toll樣受體2、4表達的影響[J].廣東醫學雜志,2013,34 (19):2926-30.
[12]白 婷,楊 勇,吳艷玲,等.百里香醌通過抑制TLR4信號通路介導的炎性反應抗肝纖維化作用研究(英文)[J].中華中醫藥雜志,2013,28(5):1541-7.
[13]朱曉靜,張 峰,孔德松,等.脂多糖/Toll樣受體4信號轉導與肝纖維化的研究進展[J].中國藥理學與毒理學雜志,2013,27 (1):106-9.
[14]Wan Y,Wu Y L,Lian L H,et al.The anti-fibrotic effect of betulinic acid is mediated through the inhibition of NF-κB nuclear protein translocation[J].Chem Biol Interact,2012,195(3):215-23.
[15]Loiarro M,Capolunghi F,Fantò N,et al.Pivotal advance:inhibition of MyD88 dimerization and recruitment of IRAK1 and IRAK4 by a novel peptidomimetic compound[J].J Leukoc Biol,2007,82 (4):801-10.
[16]趙永忠,漆志平,徐 慶,等.荔枝核總黃酮抗膽管結扎大鼠肝纖維化的作用及機制[J].世界華人消化雜志,2010,18(20):2084-9.
[17]孫旭銳,覃 浩,羅偉生,等.荔枝核總黃酮對大鼠肝星狀細胞增殖的抑制作用[J].廣東醫學,2012,33(15):2215-7.
[18]羅偉生,靳雅玲,歐士鈺,等.荔枝核總黃酮對肝纖維化大鼠肝細胞Bcl-2/Bax表達的影響[J].世界華人消化雜志,2012,20 (18):1602-8.
The total flavone of litchi chinensis sonn inhibits the proliferation of actived hepatic stellate cells via the TLR4 pathway in rats
Dong Yong,Zhao Yongzhong,Xiao Xuhua,et al
(The Affiliated Hospital of Guilin Medical University,Guilin 541001)
AbstractObjective To investigate the anti-proliferative effect of total flavone of litchi chinensis sonn(TFL)on the activated hepatic stellate cells(HSC-T6)in vitro and the influence on Toll-like receptors 4(TLR4).Methods HSC-T6 were activated with TGF-β(5 ng/ml)and then divided into the following groups:blank control,experimental control,five experimental groups.Different morphological changes of HSC-T6 and HSC-T6 were observed under the microscope.CCK8 was used to observe the proliferation of three kinds of the activated HSC-T6 which had been respectively affected by TFL for 24,48 and 72 h.The expressions of TRL4 were detected by RT-PCR(for mRNA).The cell cycle and cell apoptosis were detected by flow cytometry(FCM).Results There were obvious morphological changes of HSC-T6 and HSC-T6 under the microscope.The results of CCK8 showed that TFL could inhibit the proliferation of HSC-T6(P<0.01),and HSC-T6 decreased significantly with the increase of the concentration and action time of TFL.It could be found in the results of RT-PCR that expressions of TLR4 of HSC-T6 declined with the increase of TFL concentration.There were visible differences compared with the experimental control(P<0.01).The test of FCM showed that TFL retarded the cells during PeriA S,G0/G1cells reduce(P<0.01)and then promoted the apoptosis of cells(P<0.01).So it depended on the concentration of TFL.Conclusion TFL can inhibit the proliferation of HSC-T6,whose mechanism is to inhibit the proliferation of cells and induce the cell apoptosis by reducing the expressions of TLR4 in HSC-T6,so as to have the effect of anti-liver fibrosis.
Key wordstotal flavone of litchi chinensis sonn;hepatic stellate cells;Toll-like receptors 4;cell apoptosis;flow cytometry
作者簡介:董 勇,男,碩士研究生;趙永忠,男,教授,主任醫師,碩士生導師,責任作者,E-mail:13607736670@163.com
基金項目:國家自然科學基金(編號:81360659);廣西自然科學基金(編號:2012GXNSFAA053105)
文獻標志碼A
文章編號1000-1492(2015)04-0432-05
中圖分類號R 575

