荔枝古樹胚性愈傷組織LcCu/Zn-SOD3基因啟動子的克隆及功能驗證
練從龍,盧秉國,賴鐘雄,馮 新,林玉玲,陳裕坤,張梓浩
(福建農林大學 園藝植物生物工程研究所,福州 350002)
?
荔枝古樹胚性愈傷組織LcCu/Zn-SOD3基因啟動子的克隆及功能驗證
練從龍,盧秉國,賴鐘雄*,馮新,林玉玲,陳裕坤,張梓浩
(福建農林大學 園藝植物生物工程研究所,福州 350002)
摘要:以荔枝古樹“宋荔”胚性愈傷組織為材料,采用接頭染色體步移法,分離獲得LcCu/Zn-SOD3啟動子片段長度為1 426 bp,命名為ProLcCSD3(GenBank登錄號:KF672186.1)。生物信息學分析表明,該啟動子含有多個逆境應答元件、激素應答元件、胚乳特異表達元件,且可能受WRKY和MYB等轉錄因子調控。通過雙酶切方法,以ProLcCSD3替換載體pCAMBIA1301上的CaMv35S啟動子,構建了重組質粒p1301-proLcCSD3-GUS,并成功轉化農桿菌EHA105和GV3101。注射煙草的瞬時表達分析表明,該啟動子片段可以驅動下游報告基因表達。轉化擬南芥分析表明,該啟動子驅動的下游GUS可以在擬南芥的根、莖、葉中表達,且可響應NaCl、PEG-6000、ABA、MeJA和損傷等非生物脅迫。研究表明,荔枝古樹LcCu/Zn-SOD3可能參與多種非生物脅迫應答和激素信號轉導途徑。
關鍵詞:荔枝古樹;胚性愈傷組織;Cu/Zn-SOD3;啟動子;功能驗證
荔枝(LitchichinensisSonn.)屬無患子科(Sapindaceae)荔枝屬(Litchi),是熱帶亞熱帶地區風光的代表性樹種,也是重要的經濟樹種。古樹被譽為“活化石”,具有較高的觀賞、經濟、文化價值,同時也是一座優良種源基因庫[1]。‘宋荔’作為荔枝古樹的代表性品種,位于福州西禪寺,歷經千年,可能是國內最高齡的古荔之一[2]。‘宋荔’憑借頑強的生命力經歷4次枯榮到目前仍長勢良好,且每年仍可結出沉甸甸的果實,其強大的生命力可算是生命的奇跡[3]。體現了其自身強大的環境適應能力,也代表著荔枝整個生命的長期演化過程。超氧化物歧化酶(SOD)抗性基因作為抗氧化系統的第一道防線,具有防御氧毒性、清除體內氧自由基等作用,在植物抗氧化、抗逆等方面起著關鍵的作用[4],可能在維持“宋荔”整個生長過程中活性氧的代謝平衡,防止其衰老而歷經千年中起重要作用。
啟動子作為基因表達的重要調控元件,是轉錄的調控中心,指導著RNA聚合酶與DNA模板的正確結合,并通過活化RNA聚合酶,募集相應的轉錄因子形成特異性的轉錄起始復合體,進而決定轉錄的方向和效率[5];同時,啟動子作為精確調控基因表達的“開關”,直接控制著下游基因的表達,其含有的順式元件也直接反映了該基因的生物學功能。因此,通過對SOD基因啟動子進行研究,分析其調控元件,可為SOD基因的研究奠定一定的基礎。許珊珊[6]對‘宋荔’SOD基因的克隆與表達進行了較為全面的研究。因此,本試驗在此基礎上,采用接頭染色體步移法分離獲得荔枝古樹SOD基因家族LcCu/Zn-SOD3基因的啟動子,并通過轉化煙草和擬南芥對其功能進行初步驗證分析,為進一步深入研究SOD在荔枝古樹中的時空表達特性、生物學功能以及抗逆轉基因研究奠定基礎。
1材料和方法
1.1供試材料
‘宋荔’胚性愈傷組織,采自福州西禪寺‘宋荔’的花藥誘導而成,由福建農林大學園藝植物生物工程研究所保存。
1.2方法
1.2.1荔枝基因組DNA的提取及檢測采用改良CTAB法[7]提取‘宋荔’基因組DNA,并經1.0%瓊脂糖凝膠電泳和紫外分光光度計檢測。
1.2.2荔枝LcCu/Zn-SOD3啟動子的克隆及測序利用接頭染色體步移法對荔枝LcCu/Zn-SOD3啟動子進行克隆。參照Genome WalkingTMUniversal kit(Clonetech)試劑盒說明進行操作,步驟如下:首先,對檢驗合格的荔枝基因組DNA分別進行DraⅠ、EcoRⅤ、PvuⅡ和StuⅠ 4種平末端限制酶酶切并純化;然后,將荔枝基因組DNA的4種酶切產物分別與試劑盒中的Genome WalkerTMAdaptors連接構建4種Genome Walker文庫;最后,以構建好的4種文庫為模板,在LcCu/Zn-SOD3基因組序列(KF672186)靠近5端處設計的兩條反向互補引物分別與接頭引物AP1、AP2引物配對,進行兩輪的巢式PCR。PCR體系及two-step cycle程序詳見Genome WalkingTMUniversal kit(Clonetech)說明書。其中所用引物有AP1、AP2、LcCSD3-GSP1和LcCSD3-GSP2(表1)。
1.2.3目的片段的回收、TA克隆與測序將PCR擴增產物進行瓊脂糖(1.0%)電泳檢測,割膠回收目的片段。將目的片段克隆至pMD18-T載體,轉化大腸桿菌DH5a并進行培養。最后,PCR菌檢后挑取陽性克隆,送華大基因公司測序。
1.2.4荔枝LcCu/Zn-SOD3啟動子的序列分析首先,利用Neural Network Promoter Prediction(http://www.fruitfly.org/seq_tools/pro moter.html)在線軟件分析該啟動子可能的核心啟動子區域及轉錄起始位點;其次,使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)并結合PLACE(http://www.dna.affrc.go.jp/PLACE/signalup.html)在線軟件分析該啟動子序列潛在的順式作用元件。

表1 啟動子克隆及載體構建引物
1.2.5荔枝LcCu/Zn-SOD3啟動子瞬時表達載體的構建首先,克隆帶酶切位點的目的片段BamHⅠ-proLcCSD3-NcoⅠ。在啟動子上游引物引入BamHⅠ(5′-GGATCC-3′)酶切位點,下游引入NcoⅠ(5′-CCATGG-3′)酶切位點,所設計引物見表1的proLcCSD3-F和proLcCSD3-R。以含有該啟動子序列的質粒為模板,利用高保真酶KOD-Plus-Neo(Code:KOD041)進行PCR,獲得目的片段后割膠回收,測序正確后,將該回收產物命名為BamHⅠ- proLcCSD3-NcoⅠ。
其次,構建p1301-proLcCSD3-GUS重組質粒。利用Thermo公司的FastDigestBamHⅠ和FastDigestNcoⅠ雙酶切pCAMBIA1301和回收產物BamHⅠ-proLcCSD3-NcoⅠ,并分別回收pCAMBIA1301的大片段和BamHⅠ-proLcCSD3-NcoⅠ酶切的目的片段。將回收的兩條片段進行連接,并轉化大腸桿菌,菌液鑒定,提取該重組質粒,并進行雙酶切和特異引物PCR的雙重鑒定,將構建成功質粒命名為p1301-proLcCSD3-GUS。
最后,將重組質粒p1301-proLcCSD3-GUS轉化農桿菌EHA105和GV3101。取5 μL重組質粒于100 μL的農桿菌中,充分混勻,通過凍融法轉化農桿菌[8],并進行菌檢。
1.2.6荔枝LcCu/Zn-SOD3啟動子轉化煙草的瞬時表達鑒定以不攜帶任何載體的空菌株EHA105為陰性對照、CaMV35S啟動子驅動GUS基因的pCAMBIA1301的EHA105菌株為陽性對照,和攜帶目的質粒的陽性EHA105分別通過注射法注入煙草葉片[9],3 d后用打孔器取下煙草葉片的注射部位進行GUS組織化學染色[10]鑒定。
1.2.7荔枝LcCu/Zn-SOD3啟動子轉化擬南芥的功能鑒定以Columbia野生型擬南芥植株為陰性對照,以CaMV35S啟動子驅動GUS基因的pCAMBIA1301的GV3101菌株為陽性對照和攜帶目的質粒的陽性GV3101分別通過花絮浸染法轉化擬南芥[11]。即將待轉化的農桿菌GV3101單菌落于含str+kan各100 mg/L的50 mL YEB中,28 ℃、250 r/min振蕩培養;離心,收集菌體,重懸于5% 蔗糖懸浮液中,懸浮液濃度調至OD600為0.8左右;選取花蕾期的擬南芥,將花蕾浸泡到重懸液中數秒;培養室下黑暗保濕培養1 d,之后正常光照生長,直至開花收種。
1.2.8T1代轉基因擬南芥篩選將存放在4 ℃冰箱的T0代擬南芥種子先采用75%的乙醇處理1 min,后用10%的NaClO處理10 min,期間不斷振蕩,最后用無菌水漂洗種子數次進行消毒。將消毒后的種子平鋪在含有潮霉素的MS固體培養基上,4 ℃春化2 d后移至培養箱中正常光照萌發。待長出2片真葉后,將植株移至營養土中正常光照生長。
1.2.9轉基因擬南芥GUS組織化學染色分析和DNA水平檢測選取部分經潮霉素篩選的轉化植株,于GUS 染色液中過夜染色后,加入75% 乙醇70 ℃水浴脫色至無色后,觀察拍照[10]。之后,每種轉基因株系分別隨機選取經GUS染色驗證成功的8株植株,進行DNA水平的鑒定,即提取植物總DNA,采用相應啟動子的載體構建引物進行目的片段的PCR驗證。
1.2.10轉基因擬南芥不同株系脅迫處理選取經GUS染色和DNA水平鑒定轉化成功的轉ProLcCSD3擬南芥株系,待其蓮座葉片完全展開而還未抽薹時,分別進行200 mmol/L NaCl、15% PEG-6000模擬干旱、100 μmol/L ABA、50 μmol/L MeJA和針刺葉片的損傷處理,分別在處理后的0、6和24 h取樣,同一單株的取樣根據擬南芥生長特點取大小、長勢相同的靠基部相對較大的葉片。其中NaCl和模擬干旱處理采用澆灌法,即在營養缽上分別注入等體積配置好的溶液;ABA和 MeJA處理采用葉片噴施,即在處理的葉面上均勻的噴灑配置好的液體,并以水噴灑處理為對照,覆蓋保鮮膜;損傷處理采用針刺造成葉片上等量的多個小孔傷害。最后,將采取的樣本進行GUS熒光定量活性分析[12]。
2結果與分析
2.1荔枝LcCu/Zn-SOD3啟動子的克隆
啟動子克隆結果表明,從限制性內切酶EcoRⅤ和StuⅠ酶切的文庫中,分別獲得長度約1 100 bp和1 500 bp的擴增條帶(圖1)。測序所得實際長度分別為1 062 bp和1 491 bp,DNAMEN軟件比對分析表明其為同一條序列。取1 491 bp長片段,經拼接和NCBI Blast比對顯示所得序列即為LcCu/Zn-SOD3的啟動子序列,命名為ProLcCSD3(GenBank登入號:KF672186)。因此,獲得LcCu/Zn-SOD3啟動子長度為1 426 bp。
2.2荔枝LcCu/Zn-SOD3基因啟動子的序列結構分析
Neural Network Promoter Prediction預測表明,該啟動子可能存在的核心啟動子區域有3處,分值分別為0.88、0.85和0.80,分別位于第-782~-733 bp、-418~-369 bp和-93~-44 bp之間(將起始密碼子ATG中的A定義為位+1),而可能的轉錄起始位點為T和A。PlantCARE順式元件分析表明(圖2),該序列存在大量的調控元件,其中核心元件TATA-Box和CAAT-Box最為豐富,此外,還存在多個光響應元件Box 4、Box I、I-box、Sp1 和3-AF1 binding site;激素應答元件CE3、GARE-motif和TCA-element;胚乳表達響應元件Skn-1_motif和GCN4_motif;環境脅迫中的厭氧誘導響應元件ARE和GC-motif、熱壓響應元件HSE、防御與脅迫響應元件TC-rich repeat、干旱誘導響應元件MBS和晝夜節律元件circadian;以及一些功能未知的相關元件。其中MBS元件為干旱誘導下的MYB結合位點。此外,PLACE軟件分析表明該啟動子還存在WBOX和WRKY71OS元件。

圖1 荔枝LcCu/Zn-SOD3基因啟動子
2.3荔枝LcCu/Zn-SOD3基因啟動子載體構建
重組質粒雙酶切和目的序列的PCR雙重鑒定分析(圖3)表明,所切下的小片段及特異引物PCR所得條帶與目地啟動子長度一致,說明p1301-pro-LcCSD3-GUS重組質粒構建成功。重組質粒p1301-proLcCSD3-GUS轉化農桿菌EHA105和GV3101的PCR檢測均得到與該啟動子大小一致的條帶,說明p1301-proLcCSD3-GUS重組質粒已分別成功地轉化農桿菌EHA105和GV3101,可用于后續試驗。

圖2 PlantCARE預測LcCu/Zn-SOD3

圖3 p1301-proLcCSD3-GUS載體構建凝膠成像圖
2.4荔枝LcCu/Zn-SOD3啟動子轉化煙草的功能鑒定
GUS組織化學染色如圖4所示,陰性對照的葉片未能染色,而注射目的啟動子ProLcCSD3和陽性對照的CaMv35S驅動GUS的葉片均染成藍色,但ProLcCSD3驅動下的染色程度不及CaMv35S啟動子。該結果表明ProLcCSD3啟動子具有驅動下游GUS基因表達能力,即具有啟動子活性,但其活性不及CaMv35S啟動子。
2.5荔枝LcCu/Zn-SOD3啟動子轉化擬南芥T1代篩選及鑒定
潮霉素篩選結果表明:轉化成功的擬南芥小苗根系生長良好且植株長勢相對較強。擬南芥小苗GUS組織化學染色分析(圖5)顯示,ProLcCSD3驅動的GUS在轉基因擬南芥的根、莖和葉中均有表達。進一步DNA水平上的PCR鑒定結果(圖6)表明,隨機選取的8株轉基因擬南芥株系均為陽性植株。
2.6荔枝LcCu/Zn-SOD3啟動子響應非生物脅迫分析
轉基因擬南芥植株在不同非生物脅迫處理下的
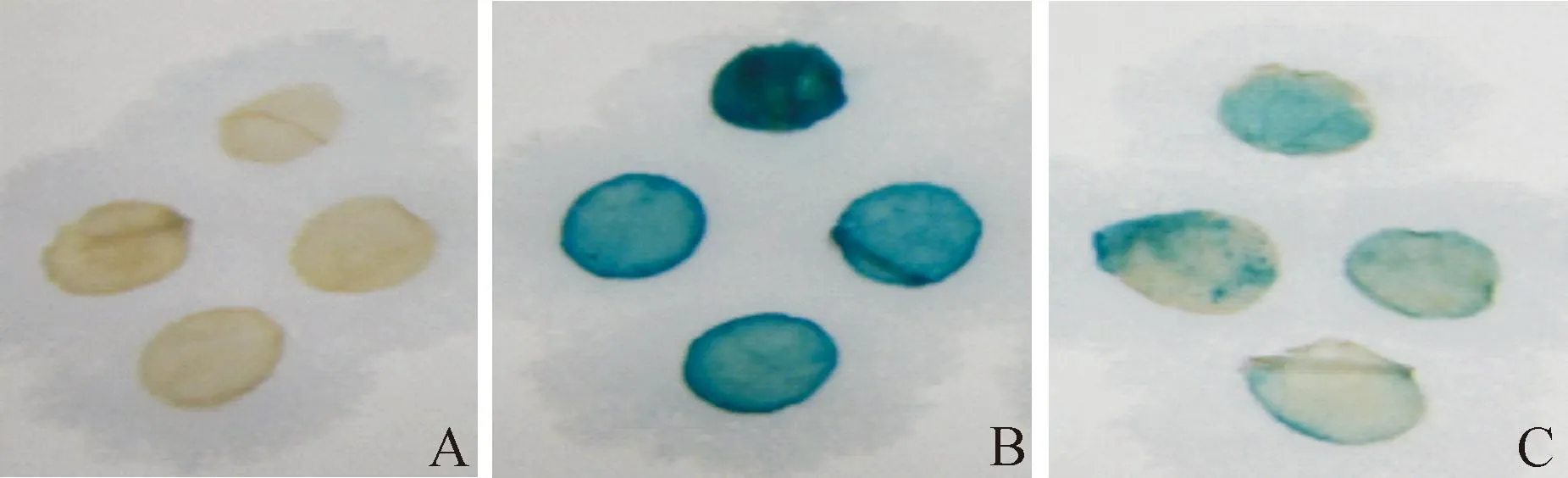
圖4 組織化學染色法檢測GUS酶活性
GUS熒光活性變化分析如圖7。首先,從圖中可看出在水處理下,其GUS活性變化不顯著,因此,可排除ABA和MeJA處理時水成分的影響。分析轉ProLcCSD3株系在各非生物脅迫下GUS活性變化,表明LcCu/Zn-SOD3啟動子可響應NaCl、PEG-6000、ABA、MeJA和損傷等非生物脅迫。其中在NaCl、PEG-6000和ABA處理6 h時其GUS活性即顯著升高,可達到未處理的1.7~3.2倍,而在24h時均又下降;MeJA和損傷脅迫處理6 h時其活性變化不明顯,而在處理24 h時其GUS活性顯著升高,約為未處理的2~3倍,且兩者的表達模式相近。

圖6 轉基因擬南芥株系DNA水平驗證

圖7 轉基因擬南芥不同脅迫處理下GUS活性分析

圖5 轉基因擬南芥植株的GUS組織化學染色

圖8 轉基因擬南芥不同株系GUS活性差異分析
此外,進一步分析(圖8)發現,不同的轉基因株系葉片中的GUS活性差異較大,表明在轉ProLcCSD3的擬南芥不同株系中,其ProLcCSD3驅動下游GUS的活性存在差異,這可能是該啟動子插入擬南芥基因組中的位置不同所致。
3討論
3.1荔枝古樹胚性愈傷組織LcCu/Zn-SOD3參與環境脅迫的調控
荔枝胚性愈傷組織LcCu/Zn-SOD3啟動子的轉錄活性受不同環境因素的誘導。順式元件預測分析表明該啟動子含有光、熱壓、厭氧、防御與脅迫、干旱和晝夜節律等響應元件,說明該啟動子可能響應光、熱、厭氧、干旱和晝夜等的誘導。本研究對轉LcCu/Zn-SOD3啟動子的擬南芥植株進行NaCl、PEG-6000和損傷脅迫的結果驗證了該啟動子對鹽、干旱和損傷逆境下的響應。這與以往NaCl、干旱等逆境脅迫均誘導Cu/Zn-SOD基因表達的研究相符[13-14]。因此,該研究表明LcCu/Zn-SOD3啟動子在逆境脅迫下,可通過響應相應的逆境順式元件調控其下游基因的表達,從而調整植株對逆境的耐受能力。
3.2荔枝古樹胚性愈傷組織LcCu/Zn-SOD3參與激素脅迫調控
荔枝胚性愈傷組織LcCu/Zn-SOD3啟動子響應外源激素脅迫。PlantCARE順式元件分析表明,該啟動子含有參與ABA、赤霉素和水楊酸應答元件。表明該啟動子在上述激素信號轉導中可能發揮了一定作用。Mundy等[15]指出一些基因的表達可能是外源激素直接作為反式作用因子與這些調控元件結合來調控的。ABA[16]、赤霉素[17]和水楊酸[18]等均在植物的抗旱、抗鹽、抗低溫等逆境方面起到一定調控作用。其中,茉莉酸甲酯作為一種揮發性化合物,可以從植物的氣孔進入植物體內,在細胞質中被酯酶水解為茉莉酸,實現長距離的信號傳導和植物間的交流,誘導鄰近植物產生誘導防御反應[19],并可以產生與機械損傷和昆蟲取食相似的效果[20]。同樣,在本研究對轉LcCu/Zn-SOD3啟動子的擬南芥植株進行ABA和MeJA脅迫的結果驗證了該啟動子對ABA和MeJA激素的響應。因此,該研究也表明該啟動子在外源激素脅迫下,可通過響應相應的激素順式元件調控LcCu/Zn-SOD3基因的表達。
綜上,本研究主要通過對LcCu/Zn-SOD3啟動子進行克隆和功能分析,即在啟動子研究的水平初步鑒定了LcCu/Zn-SOD3基因功能,為進一步對該基因的轉基因抗逆性研究奠定一定的基礎。此外,MBS、WBOX和WRKY71OS等順式元件的存在,暗示荔枝胚性愈傷組織LcCu/Zn-SOD3基因的調控可能還受MYB和WRKY轉錄因子的調控。其中,MYB轉錄因子作為植物轉錄因子中最大的家族之一,參與植物對非生物脅迫的響應[21],尤其在干旱脅迫下,大部分MYB轉錄因子均與ABA相關,且MYB轉錄因子對ABA的調控存在誘導型、介導型和依賴型三種方式[22]。本試驗所得的啟動子中,也正含有一個干旱誘導的MBS元件和ABA響應的CE3元件,那么該兩個元件是否也協同作用以及作用的方式有待進一步研究。WRKY轉錄因子能夠與W-box發生特異性作用,調節啟動子中含有W-box元件的基因表達[23],從而參與各種防御反應,調節植物的生長發育等[24]。同時,以往的研究也表明WRKY轉錄因子還受外源激素如水楊酸[25]、赤霉素[26]、脫落酸[27]和茉莉酸甲酯[28]等脅迫。因此,以上的前人研究成果也為進一步深入研究該啟動子的功能及上游調控因子的調控方式等提供新的思路。
參考文獻:
[1]LAI ZH X(賴鐘雄),LI H L(李煥苓).The evaluation and utilization of the ancient and famous trees genes resources[J].LandGreening(國土綠化),2007,(5):6-7(in Chinese).
[2]HU SH M(胡善美).The ancient litchi trees in the Xichan temple of Fuzhou[J].FujianGeography(福建地理),2000,15(4):35-38(in Chinese).
[3]劉楓.福州市寺廟園林研究[D].福州:福建農林大學,2008.
[4]BUBLIY O,LOESCHCKE V.Correlated responses to selection for stress resistance and longevity in a laboratory population ofDrosophilamelanogaster[J].JournalofEvolutionaryBiology,2005,18(4):789-803.
[5]孫乃恩,孫東旭,朱德煦.分子遺傳學[M].南京:南京大學出版社,1999.
[6]許珊珊.福州荔枝古樹離體種質保存及抗性基因SOD的克隆與表達[D].福州:福建農林大學,2012.
[7]DING X D(丁曉東),Lü L X(呂柳新).Study on genomic DNA extraction from recalcitrant litichi[J].ChineseJournalAppliedEnvironmentaiBiology(應用與環境生物學報),2000,6(2):142-145(in Chinese).
[8]WANG X Q(王學全),SHEN X(沈曉),HE Z M(何贊綿),etal.An optimized freeze-thaw for transformation ofAgrobacteriumtumefaciensEHA105 and LBA4404[J].PharmaceuticalBiotechnology(藥物生物技術),2011,18(5):382-386(in Chinese).
[9]LI Y(黎茵),ZHANG Y SH(張以順).Study onAgrobacteriumtumefaciens-mediated transient transformation of tobacco by infiltration[J].ExperimentalTechnologyandManagement(實驗技術與管理),2010,27(11):50-52(in Chinese).
[10]JEFFERSON R A,KAVANAGH T A,BEVAN M W.GUS fusions:β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].TheEMBOJournal,1987,6(13):3 901-3 907.
[11]BENT A.Arabidopsisthalianafloral dip transformation method[M].Agrobacterium Protocols.Humana Press,2006:87-104.
[12]JEFFERSON R A.Assaying chimeric genes in plants:theGUSgene fusion system[J].PlantMolecularBiologyReporter,1987,5(4):387-405.
[13]WANG SH(王盛),ZHANG B Q(張保青),HUANG X(黃杏),etal.Molecular cloning of sugarcaneCu/ZnSuperoxidedismutase(Cu/Zn-SOD) and its expression analysis[J].ScientiaAgriculturaSinica(中國農業科學),2013,46(15):3 277-3 284(in Chinese).
[14]ZANG J(臧潔),YU M(余梅),WANG X L(王先磊),etal.Cloning and salt-tolerance analysis of theSalicorniaeuropaeageneCu/Zn-SOD[J].JournalofAgriculturalBiotechnology(農業生物技術學報),2013,21(7):847-854(in Chinese).
[15]MUNDY J,YAMAGUCHI-SHINOZAKI K,CHUA N H.Nuclear proteins bind conserved elements in the abscisic acid-responsive promoter of a rice rab gene[J].ProceedingsoftheNationalAcademyofSciences,1990,87(4):1 406-1 410.
[16]NAMBARA E,KUCHITSU K.Opening a new era of ABA research[J].JournalofPlantResearch,2011,124(4):431-435.
[17]SHADDAD M A K,HM A E S,MOSTSFA D.Role of gibberellic acid(GA3) in improving salt stress tolerance of two wheat cultivars[J].InternationalJournalofPlantPhysiologyandBiochemistry,2013,5(4):50-57.
[18]MENG X J(孟雪嬌),DI K(邸昆),DING G H(丁國華).Progress of study on the physiological role of salicylic acid in plant[J].ChineseAgriculturalScienceBulletin(中國農學通報),2010,26(15):207-214(in Chinese).
[19]FARMER E E,RYAN C A.Interplant communication:airborne methyl jasmonate induces synthesis of proteinase inhibitors in plant leaves[J].ProceedingsoftheNationalAcademyofSciences,1990,87(19):7 713-7 716.
[20]XU W(徐偉),YAN SH CH(嚴善春).The function of jasmonic acid in induced plant defence[J].ActaEcologicaSinica(生態學報),2005,25(08):2 074-2 082(in Chinese).
[21]LIAO Y,ZOU H F,WANG H W,etal.SoybeanGmMYB76,GmMYB92,andGmMYB177 genes confer stress tolerance in transgenicArabidopsisplants[J].CellResearch,2008,18(10):1 047-1 060.
[22]ZUO R(左然),XU M L(徐美玲),CHAI G H(柴國華),etal.Function and regulation mechanism of plant MYB transcription factors[J].ChineseBulletinofLifeSciences(生命科學),2012,24(10):1 133-1 140(in Chinese).
[23]TIAN Y(田云),LU X Y(盧向陽),PENG L SH(彭麗莎),etal.The structure and function of plant WRKY transcription factors[J].Hereditas(遺傳),2006,28(12):1 607-1 612(in Chinese).
[24]李玥.3個玉米WRKY轉錄因子基因的表達模式分析[D].四川成都:四川農業大學,2012.
[25]DONG J,CHEN C,CHEN Z.Expression profiles of theArabidopsisWRKYgene superfamily during plant defense response[J].PlantMolecularBiology,2003,51(1):21-37.
[26]ZHANG Z L,XIE Z,ZOU X,etal.A riceWRKYgene encodes a transcriptional repressor of the gibberellin signaling pathway in aleurone cells[J].PlantPhysiology,2004,134(4):1 500-1 513.
[27]XIE Z,ZHANG Z L,ZOU X,etal.Annotations and functional analyses of the riceWRKYgene superfamily reveal positive and negative regulators of abscisic acid signaling in aleurone cells[J].PlantPhysiology,2005,137(1):176-189.
[28]PENG X X(彭喜旭),HU Y J(胡耀軍),etal.Isolation and expression profiles of rice WRKY30 induced by jasmonic acid application and fungal pathogen infection[J].ScientiaAgricultureSinica(中國農業科學),2011,44(12):2 454-2 461(in Chinese).
(編輯:宋亞珍)
Cloning and Functional Analysis ofLcCu/Zn-SOD3 Promoter
from Embryogenic Callus of the Ancient Litchi Tree
LIAN Conglong,LU Bingguo,LAI Zhongxiong*,FENG Xin,
LIN Yuling,CHEN Yukun,ZHANG Zihao
(Institute of Horticultural Biotechnology,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
Abstract:In this experiment,the 1 426 bp promoter fragment ofLcCu/Zn-SOD3 from embryogenic callus of the ancient litchi tree ‘Songli’ which namedProLcCSD3(GenBank:KF672186.1) was cloned by means of adapter chromosome walking method.The bioinformatics analysis showed that ProLcCSD3 contains a number of environmental stress response elements,hormone response elements,endosperm expression elements and also might be regulation by MYB and WRKY transcription factors.A novel plant expression vector p1301-proLcCSD3-GUS was constructed with ProLcCSD3 replace 35S promoter in the pCAMBIA1301 vector by using the double-digested method and then transferred intoAgrobacteriumstrain EHA105 and GV3101.Furthermore,transformation analysis showed that ProLcCSD3 has promoter activity by the infection of tobacco leaves and could drive the downstream reporterGUSgene expression in the roots,stems and leaves byAgrobacterium-mediated transformation ofArabidopsis.And stress treatments showed that ProLcCSD3 could response to some abiotic stresses,such as NaCl,PEG-6000,ABA,MeJA and wounding.Our results demonstrated thatLcCu/Zn-SOD3 might response to abiotic stresses and participate in the signal transduction pathways of hormones in the ancient litchi tree.
Key words:the ancient litchi tree;embryogenic callus;Cu/Zn-SOD3;promoter;functional analysis
中圖分類號:Q785;Q786
文獻標志碼:A
作者簡介:練從龍(1988-),男,碩士,主要從事花卉與景觀園藝生物技術研究。E-mail:770379183@qq.com*通信作者:賴鐘雄,博士,研究員,博士生導師,主要從事園藝植物生物技術與遺傳資源。E-mail:laizx01@163.com
基金項目:福建省農業科技平臺(2008N2001);國家科技支持計劃項目(2007BAD07B01)
收稿日期:2014-08-07;修改稿收到日期:2014-11-09
文章編號:1000-4025(2015)01-0016-07
doi:10.7606/j.issn.1000-4025.2015.01.0016

