胡蘿卜低溫脅迫轉錄因子DcICE1基因克隆與非生物逆境響應分析
黃 瑩,徐志勝,王 楓,李夢瑤,馬 靜,熊愛生
(南京農業大學 作物遺傳與種質創新國家重點實驗室,園藝學院,農業部華東地區園藝作物生物學與種質創制重點實驗室,南京 210095)
?
胡蘿卜低溫脅迫轉錄因子DcICE1基因克隆與非生物逆境響應分析
黃瑩,徐志勝,王楓,李夢瑤,馬靜,熊愛生*
(南京農業大學 作物遺傳與種質創新國家重點實驗室,園藝學院,農業部華東地區園藝作物生物學與種質創制重點實驗室,南京 210095)
摘要:植物ICE1基因是調控CBF基因表達的上游調控因子,在植物抵抗逆境脅迫中具有重要的作用。該實驗以2個胡蘿卜品種 ‘黑田五寸’和‘君川紅’為實驗材料,分別克隆出DcICE1轉錄因子基因,并通過熒光定量PCR方法測定了4種不同逆境脅迫下(4 ℃低溫、38 ℃高溫、0.2 mol·L-1NaCl及200 g·L-1PEG)DcICE1基因的表達情況,探討DcICE1轉錄因子在植物抵抗非生物脅迫下的功能。序列分析顯示,該基因全長1 458 bp,編碼485個氨基酸。2個胡蘿卜品種的DcICE1基因在核苷酸水平上有2個位點的差異,分別為第139位的G/A和第475位的A/G,導致編碼的氨基酸在第47位的E/K和第159位的N/D差異,該差異可能與DcICE1轉錄因子在2個不同品種應對逆境脅迫下的響應不同有關。胡蘿卜DcICE1轉錄因子有一個保守的ICE1功能結構域。實時定量PCR檢測DcICE1基因在不同逆境脅迫下的響應表明,低溫(4 ℃)處理能明顯地誘導DcICE1基因的表達,但鹽(0.2 mol·L-1NaCl)和干旱(200 g·L-1PEG)處理下的誘導效果均不明顯。
關鍵詞:胡蘿卜;DcICE1轉錄因子;基因克隆;非生物脅迫;表達分析
低溫是一類重要的環境因子,在很大程度上影響著植物的生長、發育,并且會給植物造成不同程度的傷害,嚴重影響著植物的產量與品質[1-2]。低溫脅迫時,植物體內會發生許多生理生化和分子變化[3],包括細胞水平和基因水平[3-4]。因此,研究植物的抗寒性、探究植物的抗寒性機制,對提高植物的抗寒能力,提高農作物的產量和品質具有重要意義[5]。
在遭遇低溫脅迫時,植物體內與冷有關的基因表達會被激活,從而提高植物的抗寒性,這種現象稱為冷馴化,其中由冷脅迫誘導而表達的基因稱為冷誘導基因(cold regulated gene,COR)[6]。冷誘導基因是一類編碼調控性蛋白的基因,可調控相關抗寒基因的表達及相關抗寒蛋白的活性,如CBF/DREB、ICE基因[7]。ICE是在低溫脅迫下誘導CBF家族轉錄因子基因表達的轉錄激活因子,在低溫脅迫時能特定地結合CBF的啟動子序列,誘導CBF基因表達,而CBF基因同樣會誘導下游相關基因的表達,從而產生一系列適應低溫的變化,增強植物的抗寒性[8]。ICE1基因編碼的蛋白具有MYC轉錄因子家族特有的bHLH(堿性-螺旋-環-螺旋)DNA結合域,能夠與CBF3啟動子上的MYC順式作用元件結合,激活CBF3基因的表達,提高抗寒性[8]。目前已經從許多植物中發現了ICE基因,包括擬南芥[9]、赤桉[10]、小麥[11]、油菜[5]、蘿卜[7]、茶樹[12]、蘋果[13]、蝴蝶蘭[14]、菊花[15],并且獲得了轉ICE基因的擬南芥[9,16]、黃瓜[17]、檸檬[18]、水稻[19]、煙草[20]和馬鈴薯[21],轉基因植株抗寒性均有提高。
胡蘿卜(DaucuscarotaL.)屬于傘形科二年生草本植物,栽培面積非常廣泛,主要以肉質根做食用材料。其肉質根含有豐富的營養物質,如葡萄糖、胡蘿卜素、維生素等,在人們健康生活中發揮著重要的作用。胡蘿卜生長發育大致可以分為發芽期、幼苗期、蓮座葉生長期、肉質根膨大期以及抽薹開花期[22],且其生長發育需要一定的溫度條件,播苗期溫度太低,會影響出苗率以及幼苗生長;若在肉質根膨大期遭遇低溫,會使胡蘿卜提前經歷春化作用而抽薹開花,嚴重影響胡蘿卜的產量及品質[23-24]。近年來許多地區初春及秋冬季不乏極端天氣的出現,嚴重影響胡蘿卜的生長發育,給胡蘿卜生產帶來極大的損失。胡蘿卜品種有多種,根據肉質根形狀,可分為短圓錐形、長圓錐形和圓柱形三大類型,‘黑田五寸’和‘君川紅’ 2個品種所食用肉質根分別為圓錐、圓柱類型,‘黑田五寸’品種引自日本,屬中早熟品種,抗熱抗病性強,產量高;‘君川紅’品種屬早熟品種,抗病性強,抗寒、抗熱性好。‘黑田五寸’和‘君川紅’ 均有很高的商品性,是生產中常用的胡蘿卜栽培種。
近年來人們對ICE基因及其低溫調控機制比較關注,研究重點主要集中在擬南芥等模式植物中,且對除低溫脅迫外的其他非生物脅迫的研究也相對較少。本研究從胡蘿卜品種‘黑田五寸’及‘君川紅’中分別克隆了DcICE1基因,并對DcICE1基因進行了較為詳細的生物信息學分析,利用熒光定量PCR檢測其在38 ℃高溫、4 ℃低溫、0.2 mol·L-1NaCl、200 g·L-1PEG等脅迫處理不同時間段的表達情況,以了解胡蘿卜抗逆轉錄調控的作用機制,為通過遺傳方法提高作物抗逆性奠定基礎。
1材料和方法
1.1植物材料
植物材料胡蘿卜品種 ‘黑田五寸’和‘君川紅’于2014年03月份種植于南京農業大學作物遺傳與種質創新國家重點實驗室人工氣候室。待長至2月齡時,分別進行低溫(4 ℃)、高溫(38 ℃)、鹽(0.2 mol·L-1NaCl)、干旱(200 g·L-1PEG)處理,在處理的0、1、2、4、8和12 h分別取葉片樣品,按照RNA simple Total RNA Kit試劑盒(北京天根公司)說明書分別提取總RNA,并用PrimeScript RT reagent Kit(大連TaKaRa公司)將提取的總RNA反轉錄成cDNA,用于熒光定量PCR。
1.2胡蘿卜DcICE1基因克隆
基于本實驗室胡蘿卜轉錄組數據,拼接得到胡蘿卜DcICE1基因的序列,并設計1對引物,DcA13F(5′-CAAAATGCTCCCCACTTCCAACGGCG-3′)和DcA13R(5′-AGCTAAATTGCTCCATGAAAACCAG-C-3′)。分別以‘黑田五寸’和‘君川紅’未經處理的葉片的cDNA為模板進行擴增,PCR反應條件為:94 ℃預變性 5 min;94 ℃變性 30 s,54 ℃退火 30 s,72 ℃延伸 1 min 45 s,共35個循環;72 ℃延伸10 min。反應產物經質量濃度12 g/L瓊脂糖凝膠電泳分離,利用AxyPrep DNA凝膠回收試劑盒(美國Axygen公司)回收后,連接pMD19-T載體(大連TaKaRa公司)并轉化到大腸桿菌DH5α(由本實驗室保存),提取質粒經PCR鑒定后委托南京金斯瑞生物科技有限公司測序。
1.3胡蘿卜DcICE1基因序列分析
各植物相關基因和氨基酸序列均來自NCBI數據庫,多序列比對采用Clustal X軟件,用MEGA 5構建分子進化樹,生成報告圖形[25],蛋白質基本性質分析使用http://www.expasy.org網站相關軟件完成[26],利用DNAMAN軟件進行蛋白質疏水性/親水性分析。
1.4胡蘿卜DcICE1轉錄因子基因實時定量PCR表達分析
熒光定量 PCR(Quantitative real time RT-PCR)采用SYBR PremixExTaq試劑盒(大連TaKaRa公司),在iQTM5 Real-time PCR System完成,采用iQTM5 software進行分析,按照操作說明進行。相對定量使用參照基因的ΔΔCT法,表達差異等于2-ΔΔCT,ΔCT=CT目標基因-CTactin。相對定量是基于處理和對照之間,目標基因相對內參基因的表達量的比較[27]。以胡蘿卜Tubulin基因為參照基因,引物為DcA15F(5′-GAGTGGAGTTACCTGCTGCCTTC-3′)和DcA15R(5′-ATGTAGACGAGGGAACGGAATCAAG-3′)。用于DcICE1基因表達分析的引物為DcA14F(5′-GCTTCCATACTTGGCGATGCTAT-TG-3′)和DcA14R(5′-CTCTTGCCCTTACCTC-GACCCTTGC-3′)。
2結果與分析
2.1胡蘿卜DcICE1基因克隆
以胡蘿卜‘黑田五寸’和‘君川紅’未經處理葉片的cDNA為模板,以DcA13F和DcA13R為引物進行擴增,分別得到長約1 500 bp的擴增產物(圖1)。將回收產物分別進行連接、轉化、序列測定,獲得2個擴增產物序列。對胡蘿卜‘黑田五寸’和‘君川紅’擴增產物核苷酸序列推導的氨基酸序列進行BLAST檢索與比對,發現其均有ICE1轉錄因子所具有的保守功能域,且具有ICE1蛋白具有的bHLH(堿性-螺旋-環-螺旋)DNA結合域,屬于ICE1家族。序列測定與分析表明,‘黑田五寸’和‘君川紅’中的DcICE1基因(GenBank登錄號分別為KM487593和KM487594)均含有一個1 458 bp的開放閱讀框,編碼485個氨基酸,兩者在核苷酸水平上有2個堿基的差異,分別為第139位的G/A,第475位的A/G;氨基酸水平上有2個位點的差異,分別為第47位的E/K,第159位的N/D。對2個品種的DcICE1轉錄因子進行氨基酸親水性/疏水性分析,結果表明,胡蘿卜DcICE1轉錄因子中大部分氨基酸屬于親水性氨基酸(圖2)。
2.2胡蘿卜DcICE1轉錄因子氨基酸序列分析及理化性質分析
通過氨基酸序列檢索和比對得知,胡蘿卜ICE1轉錄因子與大白菜(Brassicapekinensis)、大豆(Glycinemax)、擬南芥(Arabidopsisthaliana)等的相似性均較高,且均具有bHLH保守區域及ICE1轉錄因子具有的功能域(圖3)。對上述植物的氨基酸組成成分及理化性質進行分析(表1),各植物的氨基酸殘基數在420~550之間不等,其理論相對分子質量在45~61 kD之間,堿性氨基酸比例高于酸性氨基酸比例,個別植物差異較明顯,脂肪族氨基酸、芳香族氨基酸的比例均有一定的差異,可能與其在非保守區域的氨基酸差異較大有關。

圖1 胡蘿卜DcICE1基因克隆圖譜

圖2 胡蘿卜DcICE1氨基酸序列疏水性(A)
2.3胡蘿卜DcICE1轉錄因子的進化分析
為了進一步分析胡蘿卜‘黑田五寸’和‘君川紅’中DcICE1轉錄因子與其他物種中相關蛋白的進化關系,選取了相似性較高的幾種植物進行進化分析。如圖4所示,胡蘿卜與大豆中的ICE轉錄因子屬于同一個分支,親緣關系較近;十字花科的油菜、大白菜、蘿卜、擬南芥同屬于一個分支,而葡萄科的葡萄、薔薇科的蘋果、茄科的番茄屬于不同的分支,說明同科的植物進化關系最近。

圖3 胡蘿卜DcICE1轉錄因子與其他物種氨基酸序列的多重比對
2.4胡蘿卜DcICE1基因在不同逆境處理下表達情況
為了分析DcICE1基因在胡蘿卜非生物脅迫中的響應情況,對胡蘿卜‘黑田五寸’和‘君川紅’2個品種進行了38 ℃高溫、4 ℃低溫、0.2 mol·L-1NaCl、200 g·L-1PEG不同時間段的處理。結果(圖5)表明,胡蘿卜DcICE1轉錄因子基因在4 ℃低溫處理時表達,‘黑田五寸’品種在2 h時表達量達到最高水平,是對照的2.3倍,而‘君川紅’品種在處理1 h后表達量稍增加,隨著處理時間的延長,表達量均有所下降;38 ℃高溫處理下,DcICE1基因在2個胡蘿卜品種中的表達量均較對照低,其中處理2 h和4 h,‘君川紅’和‘黑田五寸’的表達量又相對高于其他處理時間;0.2 mol·L-1NaCl處理時,2個品種DcICE1基因的表達量均下降;200 g·L-1PEG處理下,2個品種各個時間段的表達量同樣與對照相比,均有所下降,其中‘黑田五寸’在處理的各時間段表達量呈連續下降趨勢,而‘君川紅’各處理時間變化更加平緩。DcICE1轉錄因子基因在2個胡蘿卜品種中響應逆境的時間和強度不同,可能與2個品種本身抗逆性差異有關。

圖4 部分物種ICE轉錄因子氨基酸序列的系統進化樹
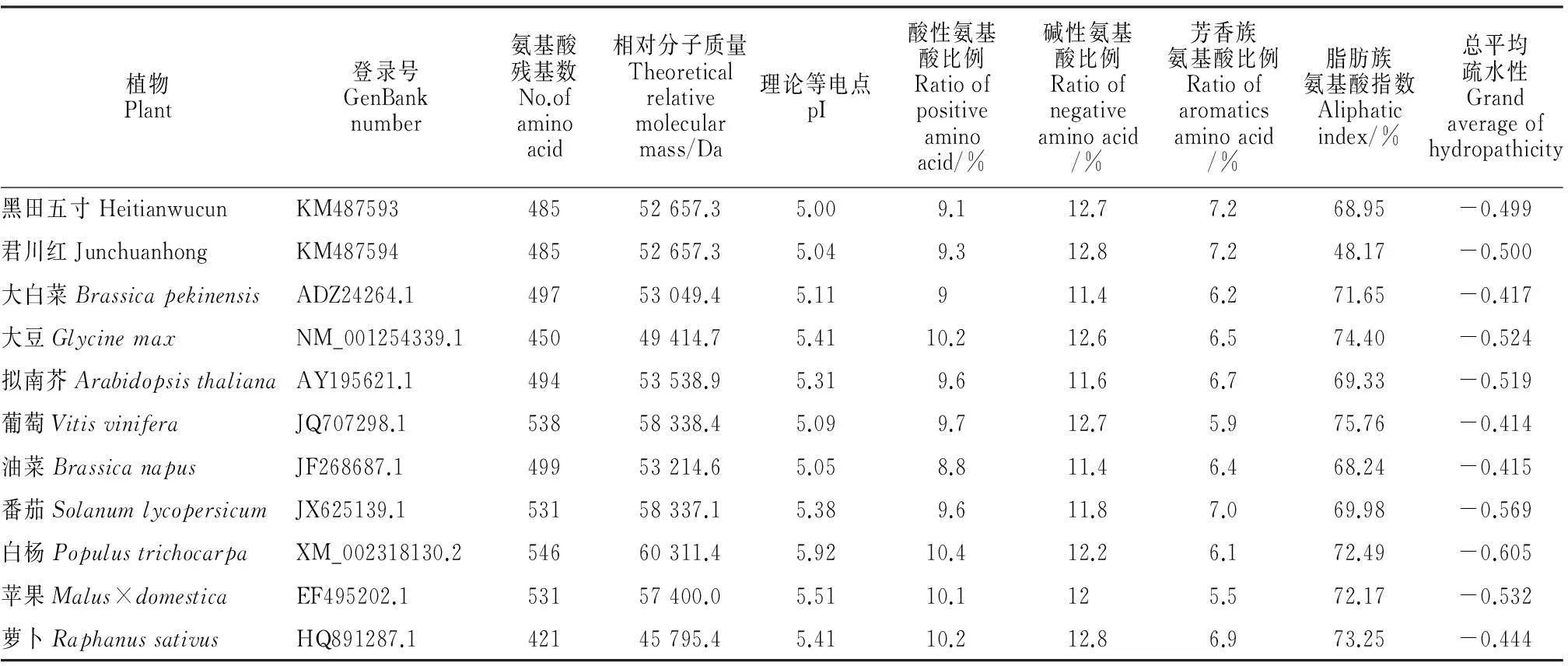
植物Plant登錄號GenBanknumber氨基酸殘基數No.ofaminoacid相對分子質量Theoreticalrelativemolecularmass/Da理論等電點pI酸性氨基酸比例Ratioofpositiveaminoacid/%堿性氨基酸比例Ratioofnegativeaminoacid/%芳香族氨基酸比例Ratioofaromaticsaminoacid/%脂肪族氨基酸指數Aliphaticindex/%總平均疏水性Grandaverageofhydropathicity黑田五寸HeitianwucunKM48759348552657.35.009.112.77.268.95-0.499君川紅JunchuanhongKM48759448552657.35.049.312.87.248.17-0.500大白菜BrassicapekinensisADZ24264.149753049.45.11911.46.271.65-0.417大豆GlycinemaxNM_001254339.145049414.75.4110.212.66.574.40-0.524擬南芥ArabidopsisthalianaAY195621.149453538.95.319.611.66.769.33-0.519葡萄VitisviniferaJQ707298.153858338.45.099.712.75.975.76-0.414油菜BrassicanapusJF268687.149953214.65.058.811.46.468.24-0.415番茄SolanumlycopersicumJX625139.153158337.15.389.611.87.069.98-0.569白楊PopulustrichocarpaXM_002318130.254660311.45.9210.412.26.172.49-0.605蘋果Malus×domesticaEF495202.153157400.05.5110.1125.572.17-0.532蘿卜RaphanussativusHQ891287.142145795.45.4110.212.86.973.25-0.444

圖5 胡蘿卜DcICE1基因在不同逆境處理下不同時間的表達情況
3討論
在植物生長發育過程中,會不斷受到各種非生物脅迫而嚴重影響作物的產量和品質[28-29],低溫就是一類重要的非生物影響因子。進一步深入了解植物抗寒機制對于農業生產有著重要的意義。胡蘿卜生產中,低溫會影響胡蘿卜的生長發育,也是制約胡蘿卜栽培區域的重要因素之一。
本實驗分別從‘黑田五寸’和‘君川紅’2個品種中克隆并分析了胡蘿卜DcICE1基因,發現有2個核苷酸位點差異,編碼氨基酸有2個位點差異。氨基酸序列及同源進化樹分析顯示,2個胡蘿卜品種中的DcICE1轉錄因子在氨基酸性質如氨基酸數目、酸堿氨基酸比例、等電點、疏水性/親水性等方面高度一致,但不同植物氨基酸理化性質有一定的差異,這可能與不同物種進化過程中的親緣關系有關[30]。傘形科胡蘿卜的DcICE1轉錄因子與蝶形花科大豆的ICE轉錄因子同屬一個分支,親緣關系較為密切。十字花科的大白菜、油菜、擬南芥及蘿卜的ICE轉錄因子屬于另外一個分支,而葡萄科的葡萄、薔薇科的蘋果、茄科的番茄分屬于不同的分支,這說明不同物種ICE轉錄因子的進化關系呈現明顯的種屬特性。
有研究表明,ICE1基因是CBF轉錄因子基因的正調控因子,在植物抵抗寒冷環境中發揮著重要的作用[8,15]。ICE1基因是一種誘發基因,即在正常條件下不啟動基因表達,當低溫脅迫時誘導CBF基因表達,進而啟動一系列相關基因表達,增強植物的抗寒性,在植物的生長發育中起著重要的作用[31]。本研究通過熒光定量PCR檢測胡蘿卜DcICE1基因在不同逆境不同時間段處理的表達情況,結果表明高溫及鹽脅迫不會引起DcICE1基因過量表達,而4 ℃低溫處理下2 h后胡蘿卜‘黑田五寸’DcICE1轉錄因子基因的表達量明顯增加,‘君川紅’1 h后表達量增加,這可能與不同胡蘿卜品種特性有關。
另外,高等植物的抵御非生物脅迫機制復雜,涉及到很多的生理生化過程,參與逆境調控的基因非常多[32]。本研究使用生產上常用的2個胡蘿卜品種,抗熱、抗病性能較強的‘黑田五寸’和抗寒、抗熱及抗病性強的‘君川紅’,2品種DcICE1轉錄因子基因在不同逆境處理下響應的時間和強度表現出較大的差異,這可能與2品種中DcICE1轉錄因子個別氨基酸位點差異有關,也可能與品種本身特性有關。另外,有研究表明,葡萄的VaICE1基因能被鹽誘導,為正調控,與本實驗結果有些差異,這可能與物種不同有關,也可能與植物生長的環境差異有關[33-34]。
參考文獻:
[1]ZHONG K Y(鐘克亞),YE M SH(葉妙水),HU X W(胡新文),etal.Role of the transcription factors CBF in plant cold tolerance[J].Hereditas(遺傳),2006,28(2):249-251(in Chinese).
[2]THOMASHOW M F.Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J].AnnualReviewofPlantBiology,1999,50(1):571-599.
[3]THOMASHOW M F.Arabidopsisthalianaas a model for studying mechanisms of plant cold tolerance[J].ColdSpringHarborMonographArchive,1994,27:807-834.
[4]VISWANATHAN C,ZHU J K.Molecular genetic analysis of cold-regulated gene transcription[J].PhilosophicalTransactionsoftheRoyalSocietyofLondon.SeriesB:BiologicalSciences,2002,357(1 423):877-886.
[5]ZHANG T G(張騰國),CHANG Y(常燕),WANG J(王娟),etal.Cloning and expression analysis of aBnICE1 fromBrassicanapusL.[J].ScientiaAgriculturaSinica(中國農業科學),2013,46(1):205-214(in Chinese).
[6]GUY C L,NIEMI K J,BRAMBL R.Altered gene expression during cold acclimation of spinach[J].ProceedingsoftheNationalAcademyofSciencesUSA,1985,82(11):3 673-3 677.
[7]XIANG D J(向殿軍),YIN K D(殷奎德),MAN L L(滿麗莉),etal.Cloning and genetic transformation of low temperature transcription factor fromRaphanussativus[J].ActaBot.Boreal.-Occident.Sin.(西北植物學報),2011,31(10):1 933-1 941(in Chinese).
[8]CHINNUSAMY V,OHTA M,KANRAR S,etal.ICE1:a regulator of cold-induced transcriptome and freezing tolerance inArabidopsis[J].Genes&Development,2003,17(8):1 043-1 054.
[9]ZARKA D G,VOGEL J T,COOK D,etal.Cold induction ofArabidopsisCBFgenes involves multiple ICE(inducer ofCBFexpression) promoter elements and a cold-regulatory circuit that is desensitized by low temperature[J].PlantPhysiology,2003,133(2):910-918.
[10]LIN Y ZH(林元震),GUO H(郭海),LIU CH X(劉純鑫),etal.Molecular cloning and expression analysis of cold-resistant transcription factor ICE1 fromEucalyptuscamaldulensisL.[J].PlantPhysiologyJournal(植物生理學報),2011,47(5):488-494(in Chinese).
[11]BADAWI M,REDDY Y V,AGHARBAOUI Z,etal.Structure and functional analysis of wheatICE(inducer ofCBFexpression) genes[J].PlantandCellPhysiology,2008,49(8):1 237-1 249.
[12]YIN Y(尹盈),ZHANG Y(張玥),HU J Y(胡靖妍),etal.Subcellular localization and expression analysis of CsICE transcription factor related to cold stress in tea plant[J].ActaHorticulturaeSinica(園藝學報),2013,40(10):1 961-1 968(in Chinese).
[13]FENG X M,ZHAO Q,ZHAO L L,etal.The cold-induced basic helix-loop-helix transcription factor geneMdCIbHLH1 encodes an ICE-like protein in apple[J].BMCPlantBiology,2012,12(1):22.
[14]PENGP H,LIN C H,TSAI H W,etal.Cold response inPhalaenopsisaphroditeand characterization ofPaCBF1 andPaICE1[J].PlantandCellPhysiology,2014,55(9):1 623-1 635.
[15]CHEN Y,JIANG J,SONG A,etal.Ambient temperature enhanced freezing tolerance ofChrysanthemumdichrumCdICE1Arabidopsisvia miR398[J].BMCBiology,2013,11(1):121.
[16]LEE B,HENDERSON D A,ZHU J K.TheArabidopsiscold-responsive transcriptome and its regulation byICE1[J].PlantCell,2005,17(11):3 155-3 175.
[17]LIU L,DUAN L,ZHANG J,etal.Cucumber(CucumissativusL.) over-expressing cold-induced transcriptome regulator ICE1 exhibits changed morphological characters and enhances chilling tolerance[J].ScientiaHorticulturae,2010,124(1):29-33.
[18]HUANG J Q,SUN Z H.Agrobacterium-mediated transfer ofArabidopsisICE1 gene into lemon(Citruslimon(L.) Burn.F.cv.Eureka)[J].AgriculturalSciencesinChina,2005,4(9):714-720.
[19]WANG B Y(王北艷),YIN K D(殷奎德).Expression ofrd29A-ICE1 gene in transgenic rice plants show increased tolerance to freezing stress[J].JournalofNuclearAgriculturalScience(核農學報),2013,27(6):731-735(in Chinese).
[20]FENG H L,MA N N,MENG X,etal.A novel tomato MYC-type ICE1-like transcription factor,SlICE1a,confers cold,osmotic and salt tolerance in transgenic tobacco[J].PlantPhysiologyandBiochemistry,2013,73:309-320.
[21]ZHANG N(張寧),SI H J(司懷軍),WANG D(王蒂).Cloning ofrd29Agene promoter fromArabidopsisthalianaand its application in stress-resistance transgenic potato[J].ActaAgronomicaSinica(作物學報),2005,31(2):159-164(in Chinese).
[22]RUBATZKY V E,QUIROS C F,SIMON P W.Carrots and related vegetable umbelliferae[M].New York:CABI Publish-ing,1999.
[23]MAO J H(毛笈華),MAO SH M(茅淑敏),ZHUANG F Y(莊飛云),etal.Heredity and environmental regulation of premature bolting in carrot[J].ActaAgriculturaeBoreali-Sinica(華北農學報),2013,28(3):67-72(in Chinese).
[24]章鎮.園藝學各論[M].北京:中國農業出版社,2004.
[25]TAMURA K,PETERSON D,PETERSON N,etal.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].MolecularBiologyandEvolution,2011,28(10):2 731-2 739.
[26]GASTEIGER E,GATTIKER A,HOOGLAND C,etal.ExPASy:the proteomics server for in-depth protein knowledge and analysis[J].NucleicAcidsResearch,2003,31(13):3 784-3 788.
[27]TAN G F(譚國飛),WANG F(王楓),etal.Isolation and expression analysisof cinnamic acid 4-hydroxylase gene under different temperatures inCryptotaeniajaponicaHassk[J].ActaBot.Boreal.-Occident.Sin.(西北植物學報),2014,34(7):1 298-1 304(in Chinese).
[28]WANG Y Q(王雅琴),SHI M(石淼),ZHANG X Y(張新宇),etal.Cloning and expression analysis ofGhMBY113 gene ingossypium hirsutum[J].ActaBot.Boreal.-Occident.Sin.(西北植物學報),2013,33(5):878-884(in Chinese).
[29]PEI L L(裴麗麗),GUO Y H(郭玉華),XU ZH SH(徐兆師),etal.Research progress on stress-related protein kinases in plants[J].ActaBot.Boreal.-Occident.Sin.(西北植物學報),2012,32(5):1 052-1 061(in Chinese).
[30]SOLTIS P S,SOLTIS D E.The origin and diversification of angiosperms[J].AmericanJournalofBotany,2004,91(10):1 614-1 626.
[31]GILMOURS J,ZARKA D G,STOCKINGER E J,etal.Low temperature regulation of theArabidopsisCBF family of AP2 transcriptional activators as an early step in cold-inducedCORgene expression[J].PlantJournal,1998,16(4):433-442.
[32]ZHUANG J,ZHANG J,HOU X L,etal.Transcriptomic,proteomic,metabolomic and functional genomic approaches for the study of abiotic stress in vegetable crops[J].CriticalReviewsinPlantSciences,2014,33(2-3):225-237.
[33]ZHOU M Q,SHEN C,WU L H,etal.CBF-dependent signaling pathway:a key responder to low temperature stress in plants[J].CriticalReviewsinBiotechnology,2011,31(2):186-192.
[34]HUANG G T,MA S L,BAI L P,etal.Signal transduction during cold,salt,and drought stresses in plants[J].MolecularBiologyReports,2012,39(2):969-987.
(編輯:宋亞珍)
Cloning and Expression Profiles Analysis under Abiotic Stresses of Cold
Stress Transcription Factor GeneDcICE1 fromDaucuscarota
HUANG Ying,XU Zhisheng,WANG Feng,LI Mengyao,MA Jing,XIONG Aisheng*
(State Key Laboratory of Crop Genetics and Germplasm Enhancement,Ministry of Agriculture Key Laboratory of Biology and Germplasm Enhancement of Horticultural Crops in East China,College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:In higher plant,ICE1 involved in the response to abiotic and biotic stresses by regulating the expression ofCBFgenes.The cDNA sequence of DcICE1 transcription factor was cloned from carrot cultivars ‘Heitianwucun’ and ‘Junchuanhong’ using RT-PCR method,respectively.In order to analyze the response ofDcICE1 gene to abiotic stress,the expression profiles ofDcICE1 gene in four different stresses(4 ℃,38 ℃,0.2 mol·L-1NaCl,200 g·L-1PEG) were detected by quantitative real-time PCR.Sequence analysis indicated that theDcICE1 gene contained 1 458 bp,encoding 485 amino acids.There were two nucleotide sites and two amino acid residue differences between two cultivars(G/A in site 139 and A/G in site 475;E/K in site 47,N/D in 159).The different amino acid residues may be involved into the different response in two carrot cultivars encountered the abiotic stresses.The DcICE1 transcription factor has a conserved domain.Quantitative real-time PCR detected the expression profiles ofDcICE1 gene under abiotic stresses.The results showed the expression ofDcICE1 gene significantly increased when exposed to 4 ℃,while the expression profiles ofDcICE1 gene was not obvious after treated by salt and PEG in the two carrot cultivars.
Key words:Daucuscarota;DcICE1 transcription factor;gene cloning;abiotic stress;expression analysis
中圖分類號:Q789
文獻標志碼:A
作者簡介:黃瑩(1990-),女,在讀碩士研究生,主要從事蔬菜分子生物學研究。E-mail:2013104056@njau.edu.cn*通信作者:熊愛生,教授,博士生導師,主要從事蔬菜分子生物學和遺傳育種研究。E-mail:xiongaisheng@njau.edu.cn
基金項目:教育部新世紀優秀人才支持計劃(NCET-11-0670);江蘇省杰出青年基金(BK20130027);中國博士后基金(2014M551609);江蘇高校優勢學科建設項目(2011PAPD);江蘇省雙創計劃(2011JSSC)
收稿日期:2014-07-08;修改稿收到日期:2014-10-11
文章編號:1000-4025(2015)01-0030-07
doi:10.7606/j.issn.1000-4025.2015.01.0030

