恩替卡韋聯合嗎替麥考酚酯治療乙型肝炎病毒相關性腎炎療效評價
袁飛遠
(四川省涼山彝族自治州第一人民醫院,四川 西昌 615000)
恩替卡韋聯合嗎替麥考酚酯治療乙型肝炎病毒相關性腎炎療效評價
袁飛遠
(四川省涼山彝族自治州第一人民醫院,四川 西昌 615000)
目的 探討恩替卡韋聯合嗎替麥考酚酯治療乙型肝炎病毒相關性腎炎(HBVGN)的臨床療效并評價其安全性。方法 選擇收治的HBVGN患者58例,隨機分為對照組和觀察組,各29例。對照組予恩替卡韋聯合醋酸潑尼松龍,觀察組予恩替卡韋聯合嗎替麥考酚酯。結果 對照組患者治療總有效率為89.65%,高于對照組的75.86%(P<0.05)。兩組患者 HBV-DNA水平較治療前均明顯下降(P<0.05),但組間未見顯著性差異(P>0.05)。治療后兩組患者24 h尿蛋白及血肌酐較前均有明顯下降,且觀察組下降程度較對照組明顯(P<0.05)。治療后兩組患者白蛋白較前明顯上升,而丙氨酸氨基轉移酶及天門冬酸氨基轉移酶較前明顯下降(P<0.05),而治療后兩組上述指標間未見明顯差異(P>0.05)。兩組患者藥品不良反應發生率間未見明顯差異(P>0.05)。結論 恩替卡韋聯合嗎替麥考酚酯治療HBVGN療效確切,且安全性良好。
恩替卡韋;嗎替麥考酚酯;乙型肝炎病毒相關性腎炎;臨床療效;安全性
乙型肝炎病毒(HBV)相關性腎炎(HBVGN)是HBV直接或間接侵入人體,產生大量乙型肝炎病毒表面抗原免疫復合物沉積并吸附在腎小球內而誘發的腎小球腎炎,是常見的繼發性腎小球疾病[1]。目前尚無有效的治療手段,臨床治療難度較大。現行的治療方案治療以抗病毒基礎上行免疫抑制治療為原則,以減少免疫復合物對腎小球的損害[2]。恩替卡韋是環戊酰鳥苷類似物,是目前抗HBV的一線用藥,具有抗病毒作用確切、耐藥率較低的特點[3]。嗎替麥考酚酯為免疫抑制劑,能特異性地抑制淋巴細胞嘌呤代謝途徑,因而具有強大的抑制淋巴細胞增殖的作用[4]。筆者觀察了恩替卡韋聯合嗎替麥考酚酯治療HBVGN的療效,現報道如下。
1 資料與方法
1.1 一般資料
選取我院2012年3月至2015年3月收治的HBVGN患者58例,納入標準[5]:有HBV感染的血清學證據,未作腎活檢者需具備HBeAg或HBeAb或HBcAb-IgM或HBV-DNA陽性;患腎小球腎炎并可除外狼瘡性腎炎等其他繼發性腎小球疾病;表現為腎病綜合征者必須腎活檢腎切片上找到HBV抗原。排除標準:合并肝硬化及肝癌;合并其他原因引起的腎小球損害;藥物過敏;妊娠期及哺乳期婦女。所有患者均簽署知情同意書,試驗內容經醫院醫學倫理委員會批準。將患者隨機分為對照組和觀察組,各29例。對照組中,男19例,女10例;年齡21~53歲,平均(42.53± 5.63)歲。觀察組中,男 21例,女 8例;年齡 22~61歲,平均(44.87±8.13)歲。兩組患者基線資料呈正態分布,經統計未見顯著性差異(P>0.05),具有可比性。
1.2 方法
兩組患者均給予常規對癥治療。對照組加用恩替卡韋片(中美上海施貴寶制藥有限公司,國藥準字H20052237,規格為每片0.5 mg)口服,每日1片,療程6個月;同時口服醋酸潑尼松片(新鄉市新輝藥業有限公司,國藥準字H41021534,規格為每片5 mg),每日以1 mg/kg劑量頓服,4~8周后開始減量,每周減為原劑量的1/5,直至停藥;口服激素期間,同時給予奧美拉唑腸溶片(上海信誼天平藥業有限公司,國藥準字 H19980124,規格為每片20 mg)口服,每日2次,每次1片,阿法骨化醇片(日本TEIJIN PHARMA LIMITED,注冊證號 H20100370,規格為每片 1.0 μg)每日1片。為預防激素副作用的藥物,與激素同用同停。觀察組口服恩替卡韋方法同對照組,同時聯合口服嗎替麥考酚酯膠囊(上海羅氏制藥有限公司,國藥準字 H20031240,規格為每粒0.25 g)1.0 g/d(體重<50 kg)或1.5 g/d(體重>50 kg),分2次空腹口服,療程為6個月。治療過程中定期監測肝腎功能。
1.3 觀察指標及療效評價
療效評價:顯效,臨床癥狀消失,尿常規正常或24 h尿蛋白定量正常(<0.3 g/d),腎功能穩定,血丙氨酸氨基轉移酶(ALT)、白蛋白正常,血清HBV-DNA轉陰;有效,臨床癥狀減輕,血白蛋白上升至32 g/L,尿蛋白減少或24 h尿蛋白定量較治療前下降>50%,血清HBV-DNA定量下降>2log10但未降至正常范圍;無效,臨床癥狀和實驗室檢查結果均無改善或加重者。前兩者合計為總有效。觀察指標:病毒活動指標HBV-DNA;24 h尿蛋白、血肌酐(Cr);白蛋白(ALB)、ALT、天門冬酸氨基轉移酶(AST);治療過程中藥品不良事件。
1.4 統計學處理
采用 SPSS 19.0統計學軟件分析。計量數據以均數 ±標準差(±s)表示,行 t檢驗;計數資料以百分比表示,行 χ2檢驗。P<0.05為差異有統計學意義。
2 結果
結果見表1和表2。治療過程中,對照組出現1例精神亢奮癥狀,2例糞便隱血陽性,不良反應發生率為10.34%。觀察組出現2例腹瀉癥狀,不良反應發生率為6.91%。上述患者經加強對癥處理后癥狀均明顯改善,無嚴重藥品不良反應發生。兩組患者藥品不良反應發生率間未見明顯差異(P>0.05)。

表1 兩組患者臨床療效比較[例(%),n=29]
表2 兩組患者臨床指標比較(±s)
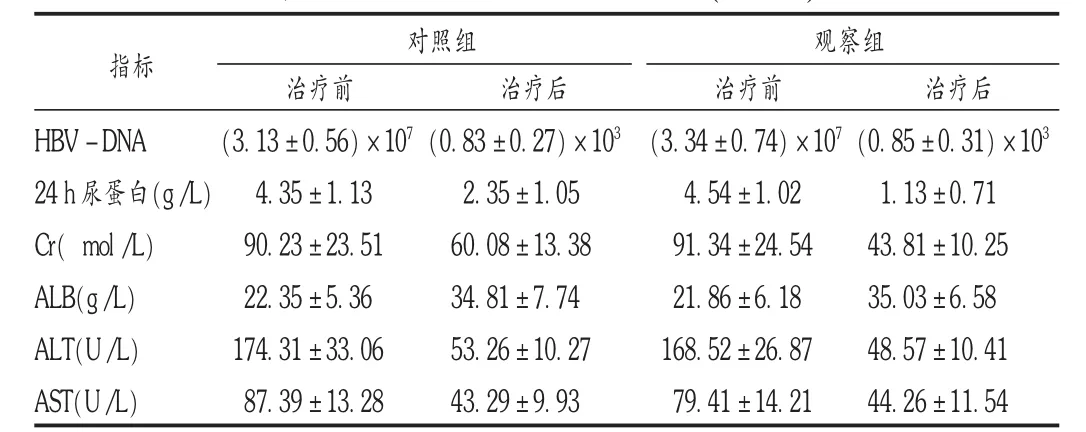
表2 兩組患者臨床指標比較(±s)
注:與本組治療前相比, P<0.05;與對照組治療后相比, P<0.05。
指標 對照組 觀察組HBV-DNA 24 h尿蛋白(g/L)Cr( mol/L)ALB(g/L)ALT(U/L)AST(U/L)治療前(3.13±0.56)×1074.35±1.13 90.23±23.51 22.35±5.36 174.31±33.06 87.39±13.28治療后(0.83±0.27)×1032.35±1.05 60.08±13.38 34.81±7.74 53.26±10.27 43.29±9.93治療前(3.34±0.74)×1074.54±1.02 91.34±24.54 21.86±6.18 168.52±26.87 79.41±14.21治療后(0.85±0.31)×1031.13±0.71 43.81±10.25 35.03±6.58 48.57±10.41 44.26±11.54
3 討論
在涼山彝族地區,HBV感染患者較多。HBVGN是臨床較常見的繼發性腎小球疾病,主要系HBV感染機體后,引起機體免疫反應,形成抗原抗體免疫復合物,包括原位免疫復合物及循環免疫復合物,兩者均可在腎小球毛細血管內皮下、系膜區及足細胞下沉積,引起腎臟固有細胞的損傷,繼而引起一系列的腎臟疾病[6-7]。
恩替卡韋具有極強的抗肝炎病毒能力,對病毒DNA復制的起始、逆轉錄負鏈及正鏈的延長均有作用。其半衰期為14~15 h,且長期應用耐藥的發生率極低(5年累計耐藥率為1.2%)[8]。與傳統拉米夫定等抗HBV藥物相比,恩替卡韋優勢明顯。在抑制免疫復合物沉積方面,以往有人試用糖皮質激素或環磷酰胺、硫唑嘌呤等藥物治療,但療效均不理想。多數學者指出,激素在治療過程中可延緩宿主對HBV的清除能力,HBV-DNA復制增多,有誘發HBV再激活或乙型肝炎復發的風險。而環磷酰胺和其他免疫抑制劑如硫唑嘌呤等具有較強肝毒性,患者常不能耐受[9]。
嗎替麥考酚酯是新型免疫抑制劑,在體內能快速水解為麥考酚酸(MPA),MPA主要通過可逆、非競爭性地抑制鳥嘌呤核苷酸經典合成途徑的關鍵限速酶,即次黃嘌呤核苷酸脫氫酶(MPDH),而對鳥嘌呤核苷酸合成的補救途徑無影響,故僅對淋巴細胞DNA和RNA的合成起到抑制作用,對其他細胞尤其是肝、骨髓細胞的影響甚微。此外,嗎替麥考酚酯具有良好的口服利用度,療效窗口寬且肝腎功能損害等不良反應較小,長期居家治療的患者易于接受[10]。與傳統免疫抑制劑相比,由于其免疫抑制強度稍弱,對HBVGN患者而言,在抑制免疫復合物沉積的同時,對HBV復燃的影響較小,因而聯合抗病毒治療對HBVGN患者尤為合適。
本研究結果顯示,觀察組治療總有效率較對照組明顯升高(P<0.05);兩組患者HBV-DNA較治療前均明顯下降(P<0.05),但組間未見顯著性差異(P>0.05),表明小劑量激素及嗎替麥考酚酯對HBV病毒的復制影響差異不明顯;治療后兩組患者24 h尿蛋白及Cr較前均明顯下降,且觀察組下降程度較對照組明顯(P<0.05),表明嗎替麥考酚酯清除免疫復合物能力較小劑量激素效果更佳;治療后兩組患者ALB較前明顯上升,ALT及AST較前明顯下降(P<0.05),而治療后兩組上述指標間未見明顯差異(P>0.05),表明嗎替麥考酚酯對患者肝功能影響程度有限,且兩組患者藥品不良反應發生率間未見明顯差異(P>0.05),表明安全性良好。
綜上所述,恩替卡韋聯合嗎替麥考酚酯治療HBVGN療效確切且安全性良好,具有一定的臨床推廣價值。但本組資料樣本量較小,抽樣誤差無法避免,擴大觀察樣本及進一步了解藥物間聯合作用是下一步研究方向。
[1]朱 楠,周 益,袁偉杰,等.乙型肝炎病毒相關性腎炎中Toll樣受體4沉積特點及其意義[J].中華內科雜志,2011,50(12):1 008-1 012.
[2]魏日胞,李 平,吳 杰,等.205例乙型肝炎病毒相關性腎炎的臨床及病理研究[J].中華實驗和臨床病毒學雜志,2010,24(6):464-467.
[3]姚光弼,張定鳳,王寶恩,等.恩替卡韋抗乙型肝炎病毒劑量和療效的研究[J].中華肝臟病雜志,2005,13(7):484-487.
[4]陸福明,丁小強,陳 楠,等.嗎替麥考酚酯治療原發性腎病綜合征的前瞻性多中心臨床研究[J].中華腎臟病雜志,2004,20(4):238-241.
[5]中華醫學會兒科學分會腎臟病學組.兒童常見腎臟疾病診治循證指南(試行)(五):兒童乙型肝炎病毒相關性腎炎診斷治療指南[J].中華兒科雜志,2010,48(8):592-595.
[6]蔣 偉,劉麗秋.血清乙肝病毒DNA載量對乙型肝炎病毒相關性腎炎病理變化的影響[J].中南大學學報:醫學版,2008,33(9):857-860.
[7]何 平,馮國和.乙型肝炎病毒相關性腎炎中病毒直接損傷腎組織作用機制研究現狀[J].中華傳染病雜志,2012,30(2):123-125.
[8]鄧中平.恩替卡韋治療乙型肝炎的療效及安全性[J].中國新藥與臨床雜志,2005,24(4):326-329.
[9]蔡建芳,竇曉麗,文煜冰,等.乙型肝炎病毒相關性腎炎的相關因素分析[J].中華腎臟病雜志,2011,27(2):96-99.
[10]許桂軍.嗎替麥考酚酯治療膜性腎病44例[J].中國藥業,2013,22(11):154-155.
The Clinical Curative Effect of Entecavir Combined with Mycophenolate Mofetil in Treating Hepatitis B Virus Associated Glomerulonephritis
Yuan Feiyuan
(The First People′s Hospital of Liangshan Yi Autonomous Prefecture,Xichang,Sichuan,China 615000)
Objective To investigate the clinical curative effect of entecavir combined with mycophenolate mofetil on hepatitis B virus associated glomerulonephritis.Methods 58 cases of patients diagnosed HBVGN were randomly divided in to the control group(n=29) and the observation group(n=29),the control group was given a grant for entecavir combined with prednisolone acetate,the observation group received entecavir combined with mycophenolate mofetil.Results The total effective rate was 89.65% in the observation group,which was significantly higher than 75.86% in the control group(P<0.05).The HBV-DNA of the two groups were significantly lower than before treatment(P<0.05),but there was no significant difference between the two groups(P>0.05).24 h urine protein and serum creatinine were significantly decreased in the two groups after treatment,and the observation group was significantly lower than that in the control group(P<0.05).After treatment,the ALB of the two groups were significantly higher than before,and ALT and AST were significantly decreased(P<0.05),but there was no significant difference between the two groups(P>0.05).There was no significant difference between the two groups in the incidence of adverse drug reactions(P>0.05).Conclusion The efficacy of Entecavir combined with mycophenolate mofetil in treating HBVGN is exact with good safety.
entecavir;mycophenolate mofetil;hepatitis B virus associated glomerulonephritis;clinical efficacy;safety
R969.4;R978.7;R979.5
A
1006-4931(2015)17-0033-02
2015-03-13)

