我院開展丹參多酚酸鹽等中藥注射劑上市后安全性再評價的實踐Δ
呂世文,郭佳奕,朱亞蘭(浙江大學金華醫院藥劑科,浙江金華 321000)
當前,我國中藥注射劑達1 000 余種[1],伴隨用量增多,其藥品不良反應/不良事件(ADR/ADE)迅速增加。據統計,2014年國家ADR 監測中心共收到中藥注射劑ADR/ADE 報告12.7萬例次,同比增長5.3%;其中嚴重報告占6.7%,同比增長26.0%[2]。近年來,因生產及質量控制等方面原因發生了多起中藥注射劑質量安全事件,如魚腥草、雙黃連、刺五加事件[3-5]等,使得中藥注射劑的安全性受到越來越廣泛的關注。而中藥注射劑的安全性監測與評價工作,一直作為我國上市后藥品風險管理的重點工作之一,也是醫藥工作者所面臨的重要課題之一[6]。為此,我院通過開展中藥注射劑上市后安全性再評價工作,探索再評價的研究思路、方法與實施方案,考察其在臨床使用中出現或可能出現的ADR/ADE,從而確保患者安全、合理用藥。
1 資料與方法
1.1 研究思路
構建科學、合理、可行的安全性再評價方法,變ADR/ADE被動監測為主動監測,探索醫療機構開展藥品上市后安全性再評價的方法。基于我院現狀,研究遵循以下思路:(1)充分利用現有的醫療資源,設計科學且切實可行的中藥注射劑安全性再評價方法;(2)利用醫院信息系統(HIS),如門診系統、住院患者電子病歷系統、嵌入HIS的合理用藥評價系統等,對上述方法進行補充與優化,使評價方法更便捷、客觀、全面;(3)針對被研究的藥品,重點觀察其ADR/ADE發生率、主要臨床表現、主要累及器官和發生ADR/ADE后的處理及主要影響因素等信息,以供臨床參考。
1.2 評價方法
采用隊列內病例-對照研究,觀察中藥注射劑在我院臨床中使用的安全性,如ADR/ADE發生率、主要臨床表現、主要影響因素等。
1.3 資料收集
將符合被研究藥物說明書適應證且無使用禁忌證的患者作為研究隊列,收集每個成員的基礎資料(患者的基本人口學資料、食物藥物過敏史、診斷疾病與原患疾病、原患疾病治療詳細過程及處理情況等)、相關暴露資料、協變量資料(被觀察藥物的用藥時間、劑量、用藥速度、配伍用藥、給藥途徑、合并用藥情況等)。
1.4 受試人群
1.4.1 病例組納入標準 對研究隊列進行隨訪,以確定在預定觀察期內所有發生中藥注射劑ADR/ADE的病例,將其作為研究的病例組。
1.4.2 對照組納入標準 采用危險集抽樣。在每個ADR/ADE 病例發病時,立即在隊列中選擇一定數量的到該病例發生ADR/ADE 時尚未發生ADR/ADE 的患者,按與病例組原患疾病相同(相似)、疾病嚴重程度相近、基本治療措施相同(相似)、性別相同、年齡相近(±5歲)、入院時間相近(±7 d)等進行匹配。每個病例可選擇1~10個匹配對照。
1.5 觀察周期及指標
1.5.1 觀察周期 觀察覆蓋整個用藥時間,終末觀察時間根據藥物的半衰期確定,至少超過6.6 個半衰期,以確保藥物在人體內已完全清除。從開始用藥即第一滴藥水進入人體開始就密切觀察30 min,觀察ADR/ADE 的發生情況;給藥30 min后護士每6 h觀察1次,并接受患者主動報告,患者出院后即停止主動觀察;患者出院后及觀察周期外,仍接受患者主動報告,但此時需注意ADR/ADE與藥物的關聯性,并加以記錄。
1.5.2 觀察指標 ①ADR/ADE 名稱和累及器官、系統;②ADR/ADE 開始、結束時間;③ADR/ADE 級別;④ADR/ADE的臨床表現、轉歸;⑤ADR/ADE的處理等。
1.6 評價工具及研究人員
以《中藥注射劑臨床安全性病例報告表》為評價工具,包括填表須知、患者基本信息、用藥信息、ADR/ADE信息和關聯性評價等部分。研究人員由主要研究者、臨床觀察員和評價人員組成。主要研究者由臨床藥學室人員承擔,參與項目設計;臨床觀察員由各涉藥科室護理人員組成,負責用藥觀察以及病例報告的填寫;評價人員由藥學人員組成,負責病例報告表的收集、整理、錄入及統計分析等。
1.7 ADR/ADE判定與研究技術路線
ADR/ADE 判定根據《ADR 報告和監測管理辦法》采用的標準[7],判斷該例ADR/ADE 的關聯性:(1)用藥與ADR/ADE時間的出現有無合理的時間關系;(2)是否為已知的ADR 類型;(3)停藥或減量后,ADR/ADE是否消失或減輕;(4)再次使用可疑藥品后是否再次出現同樣的ADR/ADE;(5)反應時間是否可用并用藥的作用、患者病情的進展、其他治療的影響來解釋。ADR/ADE 關聯性判斷見表1(注:表中“+”表示肯定;“-”表示否定;“±”表示難以肯定或否定;“?”表示不明);ADR/ADE 發生率根據其發生率判定標準判定,具體見表2;ADR/ADE研究技術路線見圖1。

表1 ADR/ADE關聯性判斷Tab 1 Relevance judgments of ADR/ADE

表2 ADR/ADE發生率判定Tab 2 Judgment of the incidence of ADR/ADE
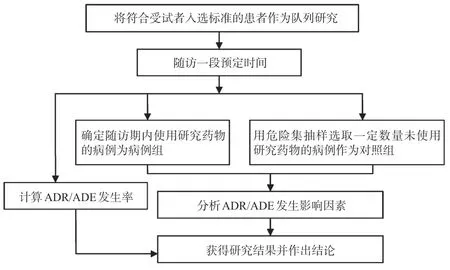
圖1 ADR/ADE研究技術路線Fig 1 Technology roadmap of ADR/ADE research
1.8 統計學方法
采用SPSS 20.0軟件協助分析,所有的統計檢驗均采用雙側檢驗,P<0.05為差異有統計學意義。對年齡等計量資料描述其均數、中位數、最小值、最大值;對分類指標如性別、藥物過敏史、有無ADR/ADE 發生等描述其各類的例數及構成比;分別以ADR/ADE、合理用藥為應變量,以性別、年齡、合并用藥等因素為自變量,采用非條件Logistic回歸分析或Poisson回歸分析ADR/ADE發生的各影響因素及其標準回歸系數。
2 結果
通過采用上述中藥注射劑上市后安全性再評價方法,我院已完成多個中藥注射劑的安全性再評價工作,促進了臨床醫師合理用藥,并有效降低了其ADR/ADE的發生率。現以注射用丹參多酚酸鹽為例進行說明。
2.1 患者的基本信息及用藥情況
選取我院2012年5月至2013年10月1 000例使用注射用丹參多酚酸鹽的冠心病心絞痛患者為研究隊列,觀察其ADR/ADE 的發生情況;病例組與對照組以1∶4 進行對照。患者的基本信息及用藥情況見表3(注:“其他”表示超說明書用法用量使用)。
2.2 用藥科室分布情況
用藥科室分布情況見表4。
2.3 ADR/ADE的發生情況
研究隊列共發生ADR/ADE者6例,按1∶4選取診斷為冠心病心絞痛、性別相同、入院時間相近(±7 d)、年齡相近(±5歲)使用注射用丹參多酚酸鹽但未發生ADR/ADE 的患者進行。病例組與對照組的基本情況見表5;ADR/ADE的類型/累及系統及臨床表現見表6(注:同一病例的ADR/ADE表現可能同時累及多個器官);ADR/ADE 的出現時間見表7(注:出現ADR/ADE 的時間從第一滴藥水進入人體開始計時);停藥后ADR/ADE的轉歸情況見表8。
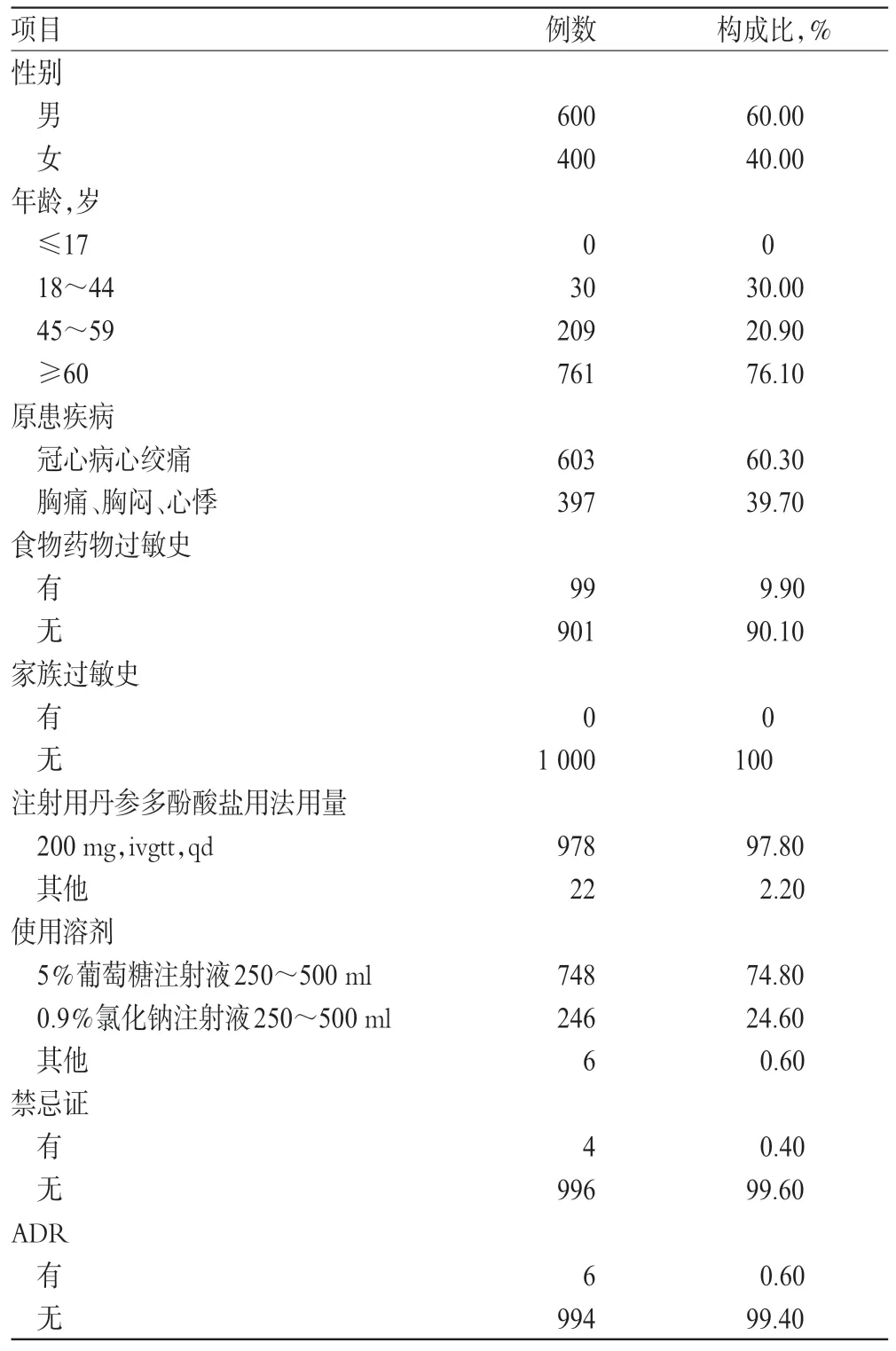
表3 患者基本信息及用藥情況Tab 3 Patient’s basic information and medications

表4 用藥科室分布情況Tab 4 Distribution of drug use in departments
2.4 相關參數統計
經采用SPSS 20.0 軟件分析,病例組中共發生ADR/ADE者6例,發生率為0.6%。按Poisson 分布估計注射用丹參多酚多酚酸鹽ADR/ADE 發生率的95%置信區間(CI)為(0.22%,1.31%),均為偶見(0.1%~1%)。進行非條件Logistic回歸分析,分別以ADR/ADE、合理用藥為應變量,以性別、年齡、合并用藥藥物過敏史、家族過敏史等因素為自變量,最終得出危險因素分別為性別、年齡、合并用藥。相關參數的估計值見表9。

表5 病例組與對照組基本情況Tab 5 General information of case group and control group
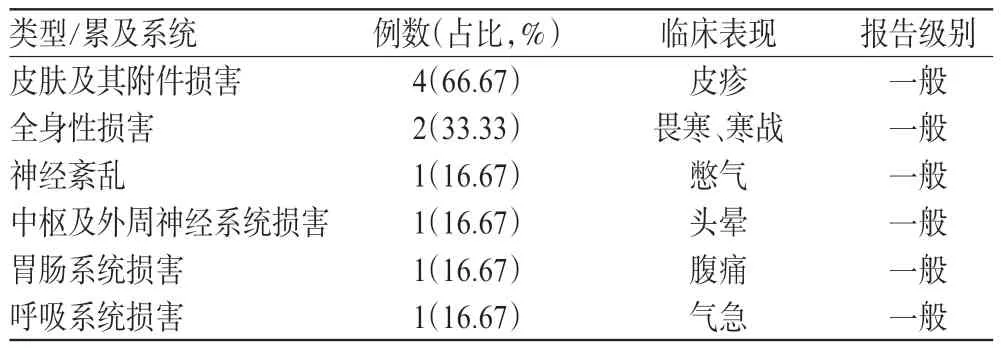
表6 ADR/ADE的類型/累及系統及臨床表現Tab 6 Types and systems of ADR/ADE and clinical manifestations

表7 ADR/ADE的出現時間Tab 7 The onset time of ADR/ADE

表8 停藥后ADR/ADE的轉歸情況Tab 8 The outcome of ADR/ADE after drug withdrawal

表9 非條件Logistic回歸分析Tab 9 Non conditional Logistic regression analysis
2.5 存在的問題
通過對注射用丹參多酚酸鹽的安全性再評價表明,我院在使用該藥的過程中雖未見新的、嚴重的ADR/ADE,但臨床在使用過程中仍存在不合理現象:(1)適應證不適宜。在選擇病例組病例時,符合藥品說明書適應證為納入標準之一。藥品說明書規定其主要適應證為冠心病和心絞痛,但在實際操作中發現我院有相當一部分患者因超適應證使用而被排除,如診斷為腔隙性腦梗死、大隱靜脈曲張、脂肪肝、膽囊結石膽囊炎、心肌梗死、骨折、糖尿病、高脂血癥、肝癌、斜疝等使用者,究其原因為中藥西用。有報道稱,某些綜合性醫院中藥注射劑由西醫處方使用的情況高達95%[8],很多西醫師沒有從中醫的角度辨證使用注射用丹參多酚酸鹽,而是簡單地認為其具有活血祛瘀的功效而使用。(2)用法用量不適宜。表現為常見給藥劑量和溶劑選用不適宜。如藥品說明書規定給藥劑量每日1 次,每次200 mg,溶劑劑量為250~500 ml,但使用時存在單次僅使用100 mg或選用溶劑劑量100 ml的情況。劑量不足或過大,可能導致療效降低或ADR/ADE 明顯增加;溶劑選用不當可能會導致配制藥液不溶性微粒增加和pH、離子強度等的變化而發生變性,直接影響用藥的安全性[9]。(3)存在禁忌使用情況。其均為與胰島素注射劑2單位混合使用,用于抵消5%葡萄糖注射液250 ml中所含的12.5 g糖對血糖的影響。根據《中藥注射劑臨床使用基本原則》要求,中藥注射劑應單用,禁忌與其他藥物混合配伍使用[10]。
3 討論
中藥注射劑的ADR具有多發性和普遍性、臨床表現多樣、不可預知性及批間差異性等特點。如何在中醫理論指導下緊密結合現代科學技術,進一步規范中藥安全性評價方法,完善安全性評價標準及體系,并以立法的形式加大中藥安全性評價規范執行的力度使其常態化值得探索。
根據《藥物臨床試驗質量管理規范》的要求,新藥Ⅵ期臨床試驗樣本量應≥2 000 例,但某些遲發的、嚴重的ADR 和藥物相互作用可能無法通過上述樣本量顯現,因此新藥上市后還應對更廣泛的人群、更復雜的用藥條件、更長的用藥時間、更多樣的用藥方案以及用藥前后的各項指標進行考察,以彌補中藥注射劑在藥品上市前評價的不足[11]。醫療機構為臨床用藥一線單位,建立一套切實可行的中藥注射劑安全性再評價方法,進而完善中藥注射劑上市后再評價體系,不僅可為探索建立藥品上市后再評價標準提供參考,而且可為臨床合理用藥提供依據,最終確保臨床安全、有效、經濟用藥。
[1]張娜,李林森.藏紅花藥理作用研究進展[J].藥物評價研究,2013,36(5):394.
[2]國家食品藥品監督管理總局.國家藥品不良反應監測年度報告:2014[S].2015-07-17.
[3]國家食品藥品監督管理局.關于暫停使用和審批魚腥草注射液等7個注射劑的通告[S].2006-06-01.
[4]國家食品藥品監督管理局.衛生部辦公廳、國家食品藥品監督管理局辦公室關于立即暫停使用和銷售黑龍江烏蘇里江制藥有限公司佳木斯分公司生產的雙黃連注射液的緊急通知[S].2009-02-12.
[5]國家食品藥品監督管理局.關于開展刺五加注射液藥品生產企業整頓工作的通知[S].2008-11-19.
[6]孫世光,石亞飛,王蘇會,等.應用德爾菲法構建中藥注射劑安全性評價指標體系[J].中國藥房,2015,26(6):729.
[7]衛生部.藥品不良反應報告和監測管理辦法[S].2011-05-04.
[8]李忠華.中藥注射劑在臨床應用中的注意事項[J].基層醫學論壇,2013,17(22):2 959.
[9]張奇兵,袁珺,趙壽寧.我院干預前后中藥注射劑使用合理性分析[J].中國藥房,2015,26(8):1 030.
[10]衛生部.中藥注射劑臨床使用基本原則[S].2008-12-24.
[11]國家食品藥品監督管理局.藥物臨床試驗質量管理規范[S].2003-08-06.

