鼠脊髓缺血再灌注損傷外周Th17/Treg細胞的變化與意義
歐 軍,姚平波,蔣福生,胡 聶,劉貴香,張 平
脊髓缺血再灌注損傷是一類脊髓神經元組織循環得到改善后乃出現的延遲性神經功能障礙或不可逆性遲發性神經元損傷[1]。目前認為參與脊髓缺血再灌注損傷發生的機制主要有免疫機制、血管機制、自由基損傷學說、鈣介導機制、炎性反應及細胞凋亡等復雜網絡演化機制調控其神經元細胞的自身活化及極化狀態,也調控神經再生和修復功能[2]。輔助性T 細胞17(T-helper17 cells,Th17)是近年來發現的一類新型Th 細胞亞群,其介導炎性反應,參與機體的免疫應答。調節性T 細胞(regulatory T cells,Treg)是能夠抑制免疫應答的重要細胞,具有抑制炎癥反應的作用,能夠下調免疫反應[3]。Treg細胞和Th17 細胞通過細胞因子的作用相互轉換,從而調節機體的免疫抑制與免疫效應并使之處于精細而復雜的動態平衡中[4]。Th17/Treg 保持平衡,有利于機體免疫穩態的維持,如果Th17/Treg 失平衡就會導致疾病發生發展乃至惡化[5~7]。但目前國內外有關Th17/Treg 平衡在大鼠脊髓缺血再灌注損傷中的變化、意義及其調控機制的研究未見文獻報道。為此,筆者觀察大鼠脊髓缺血再灌注損傷Thl7/Treg的特異性轉錄因子及相關細胞因子的變化,為闡明大鼠脊髓缺血再灌注損傷免疫紊亂的細胞與分子機制提供新思路及線索。
1 材料和方法
1.1 實驗動物及分組 健康雄性Wistar 大鼠40 只,體質量(400 ±20)g(由南華大學比較醫學科提供)。購進大鼠后進行1 w 的適應性飼養,溫度控制在20 ℃~28 ℃。隨機分為對照組(10 只)和脊髓缺血再灌注組(40 只)。
1.2 脊髓缺血再灌注損傷模型制備 采用1%氯胺酮100 mg/kg 腹腔注射麻醉,固定于實驗臺上。按昆明醫學院附屬昆華醫院李艷華教授首創的大鼠腎下腹主動脈結扎并切斷腎上腹主動脈發出的椎動脈,制備脊髓缺血再灌注損傷模型[8]。術后靜脈緩慢推注青霉素預防感染。大鼠完全清醒后放入單籠飼養。所有大鼠于缺血再灌注后重新麻醉,進行取材并-70 ℃冰箱保存。脊髓缺血再灌注損傷成功模型制作的標準:大鼠蘇醒后痙攣性擺動尾巴能正常進食,前肢功能正常,雙下肢癱瘓伴不同程度的大小便功能障礙。
1.3 轉錄因子RORγt 和Foxp3 mRNA 的表達自外周血分離淋巴細胞,Trizol 一步法提取總RNA,按照試劑盒說明書步驟反轉錄cDNA 及行熒光RT-PCR 檢測Foxp3 mRNA 和RORγt mRNA 水平表達。各基因引物序列及擴增產物長度(見表1)。采用標準曲線法計算mRNA 表達量,并計算其相對表達量(β-actin 校正值)。引物均由英濰捷基(上海)貿易有限公司合成。
1.4 血清細胞因子的測定 解凍-70 ℃保存的脊髓組織,裂解組織(裂解液4 ml/g),冰浴超聲勻漿,于4 ℃、3000 r/min 離心15 min 后收集上清液,按照ELISA 試劑盒說明書檢測白細胞介素-17 (interleukin-17,IL-17)、IL-6 及IL-10 檢測步驟,使用全自動酶標儀讀取波長450 nm 處的A 值。通過繪制標準曲線求出標本中的IL-10、IL-6 和IL-17 的濃度。
1.5 統計學分析 采用SPSS 19.0 統計軟件,數據以均數± 標準差(χ ± s)表示,采用One-Way ANOVA 檢驗,P <0.05 或P <0.01 為差異有統計學意義。
2 結果
2.1 轉錄因子Foxp3 mRNA 及RORγt mRNA的表達情況 脊髓缺血再灌注后大鼠組織中的Foxp3 mRNA 的表達急劇下降,在第3 天時表達量降到最低,之后隨著時間的延長出現再升的趨態;RORγt mRNA 表達量在第3 天時升至最高,之后隨著時間的延長出現再降的趨態(見表2)。
2.2 各組細胞因子之間的比較 脊髓缺血再灌注后各組IL-10 含量與對照組比較均明顯升高(P<0.01),在第3 天為最高。脊髓缺血再灌注后第1天其IL-6 及IL-17 含量均高于對照組(P <0.01),但IL-10 在脊髓缺血再灌注后其動態演變呈雙相變化趨勢,即在腸缺血再灌注后第3 天和第5 天分別出現兩個波谷。而脊髓缺血再灌注后第3 天和第7天其IL-6 及IL-17 含量處于較高水平,與第1 天比較有顯著性差異(P <0.05,見表3)。
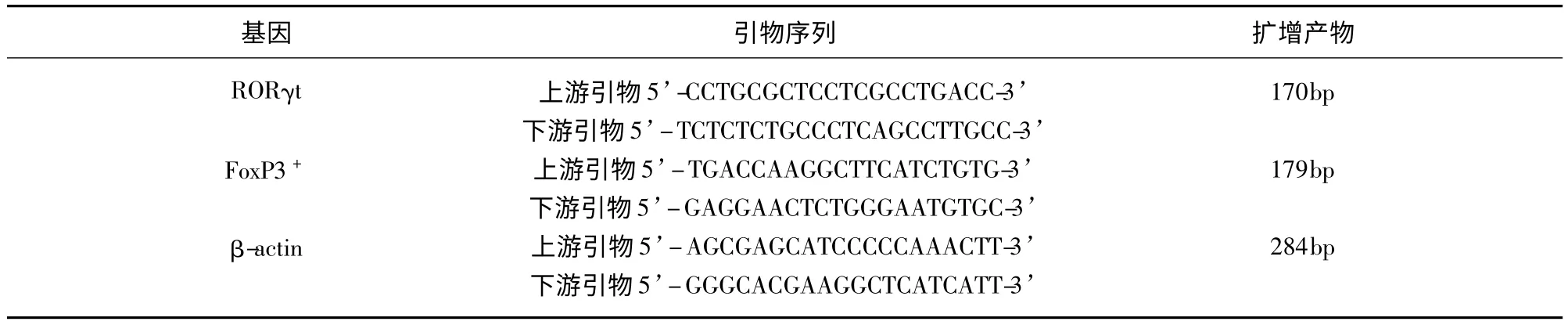
表1 各基因引物序列及擴增產物長度
表2 轉錄因子Foxp3 mRNA 及RORγt mRNA 的表達()
表3 各組之間細胞因子的比較(,ng/ml)
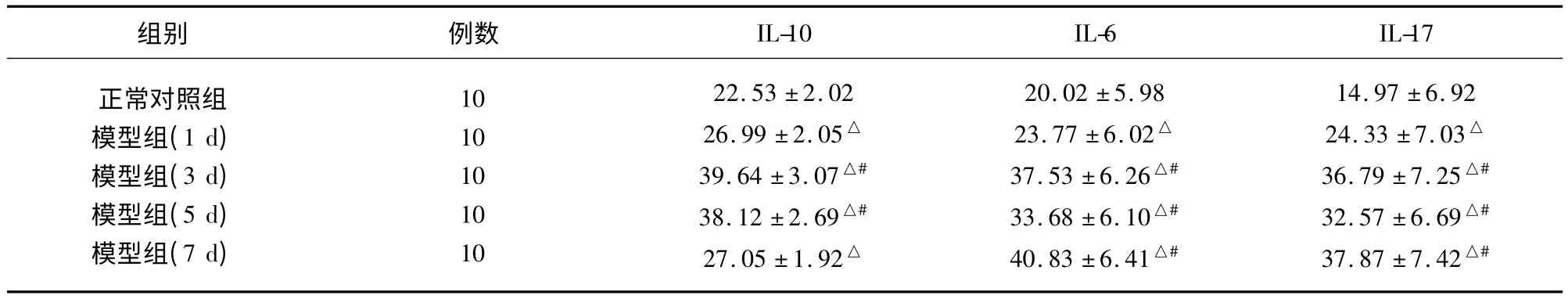
表3 各組之間細胞因子的比較(,ng/ml)
3 討論
Treg 細胞是一種具有調節機體免疫反應和誘導免疫耐受的T 細胞亞群。Treg 細胞的免疫抑制性是其最重要特性之一,能抑制效應性CD4+T 細胞增生與活化[9,10]。Th17 細胞介導炎性反應,參與機體的免疫應答,Treg 細胞與Th17 細胞保持平衡有利于機體免疫穩態的維持。Th17 細胞與Treg 細胞之間穩態的破壞是很多炎癥反應與自身免疫性疾病發生的關鍵因素[11,12]。
脊髓缺血再灌注損傷機制尚不十分明確。隨著不斷深入的研究,人們逐漸關注IL-10/IL-17 或IL-6/IL-17 軸在其發生及發展中的重要意義。本實驗研究表明,脊髓缺血再灌注損傷不同時間點的RORγt mRNA、Foxp3 mRNA 及細胞因子的表達與對照組比較,差異具有統計學意義(P <0.05 或P <0.01)。這說明在脊髓缺血再灌注損傷組織中Th17細胞/Treg 細胞比例失衡,Treg 細胞下調,免疫調節功能下降,導致效應性CD4+T 細胞大量活化,產生大量致炎因子,導致免疫功能紊亂,Th17 細胞數也隨之減少。Th17 細胞表達水平過低,從而導致機體抵抗能力下降,但Th17 細胞過度表達可能引發炎性反應和自身免疫應答。故適當提高缺血再灌注損傷組織Treg 的水平,將有助于改善其免疫功能。
此外隨著脊髓缺血再灌注損傷的發生及發展,其機體細胞因子及轉錄因子表達的動態演變如何,也是本實驗深入研究的方向和內容,以期全面系統地觀察Th17、Treg 及其上游調控因子與脊髓缺血再灌注損傷病程的相關性。在本實驗中,通過qRTPCR 技術檢測RORγt mRNA 和Foxp3 mRNA 的表達及采用ELISA 方法,檢測IL-10、IL-17、IL-6 的含量來反映脊髓缺血性再灌注損傷Th17/Treg 特異性轉錄因子動態演變及相關細胞因子的變化趨勢。在觀察的時間點內,第3 天時Foxp3 mRNA 和RORγt mRNA的表達出現一個不對稱峰值時脊髓缺血再灌注損傷后細胞因子IL-10、IL-17、IL-6 出現在高峰期說明機體通過表達Foxp3 誘導T 淋巴細胞分化Treg 細胞并促進IL-10 的分泌發揮抗炎及免疫抑制的作用;促炎因子IL-17 是Th17 細胞標志性的細胞因子,啟動炎癥的發生,促進炎性介質IL-6 的釋放加劇炎性反應。在實驗中還觀察到第7 天呈Foxp3 mRNA 呈上升趨勢,與此同時RORγt mRNA 的表達在7 d 開始下降,而IL-6、IL-17 及IL-10 含量乃處于較高水平,這可能與脊髓缺血再灌注損傷的機制的復雜化有關,且隨著時間的延長,其他的相關因素參與到脊髓缺血再灌注損傷發生發展環節中來,導致一系列機體病理生理及內環境穩態的變化,從而導致器官的損傷和全身炎性反應。
綜上所述,Treg 細胞與Th17 細胞發展的不平衡性在脊髓缺血再灌注損傷的發生發展中起關鍵性作用。這種穩態的破壞既使免疫系統激活,又使免疫效應不足,這種雙向變化,進一步加劇了炎癥反應,加劇了炎性反應狀態的發展。這提示:調控Th17 細胞的活化并增強Treg 細胞的活性使其處于穩態之中可以調節機體的免疫狀態和抑制炎癥反應狀態的進展,從而為脊髓缺血再灌注損傷的靶向治療提供了新的思路和線索。
[1]黃 飛,李亞男,尹 飛,等.脊髓缺血再灌注損傷對大鼠水通道蛋白4 表達的影響[J].中國免疫學雜志,2013,29(5):495 -498.
[2]宋慶鑫,張 帆,王 琨,等.miRNA 在急性脊髓損傷病理生理調節機制中的作用研究進展[J].中國脊柱脊髓雜志,2013,23(11):1022 -1024.
[3]Lu P,Wang M,Zheng P,et al.Th17/Treg unbalance is involved in the pathogenesis of experimental autoimmune encephalomyelitis[J].Chinese Journal of Cellular and Molecular Immunology,2014,30(10):1013 -1017.
[4]Ma L,Liang Y,Fang M,et al.The cytokines (IFN-gamma,IL-2,IL-4,IL-10,IL-17)and Treg cytokine (TGF-beta1)levels in adults with immune thrombocytopenia[J].Die Pharmazie,2014,69(9):694 -697.
[5]劉貴香,姚平波,張 平,等.急性腦梗死患者外周血Th17 細胞與調節性T 細胞的表達水平與預后的關系[J].廣東醫學,2014,35(7):1027 -1029.
[6]胡 聶,包 錚,王 松,等.嚴重胸部創傷患者外周血Th17/Treg平衡變化與預后的關系[J].廣東醫學,2014,35(7):1095 -1097.
[7]蔣福生,張 平,張新華,等.急性腦梗死患者免疫調節性T 淋巴細胞表達與預后的關系[J].中國動脈硬化雜志,2013,21(10):923 -926.
[8]金 華,郭光瓊,李艷華,等.脊髓缺血再灌注損傷模型的改進及對大鼠神經行為學的影響[J].中風與神經疾病雜志,2012,29(10):879 -882.
[9]Dong L,Wang X,Tan J,et al.Decreased expression of microRNA-21 correlates with the imbalance of Th17 and Treg cells in patients with rheumatoid arthritis[J].J Cellular and Molecular Medicine,2014,28(10):1 -12.
[10]Nogueira LG,Santos RH,Fiorelli AI,et al.Myocardial gene expression of T-bet,GATA-3,Ror-gammat,FoxP3,and hallmark cytokines in chronic Chagas disease cardiomyopathy:an essentially unopposed TH1-type response[J].Mediators of Inflammation,2014,2014:914326.
[11]Edwards JP,Thornton AM,Shevach EM,et al.Release of active TGFbeta1 from the latent TGF-beta1/GARP complex on T regulatory cells is mediated by integrin beta8[J].J Immunol,2014,193(6):2843 -2849.
[12]Hu R,Huffaker TB,Kagele DA,et al.MicroRNA-155 confers encephalogenic potential to Th17 cells by promoting effector gene expression[J].J Immunol,2013,190(12):5972 -5980.

