血尿酸水平與糖尿病周圍神經病變的相關性研究
曹宏麗,郭 暉,王月娟
尿酸(uric acid,UA)作為嘌呤代謝的終產物,是人體內一種強效的水溶性抗氧化劑和自由基清除劑,其在機體內的作用是一把雙刃劍。血尿酸水平過高,可導致痛風、高血壓和心血管疾病以及卒中的發生風險增加;血尿酸水平過低,可能與多發性硬化、帕金森病、阿爾茨海默病等神經變性疾病的發病風險增加有關[1]。DPN 作為一種特殊的神經病變,其與血尿酸的關系尚不明確,本文就兩者的關系探討如下。
1 資料與方法
1.1 資料 選取吉林大學第一醫院二部內分泌科2011年1 月~2014 年1 月間住院的明確第一診斷為2 型糖尿病患者。入組標準:糖尿病診斷標準符合1999 年WHO 糖尿病診斷標準[2]。排除標準:(1)患有痛風、原發性腎病、腎功能不全、白血病、惡性腫瘤、惡性貧血、多發性骨髓瘤等可引起血尿酸升高的疾病。(2)服用利尿劑、阿司匹林、吡嗪酰胺、苯扎貝特、苯溴馬隆等促血尿酸排泄藥及抑制尿酸合成藥物者。符合上述條件的2 型糖尿病患者共1905 例,其中男性1047 例,女性858 例;年齡22~86 歲,平均年齡(53 ±3)歲。
1.2 方 法
1.2.1 DPN 篩查 DPN 診斷標準符合2009 年中國醫師學會制定的DPN 診斷標準[3]。本研究以震動覺及10 g 尼龍絲檢查作為DPN 檢查方法。所有振動感覺閾值(vibration perception threshold,VPT)均由同一操作者使用同一感覺定量檢查儀完成。操作步驟采用國際糖尿病足工作組方法[4]。判斷標準:VPT 0~15 V,為感覺正常;16~25 V,為振動覺減退;VPT >25 V,為振動覺喪失[5]。10 g 尼龍絲檢查[6]:以雙足拇趾、第4 足趾及第1、3、5 跖骨頭的掌面為檢查部位,將特制的10 g 尼龍絲一頭垂直接觸患者的檢查部位,用手按尼龍絲另一頭輕輕施壓,正好使尼龍絲彎曲,接觸皮膚時間1~1.5 s,詢問患者是否感到尼龍絲的刺激,如不能感覺則再試一次,兩次均不能感覺即判斷此點為陽性。各個部位檢測順序隨機。
1.2.2 血尿酸測定 受試者晚餐后禁食12 h,次晨空腹靜息時抽取肘正中靜脈血3 ml,立即加入EDTA 預處理的抗凝管中,及時送檢。高尿酸血癥診斷標準[7]:男性和絕經后女性血尿酸>420 μmol/L,絕經前女性>360 μmol/L。
1.2.3 不同尿酸水平的劃分標準 將收集的患者分為男性(男性及絕經后女性)組和女性(未絕經女性)組。按照血尿酸單位換算標準(1 mg/dl~60 μmol/L)將男性組血尿酸分成如下6 層:<240 μmol/L、240~299 μmol/L、300~359 μmol/L、360~ 419 μmol/L、420~ 479 μmol/L、≥480 μmol/L。女性組血尿酸分為如下4 層:<240 μmol/L、240~299 μmol/L、300~359 μmol/L、≥360 μmol/L。
1.2.4 統計學分析 利用SPSS 17.0 軟件進行統計學分析,計量數據以均數±標準差()表示;計數資料以百分率表示,組間比較采用χ2檢驗,P <0.05 為差異具有統計學意義。
2 結果
2.1 DPN 與非DPN 患者高尿酸血癥發生率比較 DPN組HUA 的發生率為15.3%,非DPN 組HUA 的發生率為10.1%,DPN 組HUA 的發生率高于非DPN 組,差異具有統計學意義(P <0.05)(見表1)。
2.2 不同性別不同血尿酸水平的DPN 發生率 兩組患者按照尿酸水平由低到高分層,男性及絕經后女性組中,各層中DPN 的發生率分別為31.46%、29.82%、23.98%、34.09%、38.84%、37.83%。絕經前女性患者中,各層中DPN 的發生率分別為26.78%、8.20%、13.11%、71.43%。兩組結果顯示隨著血尿酸水平的增高,DPN 的發生率與血尿酸水平均呈現U 型曲線關系,即隨著血尿酸水平的增高,DPN 的發生率逐漸下降。男性及絕經后女性組中,當血尿酸水平居于300~359 μmol/L 范圍時,DPN 發生率最低。當血尿酸值≥360 μmol/L 時,DPN 發生率隨著尿酸水平升高呈上升趨勢。絕經前女性組中,當血尿酸值為240~299 μmol/L時,DPN 發生率達最低,當血尿酸水平≥300 μmol/L 且繼續增高時,DPN 發病率呈上升趨勢,不同尿酸水平之間DPN 發生率的比較具有統計學意義(P <0.05)(見表2、表3)。

表1 DPN 與非DPN 患者高尿酸血癥發生率比較
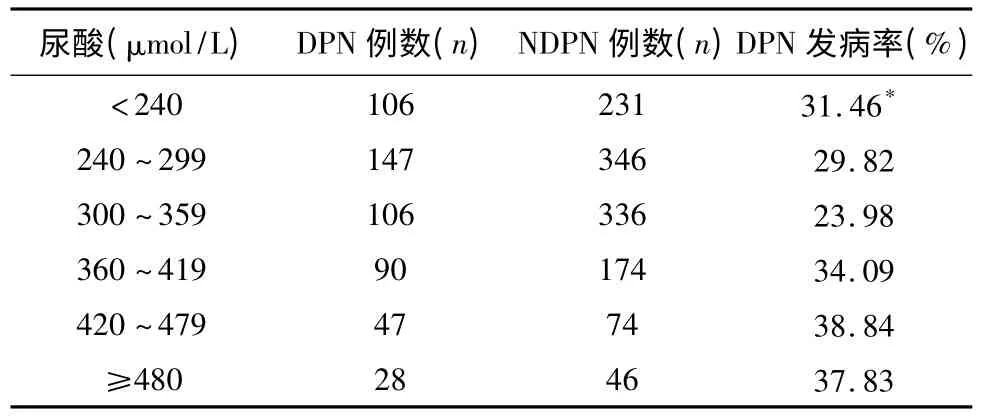
表2 男性及絕經后女性血尿酸水平與DPN 發病率的關系

表3 女性血尿酸水平與DPN 發病率的關系
3 討論
人體內存在抗氧化劑一促氧化劑尿酸鹽氧化還原穿梭系統,血尿酸在一定濃度范圍內具有抗氧化特性,對人體具有保護作用,但血尿酸水平過高時,則具有促氧化特性,成為致病因素[8]。鑒于尿酸在人體內的雙重作用,我們對1905例(男性1047 例,女性858 例)2 型糖尿病患者進行了回顧性分析,以探討尿酸水平與糖尿病周圍神經病變的關系。
本研究結果顯示,住院患者DPN 發病率為31%左右,低于其它相關文獻所報道的大于50%[9,10]。產生差異的原因考慮與本研究中所采用的DPN 檢查方法,其判定結果易被受試者的主觀因素影響有關。我們的結果表明DPN 患者HUA 的發生率高于非DPN 患者,提示2 型糖尿病患者中,高尿酸血癥可能參與了周圍神經病變的發生。兩組患者中,根據尿酸水平進行分層分析,其DPN 的發生率隨著尿酸水平的增加,均呈現先下降后上升趨勢。男性及絕經后女性組中,當血尿酸水平居于300~359 μmol/L 范圍時,DPN 發生率最低。當血尿酸值≥360 μmol/L 時,DPN 發生率隨著尿酸水平升高呈上升趨勢。絕經前女性組中,當血尿酸值為240~299 μmol/L 時,DPN 發生率達最低,當血尿酸水平≥300 μmol/L且繼續增高時,DPN 發病率呈上升趨勢。這一結果提示由于尿酸具有抗氧化及促氧化的雙重作用,在不同濃度時,其抗氧化和促氧化作用所占優勢不同,在我們的對于糖尿病周圍神經病變與尿酸的相關性研究中,發現似乎當男性及絕經后女性尿酸水平居于300~359 μmol/L,女性尿酸水平居于240~299 μmol/L 時,DPN 發病率最低,分析原因可能為在此區間內尿酸抗氧化作用處于優勢,對于周圍神經具有較好的保護作用,而當尿酸水平高于或低于這一區間時,其促氧化作用可能處于優勢,從而一定程度上參與或加重了糖尿病周圍神經病變的發生。國外對健康志愿者的研究發現,輸注尿酸可以提高血清抗氧化能力[11]。而尿酸的抗氧化作用在多發性硬化、帕金森病以及腦卒中等疾病的發生發展中也可能起到保護性作用[12~15]。因此,過低的尿酸水平可能會降低其對神經的保護作用。
本研究結果提示對于2 型糖尿病合并無癥狀高尿酸血癥的患者,在降低尿酸的治療過程中,從周圍神經系統并發癥的角度考慮,男性和絕經后女性最適宜的尿酸水平可能居于300~359 μmol/L 之間,而絕經前女性則居于240~299 μmol/L 之間,可能發揮尿酸抗氧化作用,起到神經保護作用。因此,在降尿酸過程中,尿酸水平可能并非越低越好,將尿酸水平控制在適宜水平,可能有助于減少DPN 的發生與發展。
[1]Alon A,Vivian E.Influence of serum uric acid levels on prognosis and survival in amyotrophic lateral sclerosis:a meta-analysis[J].Neurol,2014,261:1133 -1138.
[2]World Health Organization.Definition,diagnosis and classification of diabetes mellitus and its complications:Report of a WHO Consultation.Part 1:diagnosis and classification of diabetes mellitus[M].World Health Organization,Geneva,1999.
[3]胡仁明,樊東升.糖尿病周圍神經病變診療規范[J].中國糖尿病雜志,2009,17:638 -640.
[4]Apelqvist J,Bakker K,van Houtum WH,et al.Practical guidelines on the prevention of the diabetic foot:based upon the International Consensus on the diabetic foot(2007)Prepared by the International Working Group on the diabetic foot.International Working Group on the Diabetic Foot(IWGDF)Editodal Board[J].Diabetes Metab Res Rev,2008,24:181 -187.
[5]Young MJ,Breddy L,Veves A,et al.The prediction of diabetic neuropathic foot ulceration using vibratory perception thresholds.A prospective study[J].Diabetes Care,1994,17:557 -560.
[6]Leonard DR,Farooqi MH,Myer S.Restomtion of sensation,reduced pain,and improved balance in subjects with diabetic peripheral neumpathy[J].Diabetes Care,2004,27:168 -172.
[7]Hochberg MC,Smolen JS,Weinblatt ME,et al.Rheumatology,3rd ed[M].New York:Mosby Press,2003.
[8]賈少丹,王顏剛,李慧鳳,等.不同尿酸濃度與氧化應激和內皮損傷指標研究[J].中華內科雜志,2008,47(8):638 -641.
[9]Caluutt NA.Tolerating diabetes:an alternative therapeutic approach for diabetic neuropathy[J].ASN Neuro,2010,2:215 -217.
[10]Boultonn JM,Vinik Al,Arezzo JC,et al.Diabetic Neuropathies:as tatement by the American diabetes Association[J].Diabetes Care,2005,28(4):956 -962.
[11]Waring WS,Webb DJ,Maxwell SR.Systemic uric acid administration increases serum antioxidant capacity in healthy volunteers[J].Cardiovasc Phailnacol,2001,38:365 -371.
[12]Chen H,Mosley TH,Alonso A.Plasma urate and Parkinson’s disease in the atherosclerosis risk in Communities(ARIC)study[J].Am J Epidemiol,2009,169:1064 -1069.
[13]De Vera M,Rabman MM,Rankin J,et al.Gout and the risk of Parkinson’s disease:a cohort study[J].Arthritis Rhearn,2008,59:1549 -1554.
[14]Hooper DC,Spitsin S,Kean RB,et al.Uric acid,a natural scavenger of peroxynitrite in experimental allergic encephalomyelitis and multiple sclerosis[J].Proc Natl Acad Sci USA,1998,95:675 -680.
[15]Guerrero AL,Gutierrez F,Lglesias F,et al.Serum uric acid levels in multiple sclerosis patients inversely correlate with disability[J].Neurol Sci,2011,32:347 -350.

