基于根際與凋落物際評價轉Bt水稻對土壤線蟲群落的影響
戚 琳,劉滿強,2,*,蔣林惠,張楗嶠,李修強,陳法軍,胡 鋒
1 南京農業大學資源與環境科學學院土壤生態實驗室, 南京 210095 2 中國科學院南京土壤研究所/土壤與農業可持續發展國家重點實驗室, 南京 210008 3 南京農業大學植物保護學院, 南京 210095
基于根際與凋落物際評價轉Bt水稻對土壤線蟲群落的影響
戚 琳1,劉滿強1,2,*,蔣林惠1,張楗嶠1,李修強1,陳法軍3,胡 鋒1
1 南京農業大學資源與環境科學學院土壤生態實驗室, 南京 210095 2 中國科學院南京土壤研究所/土壤與農業可持續發展國家重點實驗室, 南京 210008 3 南京農業大學植物保護學院, 南京 210095
轉基因作物在商業化推廣前,有必要評價其對非靶標土壤生物的生態影響。根系和凋落物與土壤的界面是代表植物直接影響土壤的兩個典型活性微域,即根際和凋落物際。基于室內盆栽實驗構建水稻根際和凋落物際,比較了這兩個高活性微域中轉Bt水稻克螟稻(KMD)與親本水稻秀水11(XSD)對土壤可利用資源、微生物學性質和線蟲群落的影響。結果表明:轉Bt水稻對土壤性質的影響依賴于水稻生育期和微域的變化。與XSD相比,KMD在苗期和拔節期顯著提高了凋落物際土壤可溶性有機氮含量(P<0.05);在苗期顯著降低了凋落物際土壤銨態氮含量,但在成熟期顯著提高了凋落物際與交互微域土壤的銨態氮含量(P<0.05)。與親本水稻相比,轉Bt水稻分別在苗期和成熟期顯著提高了凋落物際土壤微生物生物量碳和活性,而在拔節期和成熟期顯著降低了根際土壤微生物生物量氮含量(P<0.05)。微域間的交互作用顯著影響土壤微生物生物量、可溶性有機碳和氮、線蟲總數和各食性線蟲的數量(P<0.05)。轉Bt水稻總體上降低了土壤線蟲總數,尤其在苗期和拔節期的凋落物際土壤中達到顯著水平。重復測量方差分析表明轉Bt水稻顯著影響土壤食細菌(P<0.01)和食真菌(P<0.05)線蟲數量,及線蟲群落的通道指數和富集指數。水稻收獲后KMD秸稈的Bt蛋白含量顯著高于親本,全部KMD處理的土壤樣品中Bt蛋白含量無顯著變化,因而轉Bt水稻對土壤生物學性質的影響可能并非來源于Bt蛋白的作用,而更可能來自于水稻生長性狀和凋落物性質的差異。
轉Bt水稻;根際;凋落物際;Bt蛋白;線蟲群落
水稻是我國主要的糧食作物之一,卻因長期遭受病蟲害的嚴重侵襲造成大量減產。傳統化學防治既會增加生產成本又會造成環境污染。轉基因水稻抗蟲蛋白的表達能夠減少農藥施用量,在我國糧食安全保障中具有重要的地位[1]。轉Bt水稻由于外源基因的插入,改變了作物組織的化學成分組成和生理生化性狀[2],在生長期間可能影響農田生物群落組成和多樣性。目前,有關轉Bt水稻生態風險評價的研究大多集中于地上部非靶標生物[3- 5],土壤食物網中處于較高營養級的土壤動物正逐漸受到關注[6- 10]。
線蟲是農田土壤中多樣性較為豐富的優勢生物類群[11],在評價農田土壤生態系統方面具很大優勢[12]。首先,線蟲可敏感地反映土壤環境的細微變化[13];其次,線蟲食性多樣,在土壤食物網中扮演重要角色,對維持土壤生態系統物質循環等功能起著重要作用,其營養類群結構的改變與土壤生態系統過程緊密聯系[14];且其分離、鑒定較為簡單[15],有助于評價轉Bt水稻對土壤生態環境的潛在風險。目前,利用線蟲群落研究轉基因作物對土壤生態系統的影響多集中在玉米[16- 18]和棉花[19]等作物上,研究結果各異。例如,Griffiths等[16]在3個不同試驗地種植轉Bt及親本玉米,發現二者之間的土壤線蟲群落無顯著差異;而Mina等[19]發現幾乎全部采樣時期Bt棉花根際土壤的微型、中型和大型土壤動物數量均高于非Bt棉花根際土壤。以往的相關研究主要關注土體土壤[16- 17],針對植物影響較為直接和強烈的微域土壤研究較少。以往的研究中,較多關注單一的根系生長或凋落物分解過程對土壤的影響,而綜合根際和凋落物際對土壤生物群落的影響鮮有報道[20]。
根際(根系-土壤界面)代表空間小尺度的高活性微域,受作物根系生長過程的直接影響而形成,對根際的研究有利于理解土壤生態系統結構和功能[14]。凋落物際(凋落物-土壤界面)與凋落物直接接觸,受凋落物分解過程直接影響,對土壤有機碳的礦化貢獻很大[21]。二者都是資源豐富和生物活性極高的微域[22],其養分狀況和生物群落結構與土體土壤的大為不同[20]。轉Bt水稻對土壤的影響主要通過作物根系生長和殘體分解兩個途徑,根際和凋落物際代表進行這兩個途徑的微域。根際土壤生物與植物根系相互作用,對根際生態環境和生態功能、地上部群落具有強烈的影響[14],在土壤養分轉化和土壤微生物的調節過程中發揮著重要作用[23]。鑒于根際和凋落物際是直接受到轉Bt水稻根系生長和凋落物分解影響的高活性微域,土壤線蟲群落在這兩個微域內的響應可能比土體土壤內的響應更靈敏,因此,綜合這兩個微域的線蟲群落分析可對評估轉Bt水稻的土壤生態風險起到預警作用。
本文通過構建水稻根系-土壤和凋落物-土壤的活性界面(即根際和凋落物際),研究轉Bt水稻種植過程中不同生育期內的根際和凋落物際的微生物學性質和線蟲群落結構的變化,以期深入評價轉Bt水稻短期種植后對不同微域中土壤生物群落的生態風險影響。預期結果有助于構建轉Bt水稻生態安全監測指標,全面了解轉Bt水稻對土壤生態系統的影響。
1 材料和方法
1.1 實驗材料
實驗選用轉Bt水稻克螟稻及其非轉Bt親本秀水11。其中,轉Cry1Ab純合基因抗蟲恢復系克螟稻(簡稱克螟稻,KMD)是將Bt(Bacillusthuriengsis)殺蟲蛋白基因(Cry1Ab)導入晚粳稻秀水11(簡稱秀水稻,XSD)后選育出的Bt水稻,對8種鱗翅目害蟲具有高抗性,稻種由浙江大學原子能研究所提供。
供試土壤采自江西鷹潭余江縣長期耕作的雙季稻稻田,屬于河流沖積土發育而成的潴育型水稻土,耕層土壤(0—15 cm)有機質含量25.5 g/kg,全氮1.54 g/kg,有效氮95.1 mg/kg,有效磷16.1 mg/kg,速效鉀34.2 mg/kg,pH值 5.5。
1.2 研究方法
1.2.1 實驗設計

圖1 盆缽內構建凋落物際和根際的凋落物網袋及水稻根系分布示意圖Fig.1 Schematic view of detritusphere and rhizosphere set-up via the spatial layout of litter mesh bags and roots of rice plants in the pots
水稻種植盆缽選用高19 cm,直徑17 cm的圓形塑料桶,將兩個品種的水稻凋落物(即水稻收獲后的地上部秸稈,包含莖桿和葉片)分別烘干研磨,稱取50 g凋落物與50 g鮮土混勻后裝入孔徑2 mm的網袋中。網袋平整地壓實,豎直擺放在桶的直徑剖面上(圖1),周圍填滿土,每個盆缽裝土5 kg。網袋中凋落物與種植的水稻品種一致,此網袋邊際為凋落物際的采樣點。不添加凋落物際的處理中,網袋中僅裝50 g鮮土。水稻種子在30% H2O2溶液中浸種30 min后再用大量清水反復沖洗。在去離子水中避光浸泡24 h后平鋪在濕潤紗布上室溫避光培養,2—3 d種子出芽,5 d后移栽長勢健壯一致的水稻幼苗。
于2011年6月1日移栽水稻幼苗,創建3種微域:① 不種植水稻,土壤中僅添加凋落物(D,凋落物際);② 種植水稻,土壤中不添加凋落物(R,根際);③種植水稻,土壤中添加對應品種的凋落物(DR,復合微域,即包含凋落物際和根際的復合影響),每個處理設4重復。每桶分別種植8株轉Bt或其非轉Bt親本水稻,水稻與凋落物袋的距離為2 cm,播種前基肥施入量為脲 1.0 g、NH4H2PO40.5 g、KCl 0.5 g(相當于田間施肥水平:N 150 kg/hm2,P 75 kg/hm2,K 150 kg/hm2),并于拔節期同水平追肥一次,盆缽置于南京農業大學日光溫室中,日常管理保持土壤水分飽和。隨著水稻根系的生長,根系逐漸插伸在網袋中形成了與密集的“根系網”,因此在沒有凋落物的盆缽中形成根際。同樣,沒有種植水稻的盆缽中,網袋內凋落物分解過程中形成了凋落物際,而在同時種植水稻和含有凋落物袋的盆缽中形成了受到根系和凋落物共同影響的復合微域。分別在7月13日(苗期)、9月3日(拔節期)和10月28日(成熟期)用內徑2 cm的土鉆緊貼凋落物網袋采集土壤樣品,每次采樣用標簽記錄,以便不干擾下次采樣。在水稻成熟期收獲水稻地上部植株鮮樣并保存在-70 ℃冰箱,用于測定Cry1Ab蛋白含量。挑出土壤中的植物殘體后放入4 ℃冰箱保存,盡快進行土壤微生物學性質、線蟲群落分析和速效養分的測定。
1.2.2 測定方法
Bt蛋白含量的測定采用美國Agdia公司生產的Enzyme-linked immunosorbent assay (ELISA)Bt-CrylAb酶聯免疫試劑盒。試劑盒每個孔中加入100 μL酶連接液,在酶標板的前兩列中加入8個不同濃度(0、0.125、0.25、0.5、1、2、4、8 ng/mL)的Bt標準蛋白,秸稈樣品稀釋液以及土壤樣品上清液按順序分別加入板中,將酶標板放入鋪有濕紙巾的密閉容器中,室溫孵育2 h后洗板并加入TMB顯色底物和3 mol/L的H2SO4作為反應終止液,用酶標儀在450 nm下讀數,測定酶標板中每個測試孔的光密度值。根據標準曲線求出Cry1Ac/Ab殺蟲蛋白的含量,換算成ng/g鮮重來表示。
可溶性有機碳和氮采用0.5 mol/L K2SO4溶液浸提,8000 r/min離心10 min后上清液過孔徑0.45 μm的醋酸纖維濾膜,濾液中碳氮含量測定分別用K2Cr2O4外加熱法和半微量凱氏定氮法測定。銨態氮和硝態氮采用2 mol/L KCl溶液浸提,充分震蕩后過濾取濾液用連續流動分析儀(Auto Analyzer Ⅲ,Bran and Luebbe, Germany)進行測定。
用氯仿熏蒸-K2SO4溶液浸提法測定新鮮土樣的微生物生物量碳和氮,熏蒸土樣與未熏蒸土樣的有機碳和氮差值的轉換系數分別是KC=0.38,KN=0.54[24]。土壤基礎呼吸采用呼吸瓶22℃黑暗培養3 h,收集氣體樣品用氣象色譜分析(Agilent 7890A, USA)。微生物代謝熵為土壤基礎呼吸與微生物生物量碳的比值。采用蔗糖浮選離心法分離線蟲[25],在立體顯微鏡下直接計數并換算成100 g干土的線蟲數量。在生物顯微鏡下進行線蟲屬種鑒定,根據線蟲的頭部形態學特征和取食習性劃分為植食、食細菌、食真菌和捕食/雜食線蟲[26]。
自由生活線蟲成熟度指數:
MI=∑vi×fi
式中,vi為自由生活線蟲的c-p值,fi為某科/屬(i)在自由生活線蟲(不包括植食線蟲)總數中所占的比重。
線蟲通道指數NCR為食細菌線蟲與食微線蟲(食細菌+食真菌)數量之比。
Shannon多樣性指數:
H′=-∑PilnPi
式中,Pi為第i個分類單元中個體占線蟲總數的比例。
富集指數:
EI=100×(e/(e+b))
結構指數:
SI=100×(s/(b+s))式中,e為食物網中的富集成分,主要指食細菌線蟲中c-p值為1和食真菌線蟲中c-p值為2的類群,b為食物網中的基礎成分,主要指食細菌線蟲和食真菌線蟲中c-p值為2的類群,s為食物網中的結構成分群,分別為食細菌線蟲、食真菌線蟲和捕食/雜食線蟲中c-p值為3—5的類群以及捕食性線蟲中c-p值為2—5的類群[27]。
1.2.3 數據分析
采用重復測量方差分析法(ANOVA)分析不同采樣時期KMD和XSD種植條件下土壤微生物學性質、線蟲群落和養分的變化。同一采樣時間同種微域土壤的KMD和XSD之間的差異采用獨立樣本t檢驗,不同微域、相同水稻品種之間的差異比較采用最小顯著極差法(LSD),顯著性水平設α=0.05。
KMD和XSD種植下線蟲群落結構的差異采用非度量多變量排序(nMDS),用以檢驗各采樣時期不同水稻品種的微域土壤線蟲群落組成的總體變化。上述分析方法基于各線蟲屬相對豐度的Bray-Curtis相似性矩陣,所有分析采用SPSS 16.0和PRIMER 5.0統計軟件處理。
2 結果與分析
2.1 轉Bt水稻及親本對土壤養分、Bt蛋白含量及微生物學性質的影響
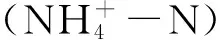
表1 轉Bt水稻及親本對不同微域土壤Bt蛋白、有效養分含量和微生物學性質影響的重復測量方差分析結果
Table 1 Repeated-measure ANOVA results for the effects of different rice varieties (transgenicBtand non-Btlines) and microsites on soilBtprotein, available nutrients content and microbial properties
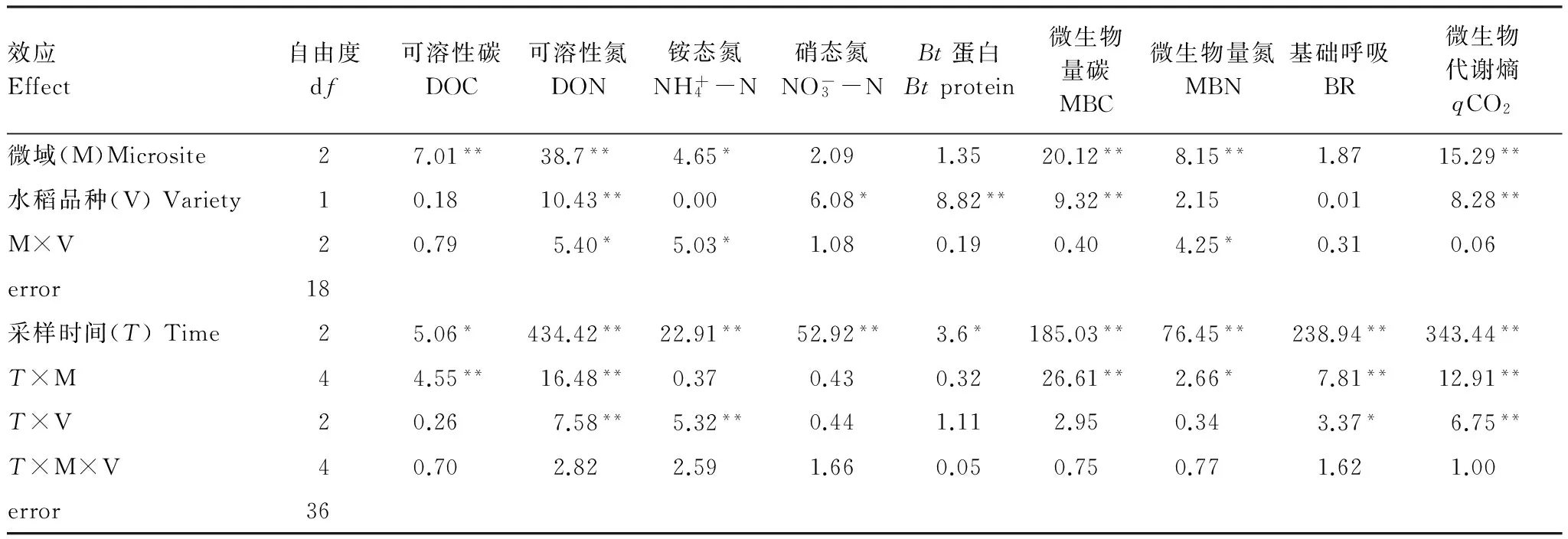
效應Effect自由度df可溶性碳DOC可溶性氮DON銨態氮NH+4-N硝態氮NO-3-NBt蛋白Btprotein微生物量碳MBC微生物量氮MBN基礎呼吸BR微生物代謝熵qCO2微域(M)Microsite27.01**38.7**4.65*2.091.3520.12**8.15**1.8715.29**水稻品種(V)Variety10.1810.43**0.006.08*8.82**9.32**2.150.018.28**M×V20.795.40*5.03*1.080.190.404.25*0.310.06error18采樣時間(T)Time25.06*434.42**22.91**52.92**3.6*185.03**76.45**238.94**343.44**T×M44.55**16.48**0.370.430.3226.61**2.66*7.81**12.91**T×V20.267.58**5.32**0.441.112.950.343.37*6.75**T×M×V40.702.822.591.660.050.750.771.621.00error36
DOC: Dissolved organic carbon;DON: Dissolved organic nitrogen;MBC: Microbial biomass carbon;MBN: Microbial biomass nitrogen;BR: Basal respiration;qCO2: Microbial metabolic quotient;*表示差異顯著; **表示差異極顯著

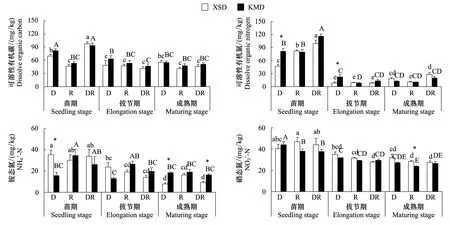
圖2 轉Bt水稻(KMD)及親本(XSD)對不同微域土壤可溶性養分含量的影響(平均值±標準誤)Fig.2 Effects of transgenic Bt and non-Bt rice varieties on soil dissolved nutrients contents (mean±SE)
所有采樣時期各微域KMD土壤樣品中均能檢測到Bt蛋白,但含量很低,土壤Bt蛋白含量在0.105—0.108 ng/g范圍內,最小值和最大值分別出現在水稻苗期和成熟期的根際土壤,且不同微域土壤間的Bt蛋白含量無顯著差異(圖3)。水稻成熟期收獲的水稻植株中,KMD秸稈Bt蛋白含量顯著高于親本,根際和交互微域處理的同一品種的水稻秸稈中Bt蛋白含量無顯著差異(P>0.05,圖3)。

圖3 轉Bt水稻(KMD)不同微域土壤Bt蛋白及成熟期轉Bt水稻(KMD)、親本水稻(XSD)秸稈Bt蛋白含量Fig.3 Contents of soil Bt protein of transgenic Bt and non-Bt rice varieties and Bt protein content in straw after maturing stage (mean±SE)
相比于親本,轉Bt水稻總體上提高了土壤MBC,僅在成熟期D土壤中KMD比XSD降低了MBC,但未達到顯著水平(P>0.05),KMD顯著提高了苗期D土壤MBC;轉Bt水稻對土壤MBN的影響因水稻生長期和微域而異,3個時期KMD比XSD降低了R土壤MBN,在拔節期和成熟期達到顯著水平(P<0.05),成熟期D土壤BR顯著提高(圖4)。
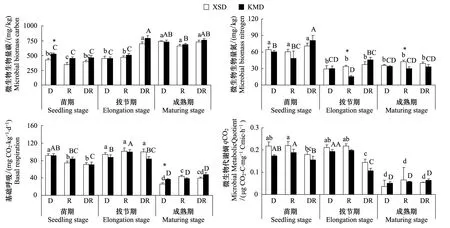
圖4 轉Bt水稻(KMD)及親本(XSD)對不同微域土壤微生物生物學性質的影響(平均值±標準誤)Fig.4 Effects of transgenic Bt and non-Bt rice varieties on soil microbial properties (mean±SE)
2.2 轉Bt水稻及親本對土壤線蟲數量及群落結構的影響
土壤線蟲總數受微域和轉Bt水稻品種及其交互作用影響顯著;其中,食微線蟲(食細菌和食真菌線蟲)數量受水稻品種影響顯著,自由生活線蟲(食微線蟲+捕食/雜食線蟲)受微域及水稻生長期影響顯著(P<0.05),微域間的交互作用對土壤線蟲數量和各食性線蟲數量影響顯著。線蟲通道指數(NCR)和富集指數(EI)受微域和水稻品種的顯著影響,而水稻品種對成熟度指數(MI)影響顯著,微域間的交互作用對MI、NCR、EI和SI的影響達到顯著水平(表2)。
表2 轉Bt水稻及親本在不同微域下線蟲數量及生態指標的重復測量方差分析結果
Table 2 Repeated-measure ANOVA results for the effects of different rice varieties (transgenicBtand non-Btlines) and microsites on soil nematode abundance and ecological indices
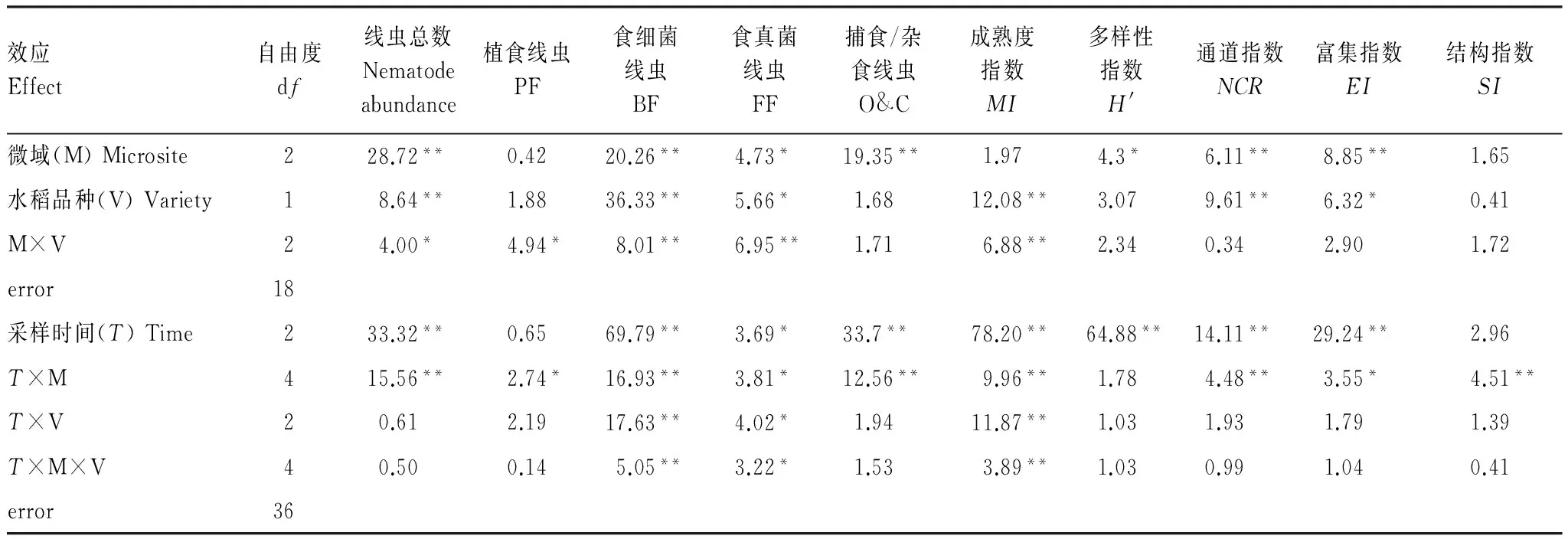
效應Effect自由度df線蟲總數Nematodeabundance植食線蟲PF食細菌線蟲BF食真菌線蟲FF捕食/雜食線蟲O&C成熟度指數MI多樣性指數H'通道指數NCR富集指數EI結構指數SI微域(M)Microsite228.72**0.4220.26**4.73*19.35**1.974.3*6.11**8.85**1.65水稻品種(V)Variety18.64**1.8836.33**5.66*1.6812.08**3.079.61**6.32*0.41M×V24.00*4.94*8.01**6.95**1.716.88**2.340.342.901.72error18采樣時間(T)Time233.32**0.6569.79**3.69*33.7**78.20**64.88**14.11**29.24**2.96T×M415.56**2.74*16.93**3.81*12.56**9.96**1.784.48**3.55*4.51**T×V20.612.1917.63**4.02*1.9411.87**1.031.931.791.39T×M×V40.500.145.05**3.22*1.533.89**1.030.991.040.41error36
PF: Plant feeders; BF: Bacterial feeders; FF: Fungal feeders; O&C: Omnivorous & Carnivorous;MI: Maturity index;H′: Shannon-Wiener index;NCR: Nematode channel ratio;EI: Enrichment index;SI: Structure index; *P<0.05, **P<0.01
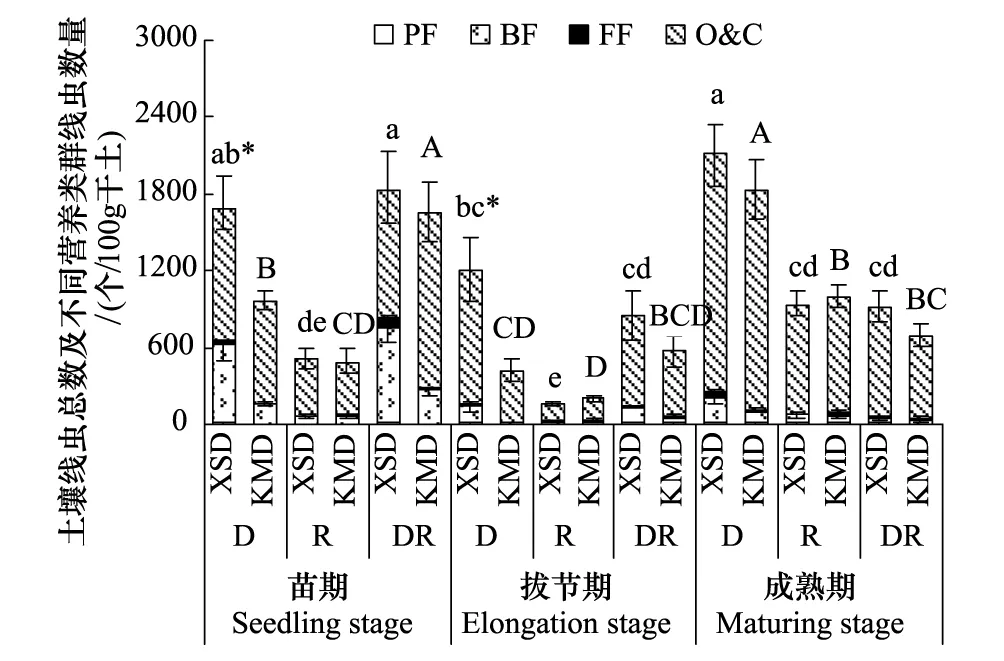
圖5 轉Bt水稻(KMD)及親本(XSD)對不同微域土壤線蟲總數和營養類群結構的影響(平均值±標準誤)Fig.5 Effects of transgenic Bt and non-Bt rice varieties on soil nematode abundance and trophic groups (mean±SE)
轉Bt水稻的種植增加了拔節期和成熟期R土壤的線蟲數量,但增量很小,在其他處理中線蟲數量均降低,并在苗期和拔節期的D土壤中達到顯著水平(P<0.05)(圖5)。在苗期和拔節期D土壤中KMD顯著降低了食微線蟲比例,在拔節期R土壤中顯著增加了植食線蟲比例。
非度量多變量排序(nMDS)結果表明,整個水稻生育期內、不同微域土壤中轉Bt水稻與親本相比線蟲群落結構無顯著差異(圖6),D和R土壤線蟲群落結構在3次采樣時間下區分明顯,說明D和R微域中采樣時間對線蟲群落結構的影響達到顯著水平(P<0.05,圖6a,b);拔節期和成熟期的根際-凋落物際(DR)土壤線蟲群落結構區分不明顯(圖6c)。而在苗期和拔節期,R處理與其他兩處理差異顯著,D和DR土壤中XSD和KMD區分明顯(圖6d,e);水稻成熟期時,D處理與其他兩處理差異顯著(圖6f)。
3 討論
3.1 轉Bt水稻對不同微域土壤Bt蛋白及可利用資源的影響
Bt殺蟲蛋白在土壤中能否長期殘留取決于Bt蛋白含量的釋放量、微生物降解速率和非生物的鈍化速率等[28- 29],一些研究發現轉Bt水稻殺蟲蛋白不會在土壤中積累[30- 31]。本實驗發現在水稻苗期和拔節期,KMD的凋落物際和交互微域土壤中Bt蛋白含量高于根際。這可能是由于水稻生長前期土壤中凋落物迅速分解,向土壤中釋放了少量的Bt蛋白[32]。而3個采樣時期KMD全部微域土壤之間的Bt蛋白含量無顯著差異,認為種植轉Bt水稻并不會造成土壤Bt蛋白含量的增加。轉Bt抗蟲水稻秸稈還田后只要經一定時間的充分降解,秸稈中的Bt蛋白一般不會在土壤中形成明顯的殘留[33- 34]。Saxena等[35]認為Bt蛋白的殘留視作物類型而定,一些抗蟲作物(如玉米、馬鈴薯等)通過根系分泌使土壤中有Cry蛋白,而Bt棉花、油菜和煙草卻沒有。

圖6 不同微域(a, b, c)和采樣時間(d, e, f)條件下土壤線蟲群落的非參數多變量排序圖Fig.6 Non-metric multidimensional scaling ordination of soil nematode community structure under different microsites (a,b,c) and sampling dates (d,e,f)
本研究發現土壤可溶性有機碳含量僅受到微域和采樣時間的顯著影響,而非水稻品種的影響。有機物與土壤的界面往往含有更高的來自凋落物和根系的可溶性碳氮資源[36- 37]。李修強等[38]通過連續兩年田間種植也沒有發現轉Bt水稻對土壤可溶性有機碳和氮產生持續的顯著影響,而采樣時間對其影響顯著,玉米的研究中也得到相同的結論[39- 40]。土壤礦質氮受采樣時間影響顯著,說明隨著水稻根系的生長,根際的效應逐漸強化,對土壤礦質氮的作用不斷加強。轉Bt水稻相比于親本對土壤礦質氮的影響因微域的不同而變化,推測由于水稻苗期根系不發達,且網袋內的凋落物迅速分解,到了成熟期水稻根系旺盛、凋落物分解漸緩,這兩個過程交互作用影響土壤礦質氮的變化。劉玲等[41]發現種植轉Bt玉米2個月左右后,根際土壤銨態氮含量較親本玉米顯著降低,硝態氮含量與親本無顯著差異。
3.2 轉Bt水稻對不同微域土壤微生物學性質的影響
土壤微生物生物量碳能夠快速反映土壤有機碳的數量和質量變化[42]。本研究結果表明轉Bt水稻顯著提高了苗期凋落物際土壤微生物生物量碳,而在水稻拔節期和成熟期顯著降低了根際土壤微生物生物量氮,可能是由于添加的轉Bt和親本水稻凋落物在有機物組成上的差異所致[20];上述結果也暗示轉Bt水稻種植后土壤微生物群落結構可能也發生了變化。李修強等[38]通過大田實驗發現,相比各自的親本,克螟稻和華恢1號顯著降低了苗期土壤MBC,而Bt汕優稻則效果相反;戚琳等[43]通過1a的田間實驗發現不同轉基因水稻品種對土壤微生物量的影響不同,種植HH1比親本水稻MH63顯著增加了土壤微生物生物量碳含量,而種植另外兩種轉Bt水稻T2A- 1和T1C- 19與親本相比沒有差異;3種轉Bt水稻種植后與親本相比對土壤微生物生物量氮含量沒有影響;而萬小羽等[44]和Sarkar等[45]均研究發現Bt棉花的根際土壤微生物生物量碳顯著高于對照。這些研究結果間的分歧說明土壤生物受到的影響因素非常復雜,尚不能確定是Bt蛋白的影響。
種植轉Bt水稻與親本水稻對土壤基礎呼吸無顯著影響,在其他植物(如玉米)上也發現了類似的結果[39- 45, 46]。但也有研究得出相反的結論,李修強等[38]研究發現轉Bt水稻與各自親本相比,對土壤基礎呼吸的影響達到顯著水平。本研究發現土壤中添加轉Bt水稻凋落物后,成熟期凋落物際土壤基礎呼吸與親本凋落物際存在顯著差異。這是因為凋落物是土壤生物可利用物質和能量的主要來源,添加的轉Bt和親本水稻凋落物在有機物組成不同,對凋落物際的微生物群落活性產生了不同的影響。土壤微生物代謝熵(qCO2)為土壤微生物呼吸釋放的CO2-C量與土壤微生物生物量碳的比值,其值的變化能夠反映土壤有機碳源的生物有效性或者微生物對有機碳的利用效率。土壤微生物代謝熵顯著受到水稻品種的影響,但各采樣時間內,轉Bt水稻對其影響不顯著,說明轉Bt水稻對土壤有機碳生物有效性及微生物碳源利用效率的影響主要依賴于水稻生長期和微域類型。
3.3 轉Bt水稻對不同微域土壤線蟲群落的影響
本研究發現苗期交互微域土壤線蟲總數顯著高于根際土壤,說明土壤中添加水稻凋落物顯著提高了苗期土壤線蟲總數,而在拔節期和成熟期,根際和交互微域土壤間各個水稻品種下線蟲總數無顯著差異,與微生物學性質變化的原因基本一致,推測在水稻成熟期由于凋落物處于分解的后期,凋落物際作用的弱化導致兩個處理間的差異逐漸消失[47- 48]。轉Bt水稻短期內對食微線蟲和植食線蟲的數量產生了顯著的影響,由于微域土壤內Bt蛋白含量的差異不明顯,上述結果更可能是由于轉Bt作物外源基因的插入導致根系分泌物成分發生變化,或作物生理生化性狀改變了土壤中化學物質的比例,進而影響線蟲群落的數量和組成[28]。轉Bt作物對土壤線蟲影響的研究有諸多不同結果,Griffiths等[16]發現在3個不同地點大田種植Bt玉米與非Bt玉米相比,線蟲數量表現出顯著而短暫的降低趨勢,而溫室實驗結論相反[49]。戚琳等[43]發現田間種植轉Bt與非Bt水稻,二者土壤線蟲總數無顯著差異,植食線蟲和捕食/雜食線蟲的比例增加。李修強等[8]發現各采樣時期BtSY63和SY63土壤線蟲數量差異均未達到顯著水平,而線蟲群落的Shannon多樣性指數、線蟲通道指數和成熟度指數均受采樣時間影響顯著。此外,不同作物種類、土壤類型、氣候條件和土樣采集方式對土壤線蟲群落也存在影響,今后仍需長期定位實驗才能更全面系統地評價轉Bt水稻對土壤非靶標生物的影響。
4 結論
轉Bt水稻對線蟲群落結構的影響依賴于水稻生育期和微域的差異,土壤有效資源、微生物學性質和線蟲總數及群落結構受到的顯著影響更主要是來源于微域及微域間的交互作用。伴隨水稻的生長及分解進程,根際的作用逐漸加強,而凋落物際的作用減弱。這兩個過程共同影響微域內土壤生物群落的數量和活性。轉Bt水稻與親本相比,對根際土壤微生物生物量氮、硝態氮和凋落物際土壤的微生物生物量碳、基礎呼吸、可溶性有機氮的影響達到顯著水平。轉Bt水稻總體上降低了線蟲的數量,尤其在苗期和拔節期的凋落物際土壤中達到顯著水平;苗期凋落物際和交互微域內土壤食微線蟲數量受水稻品種的顯著影響。由于根系和凋落物是作物直接影響土壤群落的重要因素,因此結合二者進行評價能夠更全面地反映和預警轉Bt作物對土壤生物的影響。今后有必要結合大田以及微域實驗的長期研究,以評估轉基因作物對土壤非靶標生物群落的生態風險。
[1] 韓蘭芝, 吳孔明, 彭于發, 郭予元. 轉基因抗蟲水稻生態安全性研究進展. 應用與環境生物學報, 2006, 12(3): 431- 436.
[2] 賈乾濤, 石尚柏, 楊長舉, 彭于發. 轉Bt基因水稻生長期幾種重要成分含量的變化研究. 中國農業科學, 2005, 38(10): 2002- 2006.
[3] 徐雪亮, 韓宇, 吳剛, 蔡萬倫, 袁本琦, 王暉, 劉方舟, 王滿囷, 華紅霞. 轉cry1Ab/1Ac, cry1C, cry2A基因水稻對田間稻縱卷葉螟及其捕食類天敵的影響. 中國科學(生命科學), 2011, 41(11): 1095- 1104.
[4] Chen M, Liu Z C, Ye G Y, Shen Z C, Hu C, Peng Y F, Altosaar I, Shelton A M. Impacts of transgeniccry1Abrice on non-target planthoppers and their main predatorCyrtorhinuslividipennis(Hemiptera: Miridae) —A case study of the compatibility ofBtrice with biological control. Biological Control, 2007, 42(2): 242- 250.
[5] 王園園, 李云河, 陳秀萍, 武紅巾, 彭于發. 抗蟲轉基因植物對非靶標節肢動物生態影響的研究進展. 生物安全學報, 2011, 20(2): 100- 107.
[6] 袁一楊, 戈峰. 轉Bt基因作物對非靶標土壤動物的影響. 應用生態學報, 2010, 21(5): 1339- 1345.
[7] Bai Y Y, Yan R H, Ke X, Ye G Y, Huang F N, Luo Y M, Cheng J A. Effects of transgenicBtrice on growth, reproduction, and superoxide dismutase Activity ofFolsomiacandida(Collembola: Isotomidae) in laboratory studies. Journal of Economic Entomology, 2011, 104(6): 1892- 1899.
[8] 李修強, 陳法軍, 劉滿強, 陳小云, 胡鋒. 轉基因水稻Bt汕優63種植兩年對土壤線蟲群落的影響. 應用生態學報, 2012, 23(11): 3065- 3071.
[9] Lundgren J G, Gassmann A J, Bernalc J, Duan J J, Ruberson J. Ecological compatibility of GM crops and biological control. Crop Protection, 2009, 28(12): 1017- 1030.
[10] Then C. Risk assessment of toxins derived fromBacillusthuringiensis-synergism, efficacy, and selectivity. Environmental Science and Pollution Research, 2010, 17(3): 791- 797.
[11] 邵元虎, 傅聲雷. 試論土壤線蟲多樣性在生態系統中的作用. 生物多樣性, 2007, 15(2): 116- 123.
[12] Neher D A. Role of nematodes in soil health and their use as indicators. Journal of Nematology, 2001, 33(4): 161- 168.
[13] Yeates G W. Nematodes as soil indicators: functional and biodiversity aspects. Biology and Fertility of Soils, 2003, 37(4): 199- 210.
[14] 陳小云, 劉滿強, 胡鋒, 毛小芳, 李輝信. 根際微型土壤動物——原生動物和線蟲的生態功能. 生態學報, 2007, 27(8): 3132- 3143.
[15] Chen M, Ye G Y, Liu Z C, Fang Q, Hu C, Peng Y F, Shelton A M. Analysis ofCry1Abtoxin bioaccumulation in a food chain ofBtrice, an herbivore and a predator. Ecotoxicology, 2009, 18(2): 230- 238.
[16] Griffiths B S, Caul S, Thompson J, Birch A N E, Scrimgeour C, Andersen M N, Cortet J, Messean A, Sausse C, Lacroix B, Krogh P H. A comparison of soil microbial community structure, protozoa, and nematodes in field plots of conventional and genetically modified maize expressing theBacillusthuringiensisCry1Ab toxin. Plant and Soil, 2005, 275(1/2): 135- 146.
[17] Saxena D, Stotzky G.Bacillusthuringiensis(Bt) toxin released from root exudates and biomass ofBtcorn has no apparent effect on earthworms, nematodes, protozoa, bacteria, and fungi in soil. Soil Biology and Biochemistry, 2001, 33(9): 1225- 1230.
[18] H?ss S, Nguyen H, Pagel-Menzel R, Pagel-Wieder S, Miethling-Graf R, Tebbe C C, Jehle J A, Traunspurger W. Assessing the risk posed to free-living soil nematodes by a genetically modified maize expressing the insecticidal Cry3Bb1 protein. Science of the Total Environment, 2011, 409(13): 2674- 2684.
[19] Mina U, Chaudhary A, Kamra A. Effect ofBtcotton on enzymes activity and microorganisms in rhizosphere. Journal of Agricultural Science, 2011, 3(1): 96- 104.
[20] Marschner P, Marhan S, Kandeler E. Microscale distribution and function of soil microorganisms in the interface between rhizosphere and detritusphere. Soil Biology and Biochemistry, 2012, 49: 174- 183.
[21] Ingwersen J, Poll C, Streck T, Kandeler E. Micro-scale modelling of carbon turnover driven by microbial succession at a biogeochemical interface. Soil Biology and Biochemistry, 2008, 40(4): 864-878.
[22] Gaillard V, Chenu C, Recous S. Carbon mineralisation in soil adjacent to plant residues of contrasting biochemical quality. Soil Biology and Biochemistry, 2003, 35(1): 93- 99.
[23] Bonkowski M, Villenave C, Griffiths B S. Rhizosphere fauna: The functional and structural diversity of intimate interactions of soil fauna with plant roots. Plant and Soil, 2009, 321(1/2): 213- 233.
[24] 魯如坤. 土壤農業化學分析方法. 北京: 中國農業科技出版社, 1999.
[25] 劉滿強, 黃菁華, 陳小云, 王峰, 葛成, 蘇昱, 邵波, 湯英, 李輝信, 胡鋒. 地上部植食者褐飛虱對不同水稻品種土壤線蟲群落的影響. 生物多樣性, 2009, 17(5): 431- 439.
[26] Bongers T, Ferris H. Nematode community structure as a bioindicator in environmental monitoring. Trends in Ecology and Evolution, 1999, 14(6): 224- 228.
[27] Ferris H, Bongers T, de Goede R G M. A framework for soil food web diagnostics: Extension of the nematode faunal analysis concept. Applied Soil Ecology, 2001, 18(1): 13- 29.
[28] Icoz I, Stotzky G. Fate and effects of insect-resistantBtcrops in soil ecosystems. Soil Biology and Biochemistry, 2008, 40(3): 559- 586.
[29] 王建武, 駱世明, 馮遠嬌, Nakatsu C. 轉Bt基因作物Bt毒素在土壤中的環境去向及其生態效應. 生態學報, 2003, 23(4): 797-804.
[30] 張燕飛, 岳龍, 張素芬, 沈佳君, 付秋果, 李菊英, 汪海燕, 葉慶富.Bt水稻殺蟲蛋白時空變化及秸稈還田后在土壤中的持留規律. 核農學報, 2011, 25(4): 779- 784.
[31] Wang H Y, Ye Q F, Wang W, Wu L C, Wu W X. Cry1Ab protein fromBttransgenic rice does not residue in rhizosphere soil. Environmental Pollution, 2006, 143(3): 449- 455.
[32] 付慶靈, 陳愫惋, 胡紅青, 李珍, 韓曉芳, 王樸. 種植轉Bt基因棉土壤中Bt蛋白的分布. 應用生態學報, 2011, 22(6): 1493- 1498.
[33] Ahmad A, Wilde G E, Zhu K Y. Detectability of coleopteran-specific Cry3Bb1 protein in soil and its effect on nontarget surface and below-ground arthropods. Environmental Entomology, 2005, 34(2): 385- 394.
[34] Icoz I, Stotzky G. Cry3Bb1 protein fromBacillusthuringiensisin root exudates and biomass of transgenic corn does not persist in soil. Transgenic Research, 2008, 17(4): 609- 620.
[35] Saxena D, Stewart C N, Altosaar I, Shu Q, Stotzky G. Larvicidal Cry proteins fromBacillusthuringiensisare released in root exudates of transgenicB.thuringiensiscorn, potato, and rice but not ofB.thuringiensiscanola, cotton, and tobacco. Plant Physiology and Biochemistry, 2004, 42(5): 383- 387.
[36] Appuhn A, Joergensen R G. Microbial colonisation of roots as a function of plant species. Soil Biology and Biochemistry, 2006, 38(5): 1040- 1051.
[37] Poll C, Marhan S, Ingwersen J, Kandeler E. Dynamics of litter carbon turnover and microbial abundance in a rye detritusphere. Soil Biology and Biochemistry, 2008, 40(6): 1306- 1321.
[38] 李修強, 陳法軍, 劉滿強, 胡鋒. 轉Bt水稻對土壤可溶性有機碳氮及微生物學性質的影響. 應用生態學報, 2012, 23(1): 96- 102.
[39] 王建武, 馮遠嬌. 種植Bt玉米對土壤微生物活性和肥力的影響. 生態學報, 2005, 25(5): 1213- 1220.
[40] Mungai N W, Motavalli P P, Nelson K A, Kremer R J. Differences in yields, residue composition and N mineralization dynamics ofBt- and non-Btmaize. Nutrient Cycling in Agroecosystems, 2005, 73(1): 101- 109.
[41] 劉玲, 趙建寧, 李剛, 楊殿林, 王生榮, 娜布其, 娜日蘇. 轉Bt玉米對土壤酶活性及速效養分的影響. 土壤, 2012, 44(1): 167- 171.
[42] 胡亞林, 汪思龍, 黃宇, 于小軍. 凋落物化學組成對土壤微生物學性狀及土壤酶活性的影響. 生態學報, 2005, 25(10): 2662- 2668.
[43] 戚琳, 陳法軍, 劉滿強, 陳小云, 祝向鈺, 李輝信, 胡鋒. 三種轉Bt水稻短期種植對土壤微生物生物量和線蟲群落的影響. 生態學雜志, 2013, 32(4): 975- 980.
[44] 萬小羽, 梁永超, 李忠佩, 宋阿琳, 婁運生. 種植轉Bt基因抗蟲棉對土壤生物學活性的影響. 生態學報, 2007, 27(12): 5414- 5420.
[45] Sarkar B, Patra A K, Purakayastha T J, Megharaj M. Assessment of biological and biochemical indicators in soil under transgenicBtand non-Btcotton crop in a sub-tropical environment. Environmental Monitoring and Assessment, 2009, 156(1/4): 595- 604.
[46] Raubuch M, Behr K, Roose K, Joergensen R G. Specific respiration rates, adenylates, and energy budgets of soil microorganisms after addition of transgenicBt-maize straw. Pedobiologia, 2010, 53(3): 191- 196.
[47] Flores S, Saxena D, Stotzky G. TransgenicBtplants decompose less in soil than non-Btplants. Soil Biology and Biochemistry, 2005, 37(6): 1073- 1082.
[48] Poerschmann J, Gathmann A, Augustin J, Langer U, Górecki T. Molecular composition of leaves and stems of genetically modifiedBtand near-isogenic non-Btmaize-characterization of lignin patterns. Journal of Environmental Quality, 2005, 34(5): 1508- 1518.
[49] Griffiths B S, Caul S, Thompson J, Birch A N E, Scrimgeour C, Cortet J, Foggo A, Hackett C A, Krogh P H, Soil microbial and faunal community responses toBtmaize and insecticide in two soils. Journal of Environmental Quality, 2006, 35(3): 734- 741.
Influences of rhizosphere and detritusphere ofBtrice on soil nematode communities
QI Lin1, LIU Manqiang1,2,*, JIANG Linhui1, ZHANG Jianqiao1, LI Xiuqiang1, CHEN Fajun3, HU Feng1
1SoilEcologyLab,CollegeofResourcesandEnvironmentalSciences,NanjingAgriculturalUniversity,Nanjing210095,China2StateKeyLaboratoryofSoilandSustainableAgriculture,InstituteofSoilScience,ChineseAcademyofSciences,Nanjing210008,China3DepartmentofEntomology,CollegeofPlantProtection,NanjingAgriculturalUniversity,Nanjing210095,China
It is important to evaluate the ecological risks of transgenicBtrice on soil non-target organisms before it is widely released in the market. Rhizosphere and detritusphere formed by plant roots and organic residues that contact soil directly, and represent two distinct microsites that are highly affected by plants. Pot experiments were established to investigate the effects of rice, a variety genetically modified to express theBtprotein, KMD, and its parental line, XSD, on soil chemical, microbial properties and nematode assemblages of the two microsites. Results indicated that effects of transgenicBtrice on soil properties varied with plant growth stage and microsite type. Compared with XSD, KMD increased the concentrations of soil dissolved organic nitrogen in detritusphere (D) at seedling and elongation stages, whereas the concentrations of ammonium in the detritusphere were decreased significantly by KMD at seedling stage (P<0.05). At maturing stage, KMD increased the concentrations of ammonium in the detritusphere and overlapped microsite (DR, i.e. the area that affected by both rhizosphere and detritusphere) significantly (P<0.05). With regard to soil microbial biomass, KMD significantly increased the concentrations of soil microbial biomass carbon (MBC) in detritusphere at seedling and maturing stages (P<0.05), whereas significantly decreased microbial biomass nitrogen (MBN) in rhizosphere at elongation and maturing stages (P<0.05). Integrated effects of the two microsites had a significant effect on concentrations of microbial biomass carbon and nitrogen as well as dissolved organic matter, total nematode numbers and nematode numbers of different feeding groups (P<0.05). Generally, KMD decreased the total nematode numbers, especially there were significantly fewer nematodes in the detritusphere of KMD than XSD at seedling and elongation stages (P<0.05). Repeated-measure ANOVA indicated that transgenicBtrice KMD had significant effects on numbers of bacterial feeders (P<0.01) and fungal feeders (P<0.05), nematode channel ratio (NCR) and enrichment index (EI). In addition, the genetically modified KMD significantly decreased (P<0.05) the proportions of bacterial feeders and fungal feeders in detritusphere at seedling and elongation stages, and such trends were consistent to the responses of ammonium concentrations of the same microsite and growth stage. In light of soilBtprotein concentrations under KMD treatments after maturing stage,Btrice showed no significant effect, though the content ofBtprotein in straw of KMD was significantly higher than that of XSD, indicating that significant differences of effects of KMD from XSD might not result fromBtprotein itself, but from the difference of other traits such as rice growth and residue chemical composition. Together, we found that microsite studies combining the rhizosphere and detritusphere would facilitate to demonstrate the responses of soil microbial properties and nematode assemblages to explore the ecological impacts and mechanisms of growing genetically modified rice.
transgenicBtrice; rhizosphere; detrisphere;Btprotein; nematode assemblage
土壤與農業可持續發展國家重點實驗室開放課題(0812201218); 轉基因生物新品種培育重大專項(2013ZX08012- 005); 南京農業大學SRT項目(201206); 江蘇高校優勢學科(PAPD)
2013- 05- 14;
日期:2014- 04- 17
10.5846/stxb201305141061
*通訊作者Corresponding author.E-mail: liumq@njau.edu.cn
戚琳,劉滿強,蔣林惠,張楗嶠,李修強,陳法軍,胡鋒.基于根際與凋落物際評價轉Bt水稻對土壤線蟲群落的影響.生態學報,2015,35(5):1434- 1444.
Qi L, Liu M Q, Jiang L H, Zhang J Q, Li X Q, Chen F J, Hu F.Influences of rhizosphere and detritusphere ofBtrice on soil nematode communities.Acta Ecologica Sinica,2015,35(5):1434- 1444.

