抗心律失常肽對抗柯薩奇B3病毒的體外研究*
伍 瓊,盛 蕾,洪李鋒(湖北省武漢市第五醫院心血管內科/武漢大學廣慈醫院心血管內科/江漢大學心血管研究所 430050)
?
抗心律失常肽對抗柯薩奇B3病毒的體外研究*
伍 瓊,盛 蕾△,洪李鋒(湖北省武漢市第五醫院心血管內科/武漢大學廣慈醫院心血管內科/江漢大學心血管研究所 430050)
目的 觀察抗心律失常肽(AAP10)對柯薩奇B3病毒(CVB3)感染的原代小鼠心肌細胞的保護作用。方法 將BALB/C小鼠原代心肌細胞分為7組,每組12孔,分別為細胞對照組,病毒對照組,藥物干預組(A組、B組、C組、D組、E組)。用不同濃度的AAP10培養液干預100 TCID50 CVB3感染的心肌細胞,對比每組的細胞活性。結果 藥物干預組細胞活性高于病毒對照組(F=7.489,P<0.05)。其細胞活性與藥物濃度(r=0.942,P=0.005)及作用時間(r=0.993,P<0.05)均呈正相關。結論 AAP10具有明顯的抗病毒活性,呈劑量時間相關性,對CVB3感染的心肌細胞有保護作用。
抗心律失常肽; 柯薩奇B3病毒; 原代心肌細胞
抗心律失常肽(AAP10)是人們最早從牛心房肌中分離提取的由6個氨基酸組成的物質,經人工合成為具有生物活性的小分子內分泌激素即AAP10,它可以通過調節細胞間的縫隙連接通道,介導第二信使物質,影響心肌組織的分化、心肌細胞的生長和凋亡,同時具有抗心律失常、抗栓,改善心肌缺血,預防心肌病及心力衰竭的作用[1]。臨床上病毒性心肌炎是以柯薩奇病毒(A組和B組)、腺病毒、巨細胞病毒、脊髓灰質炎病毒和流感病毒較常見。臨床觀察到SARS冠狀病毒和最近流行的甲型H1N1新型病毒也可致病毒性心肌炎,心肌炎呈現急性或慢性過程。輕可無癥狀,重至彌漫性心肌炎引起爆發性、致命性、充血性心力衰竭及嚴重的惡性心律失常[2]。本研究通過建立柯薩奇B3病毒(CVB3)感染所致的心肌細胞損傷體外模型,觀察AAP10抗病毒活性,為臨床治療病毒性心肌炎提供理論基礎。
1 材料與方法
1.1 儀器與試劑 二氧化碳細胞培養箱(MODEL2300 SHELAB,美國);倒置顯微鏡(NikonT300,日本);臺式高速離心機(TGL-16C,上海安亭科學儀器廠);酶聯免疫檢測儀(北京元業伯樂科技發展有限公司);電熱恒溫水浴鍋(北京市醫療設備廠);生物安全柜(Costar公司,美國);電子天平(上海精密科學儀器公司天平儀器廠)等。胰蛋白酶(HyClone公司);MEM營養液,含10%的胎牛血清、谷氨酰胺2 mmol/L、青霉素100 U/mL、鏈霉素100 μg/mL(HyClone公司);臺盼藍(Sigma公司);AAP10(產品號:809838,杭州中肽生化有限公司)。
1.2 實驗病毒 CVB3(武漢大學病毒研究所)經人宮頸癌細胞(Hela細胞,CTCC提供)培養擴增后,用Read-Much公式計算TCID50為:10-3.8/0.1 mL,小量分裝在-80 ℃低溫冰箱保存備用。
1.3 實驗細胞 原代小鼠心肌細胞(江陰齊氏生物科技有限公司)。
1.4 方法
1.4.1 AAP10對CVB3的抑制作用 單層培養好的原代小鼠心肌細胞分為3組,細胞對照組、病毒對照組、藥物干預組,每組12孔。其中藥物干預組根據濃度梯度分為:A組、B組、C組、D組、E組。96孔板中每孔加入5×104的小鼠原代心肌細胞,培養48 h,細胞長成單層后,除細胞對照組外,其余各組均給予0.1 mL/孔含100 TCID50的CVB3病毒維持液,干預組分別再給予0.1 mL/孔的含5、10、15、20、25 μg/mL濃度的AAP10維持液,置5%CO237 ℃培養箱繼續培養。
1.4.2 心肌細胞搏動頻率、存活率及病毒抑制率的測定 在倒置顯微鏡下觀察細胞形態及生長狀態。用四氮唑鹽(MTT)法測各孔在570 nm波長下第6、12、18、24、30、36、42、48小時的吸光度,即A值,觀察細胞活性與時間的相關性。按下述公式計算第24小時的細胞存活率及病毒抑制率,隨機計數自發搏動頻率。細胞存活率(%)=(藥物組A值/對照組A值)×100%,病毒抑制率(%)=(藥物處理組平均A值-病毒對照組平均A值)/(正常對照組平均A值-病毒對照組平均A值)×100%[3]。

2 結 果
2.1 AAP10干預后心肌細胞形態觀察 干預后觀察到第24小時,病毒對照組細胞損傷壞死明顯,圓縮脫落,大部分漂浮在培養液中,藥物干預組細胞可保持部分貼壁生長,藥物濃度較高組,細胞形態相對完整,搏動相對有力,頻率較快,隨時間推移,到第36~48小時,細胞生長狀態逐漸穩定,無進一步損傷壞死。
2.2 心肌細胞活性、搏動頻率、存活率及病毒抑制率的測定 藥物干預24 h后B、C、D、E組心肌細胞活性、搏動頻率、D及E組心肌細胞存活率以及病毒抑制率均與病毒對照組比較,差異有統計學意義,見表1。

表1 干預后第24小時各組心肌細胞情況比較±s)
注:與病毒對照組相比,※★P<0.05。

表2 藥物干預組心肌細胞活性與藥物作用時間線性相關回歸分析
注:-表示無數據。

圖1 AAP10作用時間細胞活性曲線
2.3 心肌細胞活性時間曲線、藥物濃度曲線及相關關系 A組細胞活性與時間無相關性(r=0.513,P=0.193),當AAP10干預濃度較高(B、C、D、E組)時,心肌細胞活性與藥物作用時間呈線性正相關,見表2、圖1;選取干預24 h觀察心肌細胞活性與藥物濃度的關系,發現兩者呈正相關(r=0.942,P=0.005,r2=0.888),見圖2。
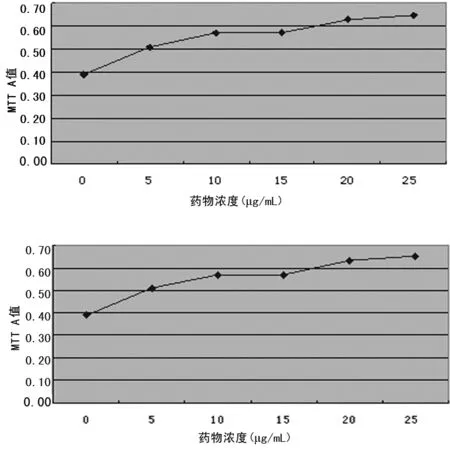
圖2 AAP10作用24 h藥物濃度細胞活性曲線
3 討 論
CVB3是臨床上最常見的引起病毒性心肌炎的微生物,病毒感染心肌細胞后,在心肌組織內復制引起的損傷以及同時介導自身免疫反應引起的免疫損傷是其主要發病機制[3-4]。國外基礎研究發現,40歲以下有接近20%的患者死于CVB3感染所致的病毒性心肌炎。在這個過程中,TLR3-IFNβ介導的免疫反應是主要的發病機制之一,蛋白酶激活受體則可通過增加及抑制效應來調節該受體的表達。臨床上對該病較難確診,心肌活檢是目前惟一有效的方法,大多數患者難以接受,Omura等[5]通過生物信息研究分析病毒性心肌炎小鼠模型可能的檢測指標來為臨床提供信息。Schumm等[6]則首次將1例通過心肌活檢確診的急性病毒性心肌炎患者繪制T1圖像,作為一種新的檢測手段指導臨床應用。在治療方面,國外有研究通過開發誘導多功能干細胞移植術來治療傳染性的病毒性心肌炎,也有通過激活基質金屬蛋白酶的表達來治療該病[7-8]。國內最新研究報道,通過注射特定的DNA疫苗來增強靶細胞免疫系統以及對抗病毒的保護能力進行治療[9]。
AAP10作為一種人工合成的多肽,具有調節心肌細胞代謝,減輕壞死程度及延緩凋亡的作用,對于急性缺氧的乳鼠心肌細胞的體外研究中具有顯著的心肌細胞保護作用。2009年,有學者發現AAP10具有增強細胞間傳導,抑制細胞間的解耦聯,其作用部位是心肌細胞間漿膜下的縫隙連接蛋白Cx43、Cx45,而非Cx40。另有研究發現,AAP10可通過增加縫隙鏈接蛋白的耦聯作用來抵抗并預防抗心律失常藥物引發的尖端流轉型室速的發生[10]。同時,Johnstone等[11]報道,AAP10能用于治療心律失常的機制主要是通過促使縫隙連接蛋白Cx43的表達來延長細胞有絲分裂及細胞周期,而并非是調節心肌細胞間潤盤的連接通道功能來完成這一過程。還有研究報道,在缺血再灌注的小鼠模型中AAP10缺血后處理可大大減少細胞間解耦聯以及抑制室性心律失常的發生。而2008年發表在我國臨床心血管病雜志上的1篇報道是基于兔肥厚型心肌病模型的建立上,發現AAP10可通過顯著改善縫隙連接蛋白的分布來達到改善心肌細胞的重構,防止Cx43排列紊亂,從而降低心律失常的發生率。因此,大多數研究認為AAP10作為一種新型的抗心律失常藥物可逐漸替代目前市場上已有的抗心律失常藥物,避免其嚴重不良反應的發生,而且對于缺血性心肌病、慢性房顫所致的獨特性的心肌損害有較為肯定的保護作用[12]。少數研究也發現,Cx43表達水平是冠狀動脈閉塞后心肌梗死面積大小的一個關鍵因素,通過增強細胞間傳導來降低心律失常發生的藥物(如AAP10)可能會增大心肌梗死的面積;而有報道,縫隙連接阻滯劑可以減少心肌梗死面積和心肌局部缺血性室性心律失常的發生,故在AAP10的研究及使用上值得進一步探討。
病毒性心肌炎患者由于病毒感染或病毒感染后免疫反應引起的彌漫性或灶性心肌間質的炎性細胞浸潤和鄰近的心肌纖維壞死或退行性變,導致不同程度的心功能障礙[13]。整個過程很有可能直接影響心肌細胞間的縫隙連接通道,并影響縫隙連接蛋白的正常表達及分布。從而推測AAP10作為一種心肌保護劑及縫隙連接蛋白激動劑,給予一定的干預后可明顯保護心肌,減少損傷,促使細胞膜上縫隙連接蛋白的正常表達及分布,從而對抗病毒感染所致的心肌損害。本文通過建立CVB3感染小鼠原代心肌細胞的模型,來觀察給予AAP10藥物之后心肌細胞的改變,發現AAP10藥物干預組的心肌細胞受CVB3的損害明顯減少,其減輕程度與藥物濃度及作用時間呈正相關。體外研究中達到10 μg/mL以上的AAP10作用24 h后開始體現出抗病毒活性,而20 μg/mL的AAP10作用24 h后就可明顯增加細胞存活率及病毒抑制率。因此,AAP10有明確的抵抗CVB3對心肌細胞造成的損害過程,這對于AAP10的藥理學及毒理學的研究具有參考價值,并對將來應用于臨床上病毒性心肌炎的治療提供理論基礎。
[1]陳孝麗.病毒性心肌炎診治新進展[J].中外健康文摘,2013,10(28):7-9.
[2]許茸茸,李應東,劉凱,等.當歸紅芪超濾膜提取物對阿霉素致心肌細胞凋亡的影響[J].中國實驗方劑學雜志,2013,19(15):232-236.
[3]Zhang YY,Li JN,Xia HH,et al.Protective effects of losartan in mice with chronic viral myocarditis induced by coxsackievirus B3[J].Life Sci,2013,92(24/26):1186-1194.
[4]Kong Q,Wu W,Yang F,et al.Increased expressions of IL-22 and Th22 cells in the coxsackievirus B3-Induced mice acute viral myocarditis[J].Virol J,2012,9(10):232-235.
[5]Omura S,Kawai E,Sato F,et al.Bioinformatics multivariate analysis determined a set of phase-specific biomarker candidates in a novel mouse model for viral myocarditis[J].Circ Cardiovasc Genet,2014,7(4):444-454.
[6]Schumm J,Greulich S,Sechtem U,et al.T1 mapping as new diagnostic technique in a case of acute onset of biopsy-proven viral myocarditis[J].Clin Res Cardiol,2014,103(5):405-408.
[7]Sinnecker D,Laugwitz KL,Moretti A.Extending human induced pluripotent stem cell technology to infectious diseases:new model for viral myocarditis[J].Circ Res,2014,115(6):537-539.
[8]Hendry RG,Bilawchuk LM,Marchant DJ.Targeting matrix metalloproteinase activity and expression for the treatment of viral myocarditis[J].J Cardiovasc Transl Res,2014,7(2):212-215.
[9]Ye T,Yue Y,Fan X,et al.M cell-targeting strategy facilitates mucosal immune response and enhances protection against CVB3-induced viral myocarditis elicited by chitosan-DNA vaccine[J].Vaccine,2014,32(35):4457-4465.
[10]Ruan L,Quan X,Li L,et al.Increasing gap junction coupling suppresses ibutilide-induced torsades de pointes[J].Exp Ther Med,2014,7(5):1279-1284.
[11]Johnstone SR,Best AK,Wright CS,et al.Enhanced connexin 43 expression delays intra-mitotic duration and cell cycle traverse independently of gap junction channel function[J].J Cell Biochem,2010,110(3):772-782.
[12]Dhein S,Hagen A,Jozwiak J,et al.Improving cardiac gap junction communication as a new antiarrhythmic mechanism:the action of antiarrhythmic peptides[J].Naunyn Schmiedebergs Arch Pharmacol,2010,381(3):221-234.
[13]陳元元,范曉晨.自身免疫機制在病毒性心肌炎中的作用[J].安徽醫學,2014,35(5):704-706.
The vitro study of anti-arrhythmic peptide against coxsackie B3 virus*
WUQiong,SHENGLei△,HONGLi-feng
(DepartmentofCardiology,theFifthHospitalofWuhanCity/DepartmentofCardiology,MercyHospitalofWuhanUniversity/InstituteofCardiovascularSciencesofJianghanUniversity,Wuhan430050,China)
Objective To observe the anti-arrhythmic peptide 10(AAP10) against coxsackie virus B3 (CVB3) damage to the generation of myocardial cells in mice.Methods BALB/C mice primary myocardial cells can be divided into 7 groups,each group of 12 holes:the cell control group,the virus control group,and drug intervention group(five different concentrations).Myocardial cells of 100 TCID50 CVB3 were interventied with different concentrations of AAP10.Cell damage degree among each group were contrasted.Results Myocardial activity has a positive correlation with the drug concentration (r=0.942,P=0.005,r2=0.888) and action time(r=0.993,P<0.05).Myocardial activity in intervention group is significantly higher than virus control group(F=7.489,P<0.05).Conclusion AAP10 has obvious antiviral activity in vitro,which has a correlation with drug and action time.AAP10 can protect myocardial cell infected by CVB3 in vitro.
anti-arrhythmic peptide; coxsackie virus B3; primary cardiac myocyte
湖北省武漢市漢陽區科學技術局計劃項目[陽科(2011)11號]。
伍瓊,女,主治醫師,碩士,主要從事心臟病毒學及分子生物學方面的研究。△
,E-mail:309325285@qq.com。
10.3969/j.issn.1672-9455.2015.08.012
A
1672-9455(2015)08-1056-03
2014-11-15
2014-12-01)

