血管緊張素轉換酶對于乙肝患者肝纖維化水平的臨床評價
柴云飛(湖北省荊門市康復醫院檢驗科 448000)
?
血管緊張素轉換酶對于乙肝患者肝纖維化水平的臨床評價
柴云飛(湖北省荊門市康復醫院檢驗科 448000)
目的 研究血清血管緊張素轉換酶對乙肝患者肝纖維化水平的診斷價值。方法 選取2013~2014年于荊門市康復醫院就診并被確診為慢性乙型肝炎的患者62例和40例健康人,進行實驗室和肝臟活組織檢查。分析并評價相關指標對乙肝患者肝纖維化的診斷價值。結果 乙肝組患者丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)和血管緊張素轉換酶(ACE)水平均高于健康人組,差異均有統計學意義(PALT=0.023,PAST=0.042,PACE=0.004)。乙肝患者纖維化早期(S1~2期)患者ALT、AST和血小板與中、晚期(S3~4期)患者差異無統計學意義(P>0.05),血小板比值指數(APRI)和ACE水平均低于纖維化中、晚期(S3~4期)患者,差異有統計學意義(P<0.05)。相關性分析顯示,ACE水平與APRI呈正相關(r=0.48,P<0.05)。ACE對肝纖維化患者的診斷曲線下面積(AUC)為0.801(95%CI:0.706~0.896,P<0.05),高于APRI對肝纖維化(AUC:0.676,95%CI:0.563~0.789,P<0.05)。當ACE為48 U/L時,診斷靈敏度為68%,特異性為71%。結論 血清ACE升高能夠反映乙肝患者纖維化的發生和發展,有望成為乙肝肝纖維化血清學輔助診斷指標。
乙型肝炎; 肝纖維化; 血管緊張素轉化酶
乙型肝炎為世界慢性感染性疾病,影響人口超過3億。乙型肝炎感染后發展為急性或慢性肝炎,肝組織反復受損修復后逐漸發展為肝纖維化,進一步發展為肝硬化和肝癌。盡管多數研究認為,性別、病毒的基因型和病毒載量等因素成為乙型肝炎惡化的潛在風險因子,但是仍有其他因素影響疾病的進展。肝臟活組織檢查是肝纖維化診斷的金標準,但其為有創性檢查,臨床應用受到局限[1]。因此,研究者更著重于尋找其他能夠反映肝纖維化的無創血清學診斷指標。盡管有研究試圖通過多項血清指標聯合建立無創診斷模型來評價肝纖維化的程度,以期早期發現肝纖維化,但是此類無創診斷模型的臨床價值仍不十分肯定。腎素-血管緊張素-醛固酮系統(RAS)調節人類的血壓、體液和電解質平衡。近幾年,RAS系統在許多疾病的發病機制中被闡述,其中血管緊張素轉換酶(ACE)作為RAS系統重要的參與分子,在肝臟疾病的發病機制中起重要作用。因此,本研究旨在檢測乙肝患者血清ACE水平,通過比較不同程度肝纖維化的乙肝患者血清中ACE水平,并與常見無創診斷模型血小板比值指數(APRI)進行比較,探討血清ACE對乙肝患者肝纖維化的診斷價值,現將有關情況報道如下。
1 資料與方法
1.1 一般資料 選取2013~2014年于本院就診并被確診為慢性乙型肝炎的患者62例,其中男36例,女26例,平均年齡(32.6±7.2)歲。患者均根據2010年中華醫學會制定的慢性乙型肝炎防治指南的診斷標準進行確診[2]。排除合并其他病毒性或自身免疫性肝炎、脂肪肝、惡性消耗性疾病的患者,妊娠或哺乳期的婦女。同期納入40例健康人作為健康對照組,健康對照組排除病毒性或自身免疫性肝炎、脂肪肝、肝硬化、急性肝損傷和肝癌等肝臟損傷性疾病,其中男26例,女14例,平均年齡(32.7±5.8)歲。研究對象全部簽署知情同意書,經本院倫理委員會批準通過。
1.2 方法 所有研究對象禁食8 h后抽取清晨空腹靜脈血5 mL后,立即分離血清,-80 ℃保存待測。常規檢查包括:(1)體質量指數(BMI);(2)丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、γ-谷氨酰轉移酶(GGT)和堿性磷酸酶(ALP);(3)HBV-DNA;(4)血小板(PLT)。血清ACE水平經FAPGG連續監測法檢測,試劑盒購自羅氏公司,操作嚴格遵循說明書。對乙肝患者進行肝纖維化血清學評價,計算APRI,APRI=AST/PLT×100[3]。乙肝患者另行肝臟活組織檢查,纖維化程度根據活組織檢查結果確診。
1.3 診斷標準 肝活組織檢查后,收集的肝組織標本經10%的中性甲醛固定后石蠟包埋,連續切片后經HE和網狀纖維染色,由本院2位工齡大于10年的病理醫師分別讀片并根據肝病病理學標準評價肝纖維化程度。肝纖維化分期(S0~4期):S0期為肝臟無纖維化;S1期為肝匯管區纖維化,或僅有竇周纖維化,或僅有小葉內纖維化;S2期為肝匯管區和竇周纖維化,纖維間隔已形成,小葉結構大致正常;S3期為間隔形成,小葉結構紊亂;S4期為確診肝硬化。將S1~2期患者評定為肝纖維化早期患者,S3~4期患者評定為肝纖維化中、晚期患者。
1.4 統計學處理 采用SPSS18.0統計軟件對數據進行分析,計數資料比較采用χ2檢驗,計量資料比較采用t檢驗。變量間相關性分析采用Spearman相關性分析。通過繪制受試者工作特征(ROC)曲線,計算診斷的曲線下面積,確定最佳閾值,并計算敏感性和特異度,以P<0.05為差異有統計學意義。
2 結 果
2.1 乙肝組和健康對照組臨床病理特征和實驗室檢查比較 見表1。兩組年齡、性別和體質量差異無統計學意義。在肝纖維化分期上,乙肝患者中S0期患者18例,S1~2期27例,S3~4期17例。乙肝組患者ALT、AST和ACE水平均高于健康對照組,差異有統計學意義(P<0.05)。
2.2 肝纖維化不同分期患者相關指標比較 乙肝患者纖維化早期(S1~2期)患者ALT、AST和PLT與中、晚期(S3~4期)患者差異無統計學意義(P>0.05),APRI和ACE水平均低于纖維化中、晚期(S3~4期)患者,差異有統計學意義(P<0.05),見表2。相關性分析顯示,ACE水平與APRI呈正相關(r=0.48,P<0.05)。
2.3 APRI評分和ACE水平對乙肝肝纖維化的診斷價值 繪制ROC曲線,ACE對肝纖維化患者診斷的曲線下面積(AUC)為0.801(95%CI:0.706~0.896,P<0.05),高于APRI對肝纖維化的(AUC:0.676,95%CI:0.563~0.789,P<0.05。當ACE為48 U/L時,診斷靈敏度為68%,特異性為71%,見圖1。

表1 兩組臨床病理特征和實驗室檢查比較

續表1 兩組臨床病理特征和實驗室檢查比較
注:-表示無數據。
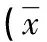
表2 肝纖維化不同分期患者相關指標比較±s)

圖1 APRI與ACE對肝纖維化患者的診斷價值
3 討 論
每年約100萬人死于乙肝病毒(HBV)感染導致的肝硬化和肝癌,由于肝臟中乙肝病毒的長期存在,高達40%的HBV感染患者被確診為肝硬化[4]。肝纖維化是肝硬化發展的前期病理基礎,也是肝硬化繼續惡化的主要原因之一。不僅如此,研究發現肝纖維化同時也是肝癌的主要危險因素之一。目前纖維化的診斷仍然依賴肝臟活組織檢查,但是此項檢查具有創傷性大、可能發生嚴重并發癥、局限性高等缺點,導致一部分乙肝患者因無法施行此項檢查而喪失早期發現纖維化的可能性。但大量研究表明,目前仍少有明確的血清學指標能夠代替肝臟活組織檢查,尋找可用的肝纖維化相關血清學指標仍受到研究者的高度關注[5]。
APRI是近年來西方國家用于診斷丙肝患者肝纖維化的無創診斷模型,研究發現其在乙肝肝纖維化患者中同樣具有診斷價值,但是確切的診斷應用仍具有爭議[6]。APRI計算方法簡單,僅包括2項臨床常見血清學指標的數值,可行性高,臨床使用范圍廣。但是,蔣忠勝等[7]發現,盡管APRI能夠用于肝纖維化的診斷,其對不同分期纖維化的診斷效果并不佳。
肝纖維化病理改變的基礎主要是肝內纖維組織過度增生,降解減少,肝實質結構大量破壞,最終引起廣泛纖維化[8]。新近研究認為,肝纖維化屬于可逆的病理改變,而肝硬化卻無法逆轉,如果對肝纖維化使用藥物干預,是有可能逆轉患者的纖維化程度,從而降低肝硬化的發生率。那么早期發現肝纖維化并評估患者肝纖維化程度顯得尤為重要。RAS系統是體內內分泌的重要調節軸,主要參與水和電解質代謝、血壓調節等正常生理過程。研究發現多數器官和組織也能合成RAS系統的組成分子,稱為局部RAS。局部RAS與內分泌系統中的RAS功能不同,主要參與組織結構的纖維化和重塑。研究發現,局部RAS在肝纖維化的發展中起調控作用,尤其是血管緊張素Ⅱ作為RAS系統中的關鍵分子,其通過旁分泌或自分泌的方式作用于成纖維細胞,促進成纖維細胞增生[9]。ACE可以促進血管緊張素Ⅰ轉化為血管緊張素Ⅱ,研究發現損傷的肝臟中RAS系統的成分包括血管緊張素Ⅰ和Ⅱ、ACE、醛固酮等均表達上調,可見局部RAS確實參與了肝纖維化的發展。此外,肝纖維化發展過程中肝星狀細胞被過度激活,表現出成纖維細胞的活性,產生大量的膠原纖維,這一過程受到血管緊張素Ⅱ的調控。研究發現阻斷肝內的血管緊張素Ⅱ產生似乎可以緩解肝纖維化的程度[10]。事實上,Corey等[11]發現,ACE抑制劑對于輕微纖維化的丙肝患者具有保護作用。因此,ACE不僅參與肝纖維化的發生和發展,同時也是治療的一個潛在靶點。本研究檢測了乙肝患者血清中ALT、AST、GGT、ALP、PLT和ACE水平,發現乙肝組患者ALT、AST和ACE水平均高于健康對照組,由此說明ACE確實在乙肝患者血in solid organ transplantation[J].Front Immunol,2012,3(2):184-189.
[18]Wing K,Yamaguchi T,Sakaguchi S.Cell-autonomous and-non-autonomous roles of CTLA-4 in immune regulation[J].Trends Immunol,2011,32(9):428-433.
[19]Sayo Y,Chikako T,Oya H,et al.Regulatory T-cell activation among patients who displayed operational tolerance following intra-portal administration of Donor-Specific antigens in living donor liver transplantation[J].Transplant Proc,2012,44(2):560-564.
[20]Zhang Y,Zhao H,Bo L,et al.Total body irradiation of donors can alter the course of tolerance and induce acute rejection in a spontaneous tolerance rat liver transplantation model[J].Sci China Life Sci,2012,55(9):774-781.
[21]Iyama S,Muease K,Sato T,et al.Narrowband ultraviolet B phototherapy ameliorates acute graft-versus-host disease by a mechanism involving in vivo expansion of CD4+CD25+Foxp3+regulatory T cells[J].Int J Hematol,2014,99(4):471-476.
[22]Xu HT,Xing TJ,Li H,et al.Association of T regulatory cells with natural course and response to treatment with interferon-alpha in patients with chronic hepatitis B infection[J].Chin Med J,2012,125(8):1465-1468.
[23]Garg G,Jennifer RT,Jennie HY,et al.Type 1 diabetes-associated IL2RAvariationlowers IL-2 signaling and contributes to diminished CD4+CD25+regulatory t-cell function[J].J Immunol,2012,188(9):4644-4653.
[24]Monteiro M,Almeida CF,Caridade M,et al.Identification of regulatory Foxp3+invariant NKT cells induced by TGF-beta[J].J Immunol,2010,185(4):2157-2163.
[25]Moreira-Teixeira L,Resende M,Devergne OA,et al.Rapamycin combined with TGF-beta converts human invariant NKT cells into suppressive Foxp3+regulatory cells[J].J Immunol,2012,188(2):624-631.
10.3969/j.issn.1672-9455.2015.09.046
A
1672-9455(2015)09-1294-02
2014-11-19
2015-01-26)

