慢性腎病患者抗氧化低密度脂蛋白抗體水平與炎性細胞因子表達的相關性研究
賴鈺明,張 琴
(四川省綿陽市三臺縣醫(yī)院腎臟內(nèi)科 621100)
?
·論 著·
慢性腎病患者抗氧化低密度脂蛋白抗體水平與炎性細胞因子表達的相關性研究
賴鈺明,張 琴△
(四川省綿陽市三臺縣醫(yī)院腎臟內(nèi)科 621100)
目的 探討慢性腎病患者抗氧化低密度脂蛋白(ox-LDL)抗體水平與炎性細胞因子表達的相關性。方法 收集慢性腎病患者50例,以及健康體檢者10例(對照組)作為研究對象。檢測研究對象血漿抗ox-LDL抗體水平,根據(jù)檢測結果將慢性腎病患者分為高滴度組(抗ox-LDL抗體滴度≥23 μg/mL,n=21)和低滴度組(抗ox-LDL抗體滴度<23 μg/mL,n=29),比較各組炎性細胞因子[干擾素(IFN)-α、IFN-β、IFN-γ、白細胞介素(IL)-6、IL-10、IL-12]基因表達水平。結果 與對照組相比,高滴度組和低滴度組IFN-α、IFN-β和IFN-γ均明顯升高(P<0.05)。低滴度組IL-6和IL-10較對照組有明顯升高(P<0.05),但高滴度組與對照組差異無統(tǒng)計學意義(P>0.05);高滴度組和低滴度組IL-12水平均明顯高于對照組,差異均有統(tǒng)計學意義(P<0.05)。結論 慢性腎病患者血中抗ox-LDL抗體升高程度與多個炎性因細胞子表達水平具有一定相關性,檢測慢性腎病患者血中抗ox-LDL抗體水平對了解疾病進程有重要的臨床價值。
慢性腎病; 氧化低密度脂蛋白; 細胞因子
血脂異常多見于免疫低下患者,如腎移植和骨髓移植患者,且他們更易出現(xiàn)動脈粥樣硬化[1]。研究表明,在免疫抑制患者中,心血管疾病導致的病死率高出健康人群10倍,其中氧化低密度脂蛋白(ox-LDL)在急性心肌梗死中表達上調(diào),由ox-LDL引發(fā)的動脈粥樣硬化是導致內(nèi)源性功能失調(diào)的關鍵因素[2]。ox-LDL通過多種生物學活性引發(fā)動脈粥樣硬化,包括影響一氧化氮合成、活化T淋巴細胞、誘導促粥樣化效應因子表達,同時ox-LDL可活化單核細胞并誘導轉化生長因子β(TGF-β)上調(diào),促進疾病進展[3]。
細胞因子在慢性腎病發(fā)生和發(fā)展中起重要作用,研究表明,慢性腎病患者血清白細胞介素(IL)-6水平明顯高于健康人,同時血清白細胞介素(IL)-8、IL-10和IL-18水平也明顯高于健康人,表明細胞因子在慢性腎病患者疾病進程中有重要作用[4]。目前關于ox-LDL的研究多集中于器官移植患者和腫瘤患者中,而慢性腎病患者中抗ox-LDL抗體陽性水平與炎性細胞因子的相關性研究較少。本研究選取50例慢性腎病患者作為研究對象,并以健康成年人作為對照,研究血漿抗ox-LDL抗體水平與炎性細胞因子[干擾素(IFN)-α、IFN-β、IFN-γ、IL-6、IL-10、IL-12]表達的關系,報道如下。
1 資料與方法
1.1 一般資料 選取2009年6月至2013年5月在本院確診為慢性腎病的患者50例,以及10例健康體檢者(對照組)作為研究對象。抽取患者和健康對照者抗凝血2 mL,1 500 r/min離心5 min分離血漿,于4 ℃保存待測。
1.2 方法
1.2.1 血漿抗ox-LDL抗體檢測 檢測試劑盒購自上海研吉生物有限公司(貨號 DRE10046)。(1)標準品的稀釋與加樣:在酶標包被板上設10個標準品孔,按試劑盒說明書進行倍比稀釋(稀釋濃度分別為180、120、60、30、15 μg/L)。(2)加樣:分別設空白對照孔和待測樣品空,空白對照孔不加樣品及酶標試劑,其余各步操作相同,在酶標包被板的待測樣品孔中先加樣品稀釋液40 μL,然后再加待測樣品10 μL。(3)溫育:用封板膜封板后置37 ℃溫育30 min。(4)加酶:除空白對照孔外,每孔加入酶標試劑50 μL。(5)顯色:每孔先加入顯色劑A 50 μL,再加入顯色劑B 50 μL,37 ℃避光顯色15 min。(10)終止:每孔加終止液50 μL,終止反應(此時藍色立刻轉為黃色)。(11)測定:以空白對照孔調(diào)零,檢測450 nm波長下各孔的吸光度(OD),測定應在加入終止液后15 min以內(nèi)進行。
1.2.2 RNA提取 采用Trizol法提取RNA:(1)在細胞中加入1 mL Trizol試劑,15~30 ℃下靜置5 min后加入0.2 mL氯仿;(2)室溫靜置3 min后,12 000×g離心15 min,棄上清液并加入0.5 mL異丙醇;(3)室溫靜置10 min后,12 000×g離心10 min,棄上清液并加入75%乙醇,12 000×g離心5 min;(4)棄上清液,空氣干燥后,加入100 μL滅菌后的超純水溶解。
1.2.3 PCR檢測 反轉錄試劑盒試劑盒(FSQ101)購自北京天根生物公司以完成cDNA合成,反轉錄PCR條件:65 ℃ 5 min,37 ℃ 15 min,98 ℃ 5 min。定量PCR試劑盒購自北京天根生物公司(FP202),PCR條件:95 ℃ 30 s;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s。共40個循環(huán);55~95 ℃采集熔解曲線。擴增反應采用貝克曼定量PCR儀完成。PCR擴增引物見表1,其中3-磷酸甘油醛脫氫酶(GAPDH)為內(nèi)參。定量PCR結果采用Bio-Rad iQ5軟件進行分析,按照文獻采用2-ΔΔCt法進行相對定量分析[7]。

表1 PCR擴增引物
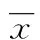
2 結 果
2.1 各組研究對象一般資料比較 本研究共納入慢性腎病患者50例,按照抗ox-LDL抗體滴度將其分為高滴度組(抗ox-LDL抗體滴度≥23 μg/mL,n=21)和低滴度組(抗ox-LDL抗體滴度<23 μg/mL,n=29)。高滴度組中性粒細胞水平較低滴度組及對照組略有升高,淋巴細胞則降低,其他指標無明顯差異(P>0.05),見表2。

表2 各組研究對象一般資料比較±s)
2.2 慢性腎病患者中炎性細胞因子基因表達變化 與對照組相比,高滴度組和低滴度組IFN-α、IFN-β和IFN-γ均明顯升高(P<0.05)。低滴度組IL-6和IL-10較對照組有明顯升高(P<0.05),但高滴度組與對照組差異無統(tǒng)計學意義(P>0.05);高滴度組和低滴度組IL-12水平均明顯高于對照組,差異均有統(tǒng)計學意義(P<0.05)。見圖1。

注:與對照組比較,*P<0.05,**P<0.01。
圖1 各組炎性細胞因子基因表達情況
3 討 論
慢性腎病的發(fā)病率呈逐步上升趨勢,該病具有進展迅速、篩查手段匱乏等特點,如未及時治療,將迅速發(fā)展至終末期腎衰,并可導致心血管疾病等多種嚴重并發(fā)癥。傳統(tǒng)診斷方法常以血肌酐和蛋白尿作為監(jiān)測腎功能的指標,但這2項指標的缺點在于難以準確反映腎臟受損程度[5]。目前已發(fā)現(xiàn)多個與慢性腎病發(fā)生、發(fā)展密切相關的生物學標志物,如胱抑素C、不對稱二甲基精氨酸、肝型脂肪酸結合蛋白,以及與心血病并發(fā)癥相關的標志物,包括心肌肌鈣蛋白、腦鈉肽、C反應蛋白、脂聯(lián)素等,均在慢性腎病早期診斷中顯示出良好的應用前景[6]。
ox-LDL是導致血脂異常及心血管疾病的重要因子之一,其致病機制為單核細胞分泌多個趨化因子,在活性氧參與下氧化為ox-LDL;同時還通過上調(diào)內(nèi)皮細胞因子,增加血小板聚集影響凝血系統(tǒng),從而促進心血管疾病進展。ox-LDL還通過細胞毒性作用,加速血液單核細胞進入內(nèi)膜使細胞損傷加劇。血漿ox-LDL水平升高可增加動脈壁基質(zhì)表達,促進動脈粥樣硬化發(fā)生;ox-LDL還可通過直接或間接滅活一氧化氮的作用使內(nèi)皮細胞功能調(diào)節(jié)異常[7]。但ox-LDL在慢性腎病中的研究還較少,對其在慢性腎病發(fā)生、發(fā)展中的作用也尚未清楚。
IL-6、IL-8和IL-10等炎性細胞因子主要由單核或巨噬細胞產(chǎn)生,是參與機體炎性反應和一系列生理過程的重要因子。劉從江等[8]研究表明,慢性腎病患者IL-6、IL-8、IL-10、IL-18的基因表達水平明顯高于對照組,其機制是由于腎組織內(nèi)炎性細胞浸潤、多種細胞因子及氧自由基等共同作用從而引起腎組織結構受損。范廣忠等[9]研究也發(fā)現(xiàn),IL-6、IL-8、TNF-α等炎性細胞因子在早期糖尿病腎病患者中的表達水平明顯升高,表明炎性細胞因子在慢性腎病的病理進程中有重要作用。本研究選取50例慢性腎病患者進行血清抗ox-LDL抗體檢測,并根據(jù)檢測結果將患者分為高滴度組和低滴度組,用定量PCR法檢測患者多個炎性細胞因子的基因表達情況,結果提示抗ox-LDL抗體滴度升高似乎在慢性腎病患者中是一種保護性因素,可延緩炎性反應的發(fā)生。Yang等[10]研究也發(fā)現(xiàn),血漿ox-LDL水平變化與白血病患者的多個細胞因子和趨化因子的表達呈明顯負相關。但根據(jù)本研究結果就下此結論為時過早,在后續(xù)研究中將根據(jù)ox-LDL血漿水平并結合炎性細胞因子水平,監(jiān)測患者病情進展及其對治療效果和預后的影響,并根據(jù)臨床隊列研究得出ox-LDL與腎病進展的相關性,從而指導臨床實踐。
[1]Chadban S,Chan M,Fry K,et al.The CARI guidelines.Protein requirement in adult kidney transplant recipients[J].Nephrology (Carlton),2010,15 Suppl 1:S68-71.
[2]Diao Y,Li H,Li H,et al.Association of serum levels of lipid and its novel constituents with the different stages of esophageal carcinoma[J].Lipids Health Dis,2009,8(1):48.
[3]Li H,Diao YT,Li HQ,et al.The association between serum levels of oxLDL-lgG and oxLDL-lgM autoantibody with adult acute myeloblastic leukaemia[J].Lipids Health Dis,2010,9(1):11.
[4]Antonov AS,Munn DH,Kolodgie FD,et al.Aortic endothelial cells regulate proliferation of human monocytes in vitro via a mechanism synergistic with macrophage colony-stimulating factor.Convergence at the cyclin E/p27(Kip1) regulatory checkpoint[J].J Clin Invest,1997,99(12):2867-2876.
[5]Vassalotti JA,Stevens LA,Levey AS.Testing for chronic kidney disease:a position statement from the National Kidney Foundation[J].Am J Kidney Dis,2007,50(2):169-180.
[6]Zahran A,El-Husseini A,Shoker A.Can cystatin C replace creatinine to estimate glomerular filtration rate? A literature review[J].Am J Nephrol,2007,27(2):197-205.
[7]岳福仁.氧化型低密度脂蛋白與動脈粥樣硬化關系的研究[J].菏澤醫(yī)學專科學校學報,2012,24(1):67-69.
[8]劉從江,李芬,張磊,等.慢性腎病患者細胞因子測定的臨床意義[J].放射免疫學雜志,2008,21(6):514-515.
[9]范廣忠,高文杰,鄭雪峰,等.檢測糖尿病腎病患者血清細胞因子的意義[J].中國實用醫(yī)刊,2012,39(13):33-35.
[10]Yang HQ,Qiu FQ,Jin K,et al.High plasma levels of oxidatively modified low-density lipoproteins are associated with the suppressed expression of immunomodulatory molecules in patients with hematological malignancies[J].Exp Ther Med,2015,9(6):2394-2400.
Correlation study between the anti-ox-LDL antibody level and cytokine expression in patients with chronic kidney disease
LAIYu-ming,ZHANGQin△
(DepartmentofNephrology,CountyHospitalofSantai,Mianyang,Sichuan621100,China)
Objective To explore the relationship of the anti-ox-LDL antibody level and cytokine expression in patients with chronic kidney disease.Methods 50 cases of patients with chronic kidney disease were enrolled,and 10 healthy people were selected as control group.The plasma levels of anti-ox-LDL antibody were detected.According to the results,the patients with chronic kidney disease were divided into high titer group (anti-ox-LDL antibody≥23 μg/mL,n=21) and low titer group (anti-ox-LDL antibody<23 μg/mL,n=29).The gene expression levels of inflammatory cytokines (IFN-α,IFN-β,IFN-γ,IL-6,IL-10 and IL-12) in each group were compared.Results Comparing with control group,the levels of IFN-α,IFN-β and IFN-γsignificantly increased in both high titer group and low titer group (P<0.05).The levels of IL-6 and IL-10 of low titer group were significantly higher than control group (P<0.05),however,those of high titer group were not significantly different from control group (P>0.05).The IL-12 levels of higher titer group and low titer group were significantly lower than that of control group (P<0.05).Conclusion The increase of anti-ox-LDL antibody in patients with chronic kidney disease related with the expression of many inflammatory cytokines.The detection of anti-ox-LDL antibody was important to understand the progression of chronic kidney disease.
chronic renal disease; oxdidatively modified low-density lipoprotein; cytokine
賴鈺明,男,本科,主治醫(yī)師,主要從事腎臟疾病診治及血液透析血管通路研究。△
,E-mail:15228711845@163.com。
10.3969/j.issn.1672-9455.2015.20.041
A
1672-9455(2015)20-3075-03
2015-05-15
2015-08-10)

