VITROS 5600分析儀檢測3項心肌損傷標志物的性能評價
吳金斌,歐嘉文(北京大學深圳醫院檢驗科,深圳 518036)
?
·臨床探討·
VITROS5600分析儀檢測3項心肌損傷標志物的性能評價
吳金斌,歐嘉文
(北京大學深圳醫院檢驗科,深圳 518036)
目的 驗證和評價化學發光法檢測心肌損傷標志物肌鈣蛋白I(cTnI)、肌紅蛋白(Myo)、肌酸激酶同工酶質量(CK-MBmass)的分析性能。方法 參考NCCLS發布的方法學評價系列文件,對強生VITROS5600分析儀免疫模塊化學發光法檢測心肌損傷標志物3項的正確度、精密度、線性范圍和參考區間進行驗證與評價。結果cTnI、Myo和CK-MBmass正確度驗證偏倚分別為-3.75%~4.58%、-4.10%~-1.04%和2.90%~1.63%,批內精密度分別0.89%~3.33%、0.90%~0.94%和1.10%~1.74%,天間精密度分別為1.53%~6.45%、2.2%~2.80%和1.45%~2.06%,各項目呈一次性線性關系,相關系數(r)分別為0.999 2、0.998 6和0.999 0(P<0.05);按性別分組驗證各項目的參考區間,結果顯示大于95%的檢測值在廠家提供的生物參考區間范圍內。結論 強生VITROS5600分析儀化學發光法檢測3項心肌損傷標志物的主要分析性能達到了廠商聲明的性能和有關的質量要求,能夠滿足臨床需要。
肌鈣蛋白I; 肌紅蛋白; 肌酸激酶同工酶質量; 化學發光法; 性能評價
急性冠狀動脈綜合征(ACS)是由急性心肌缺血所致的以胸悶、胸痛為主要臨床表現的心血管疾病,它對患者的生命和健康構成嚴重威脅,早期診斷和及時治療是降低病死率和改善預后的關鍵。因此,快速、靈敏、準確地檢測心肌損傷生化標志物對于ACS的診療具有非常重要的意義[1]。為了向臨床提供準確、可靠的檢驗結果,本試驗依照ISO15189《醫學實驗室質量和能力認可準則》的要求[2],參考美國臨床實驗室標準化委員會(NCCLS)指南EP15-A2、EP5-A2、EP6-A2和C28-A2文件[3-6],結合工作實際設計驗證方案,對強生VITROS 5600分析儀化學發光法檢測肌鈣蛋白I(cTnI)、肌紅蛋白(Myo)、肌酸激酶同工酶質量(CK-MB mass)的分析性能進行驗證和評價。
1 材料與方法
1.1 標本來源 試驗血漿選取2014年8~9月北京大學深圳醫院住院患者符合試驗要求且無溶血、黃疸、脂血的標本。
1.2 儀器與試劑 檢測系統使用強生公司VITROS 5600生化免疫分析儀及其配套試劑和校準品。
1.3 方法
1.3.1 正確度驗證 參照EP15-A2文件,對校準后并且室內質控在控的試驗項目進行非同一批次的定值校準品(2份)和衛生部臨檢中心發放2014年第1次心肌損傷標志物的質評樣品(5份)各測定2次,將測定均值與相應校準品標定值、質評靶值相比較,以相對偏差小于該項目臨檢中心質評允許誤差范圍的1/2(<±15%)為可接受。

1.3.3 線性驗證 參考 EP6-A2文件,設定各項目試驗線性的允許誤差范圍為5.0%。分別收集cTnI、Myo、CK-MB mass各項目濃度接近廠商聲明分析測量范圍的下限和上限的低值標本(L)和高值標本(H),然后按L、4L+1H、3L+2H、2L+3H、1L+4H、H配制成6個系列濃度的標本,按照從低濃度到高濃度順序測定1次,再從高濃度到低濃度順序測定1次,在重復測定誤差符合要求的條件下,進行多項式回歸分析,將數據擬合為一次(Y=b0+b1X)、二次(Y=b0+b1X+b2X2)和三次(Y=b0+b1X+b2X2+b3X3)多項式,根據t值判斷擬合曲線的非線性系數 (b2和b3)與 0的差異是否有統計學意義,如果非線性系數b2和b3與0比較差異無統計學意義(P>0.05),則認為存在線性關系,否則該組數據存在非線性,則要進行非線性度的評價。
1.3.4 參考區間驗證 按NCCLS C28-A2推薦的方法,從2014年8~9月在本院體檢的人群中,選取年齡分布在18~70歲,排除心腦血管疾病,并且肝、腎功能正常的男性和女性健康體檢者血清標本各20例,按照標準操作程序(SOP)要求在VITROS 5600分析儀上進行心肌損傷標志物3項的檢測,在分組統計中,有95%(≥19例)的檢測結果在廠商提供的參考區間內即表明該參考區間適用于本實驗室。
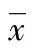
2 結 果
2.1 正確度驗證結果 檢測cTnI、Myo、CK-MB mass的定值校準品和衛生部臨檢中心2014年第1次心肌損傷標志物質評樣品,分別將測定均值與標準品標定值和質評靶值相比較。結果顯示,各項目各濃度水平的偏倚程度均小于臨檢中心質評允許誤差范圍的1/2(<±15%),驗證通過。見表1、2。

表1 檢測定值標準品正確度驗證

表2 檢測質評標本正確度驗證
2.2 精密度驗證結果 3個項目低、高濃度標本的批內、天間不精密度驗證結果見表3~5,各項目各濃度水平的批內和天間精密度均小于廠商標示的相應濃度水平的CV值。

表3 cTnI批內和天間精密度驗證

表4 Myo批內和天間精密度驗證
2.3 線性驗證結果 cTnI、Myo、CK-MB mass的線性范圍和6個系列濃度標本重復測定結果均值見表6,經計算重復檢測集合方差(SDr)分別為0.48%、0.28%、0.35%,小于實驗室設定允許誤差范圍5.0%。SSPSS 19.0統計軟件多項式回歸數據擬合結果顯示,項目各指標b2、b3與0比較差異均無統計學意義(P>0.05),為一次線性;cTnI線性方程為Y=1.020 8X-0.624 2,R2=0.998 4(P<0.05);Myo線性方程為Y=1.018 1X+1.228 5,R2=0.997 3(P<0.05);CK-MB mass線性方程為Y=1.022 4X-2.138 9,R2=0.998(P<0.05)。各項目試驗線性范圍與廠家聲明的線性范圍基本一致。
2.4 參考區間驗證結果 依NCCLS C28-A2推薦的方法,驗證現用廠家提供的生物參考區間,各項目參考區間及驗證結果見表7,結果顯示在不同性別組各20例健康參考個體中,Myo的男性組有1例超出廠商提供的參考區間(126 ng/mL),其余各項目各組驗證結果均在廠商提供的參考區間內,各項目參考區間驗證符合率不低于95%,說明廠家提供的生物參考區間適合于本實驗室使用。

表5 CK-MB mass批內和天間精密度驗證

表6 心肌損傷標志物三項線性范圍及驗證值(ng/mL)

表7 3項心肌損傷標志物參考區間驗證結果
3 討 論
對分析系統的主要檢測性能進行驗證,是保證檢驗質量的一個重要措施,也是《醫療機構臨床實驗室管理辦法》和醫學實驗室ISO15189《醫學實驗室質量和能力認可準則》的要求。本研究對強生VITROS 5600分析儀檢測cTnI、Myo和CK-MB mass 3個項目的正確度、精密度、線性和參考范圍分別進行了驗證。
正確度是多次重復檢測所得量值的平均值與一個參考量值間的一致程度。通常用“偏移”(或偏倚)表達,是對系統誤差的衡量。本試驗按照NCCLS EP15-A2文件執行正確度驗證,采用廠商提供的可溯源定值校準品和衛生部臨床檢驗中心指定值的質評物作為參考物質進行驗證。通常生化定量測定項目以美國臨床實驗室修正法規(CLIA′88)允許總誤差的1/2作為允許偏倚[7],由于CLIA′88中沒有對cTnI、Myo和CK-MB mass 3個項目的允許總誤差進行規定,因此本試驗以小于臨檢中心質評允許誤差范圍的1/2作為判斷標準。
精密度是在規定條件下,對同一被測對象重復測量所得值間的一致程度,是對隨機誤差的衡量。檢測系統的精密度是所有分析性能評價的基礎,本試驗采用EP5-A2文件驗證廠商的精密度聲明,考慮到基質效應,每個驗證項目均采用健康人低值新鮮混合血清稀釋高值樣品,配制濃度范圍包括了廠商聲明的濃度和醫學決定水平處的濃度。指定范圍的低濃度標本的天間精密度水平反映了檢測系統的功能靈敏度,在cTnI、Myo和CK-MB mass參考范圍上限濃度處,天間精密度驗證結果分別為 6.45%、2.80%、2.06%,符合準則[8]和共識[9]中對參考范圍上限濃度處功能靈敏度的要求(cTnI 第99百分位值:0.034 ng/mL,CV≤10%;Myo第97.5百分位值:61.5 ng/mL,CV≤5.6%;CK-MB mass第97.5百分位值:61.5 ng/mL,CV≤9.3%)。
線性范圍即分析測量范圍(AMR),是指標本沒有經過任何預處理(濃縮或稀釋)能夠直接測定出待測物的范圍,是反映方法學性能評價的重要指標之一。本試驗應用NCCLS EP6-A2文件驗證廠商聲明的AMR,分析6個基本覆蓋整個預期測量范圍的系列濃度標本,在重復測量誤差符合試驗要求的條件下(≤5.0%)進行多項式回歸分析,驗證結果顯示,各項目在試驗所涉及的濃度范圍內線性關系良好。
本試驗按NCCLS C28-A2文件推薦的方法,每個項目按性別分為男、女兩組,各選取了20例符合試驗要求的健康體檢者的血清標本,驗證了cTnI、Myo和CK-MB mass試劑說明書中廠商提供的參考區間。驗證結果在Myo的男性組中僅有1例超出廠商提供的參考區間,各項目及其分組參考區間驗證符合率均不低于95%,符合NCCLS C28-A2文件要求,判定廠家提供的生物參考區間適用于本實驗室。
綜上所述,VITROS 5600分析儀檢測3項心肌損傷標志物的主要分析性能驗證結果與廠商聲明的性能參數基本一致,符合相關文件規定和質量要求,能夠為臨床提供準確、可靠的檢驗結果,對ACS的診斷和治療提供重要的參考信息。
[1]鄢盛愷.高敏感心肌肌鈣蛋白檢測的臨床應用[J].中華檢驗醫學雜志,2010,33(9):809-813.
[2]International Organization for Standardization.ISO 15189.Medical laboratories-Particular requirements for quality and competence [S].Geneva:ISO,2007.
[3]NCCLS.EP15-A2.User demonstration of performance for precision and accuracy[S].Wayne,PA,USA:NCCLS,2004.
[4]NCCLS.EP5-A2.Evaluation of precision performance of quantitative methods;approved guideline-second edition[S].Wayne,PA,USA:NCCLS,2004.
[5]NCCLS.EP6-A2.Evaluation of the linearity of quantitative measurement procedures[S].Wayne,PA,USA:NCCLS,2003.
[6]NCCLS.C28-A2.How to define and determine reference intervals in the clinical laboratory;approved guideline-second edition[S].Wayne,PA,USA:NCCLS,2000.
[7] 中華人民共和國衛生部.WS/T 403-2012.臨床生物化學檢驗常規項目分析質量指標[S].北京:中華人民共和國衛生部,2012.
[8]楊振華,潘柏申,許俊堂.中華醫學會檢驗學會文件心肌損傷標志物的應用準則[J].中華檢驗醫學雜志,2002,25(3):185-189.
[9]胡大一.超敏心肌肌鈣蛋白在急性冠狀動脈綜合征中的應用中國專家共識[J].中華心血管病雜志,2012,40(10):809-811.
10.3969/j.issn.1672-9455.2015.21.051
A
1672-9455(2015)21-3256-04
2015-01-13
2015-06-29)

